聚焦高考化学易错知识点(一)
卢国锋

化学基础知识是学生体验化学研究过程、掌握科学方法、形成科学态度和价值观的载体,对知识的正确理解与应用是对科学素养高低的一种界定.本文将知识分类与典型错误有序结合,从知识的记忆、理解、应用三维视角分析产生错误的原因并纠正.
易错点1:联系STS(科学、技术、社会)知识模块
错因分析缺乏理论联系实际的自主学习能力,不能复述再现常识性的数据和知识.
(1)酶具有很强的催化作用,胃蛋白酶只能催化蛋白质的水解,348 K时活性更强(×)
348K转化摄氏温度75℃催化活性降低.
(2)丙烷比丁烷更易液化(×)
易液化是指沸点高,结构相似的分子晶体相对分子质量越大熔沸点越高.
(3)合成纤维、人造纤维及碳纤维都属于有机高分子材料(×)
碳纤维跟石墨很相近,是由一层层以六角型排列的碳原子所构成,碳纤维也能导电.
(4)2011年诺贝尔化学奖的贡献,是发现了准晶体,化学式为Al63Cu24Fe13的准晶体不可与稀硝酸发生反应(×)
Al63Cu24Fe13的准晶体所含元素都能与稀硝酸反应.
(5)2013年诺贝尔化学奖的贡献,是开发多尺度复杂化学系统模型,催生了现代化学研究手段的一次新飞跃.属于现代化学对物质结构研究的手段还有X射线、红外光谱、质谱、核磁共振(√)
X射线用于晶体与非晶体结构的判断,红外光谱用于获得化学键或官能团信息,质谱法用于相对分子质量的测定,核磁共振氢谱用于氢原子种类的判断.
(6)PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,这些细颗粒物分散在空气中形成混合物属于胶体(×)
含2.5pm颗粒物的空气不能形成胶体,它在空气中混合形成的是浊液,通常把粒径在10微米以下的颗粒物称为PM10,又称为可吸入颗粒物或飘尘.
易错点2:基本概念模块
1.物质的组成和分类模块
错因分析分类标准含糊,概念部分文字相似产生混淆.
(1)淀粉、纤维素和油脂都属于天然高分子化合物(×)
有机高分子化合物的相对分子质量104~106,单糖、二糖、氨基酸、油脂的相对分子质量在1000以下属低分子有机物.
(2)直径介于1nm~100nm之间的微粒称为胶体(×)
如果直径介于1nm~100nm之间的微粒没有形成分散系,不是胶体.
常见的混合物:漂白粉、铝热剂、水玻璃、氨水、氯水、王水、爆鸣气、水煤气、石油气、裂解气、焦炉气、福尔马林,没有纯净的NO2存在,因存在平衡:2NO2N2O4.纯净物概念是指同种物质组成的,因同素异形现象,由同种元素组成的物质,可能是混合物;因同分异构现象,分子式相同的物质,可能是混合物;从性质看纯净物具有固定熔沸点的物质,逆命题也成立.
(3)焰色反应、显色反应、颜色反应都是化学反应(×)
焰色反应是物理变化,类似的还有分馏、电泳、盐析、萃取,而干馏、电解、电镀、氧化、钝化、裂化、裂解、炭化、皂化、硫化、氢化(硬化)、酯化、变性是化学变化.
(4)乙二酸乙二酯、乙二酸二乙酯、二乙酸乙二酯属同分异构体(×)
三物质的碳原子数分别为4、6、6,故不可能为同分异构体.同位素、同系物、同分异构体、同素异形体、同类物质、同一物质,宜对同类概念“异”的挖掘.
(5)金属氧化物均为碱性氧化物(×)
金属氧化物从组成上定义的,碱性氧化物从性质上定义的,Al2O3是两性氧化物,Mn2O7是酸性氧化物.类似的还有难溶电解质与强电解质,酸的强弱、酸性的强弱、酸的浓度、pH,列表对比清晰明了.
2.常用物理量模块
错因分析确定结构微粒方法不当,或未察觉隐含微粒.漠视气体摩尔体积和气体定律使用的条件.
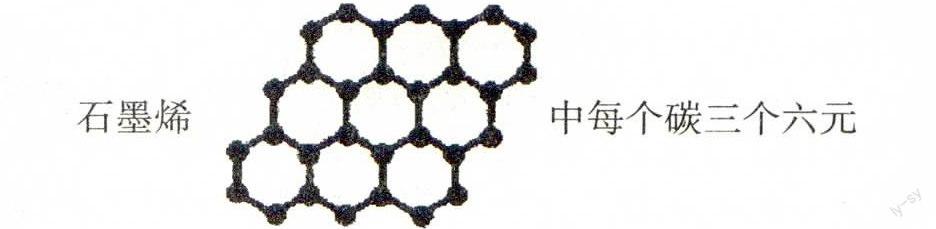
(1)12 g石墨烯(单层石墨)中含有六元环的个数0.5NA(√)
石墨烯中每个碳三个六元环共用,平均每个六元环拥有2个碳原子,12 g石墨烯中含有六元环的个数为12 g/12g·mol-1×2NA=0.5NA.晶体结构要用分摊法确定晶胞,气态团簇分子,即是一个大分子,不能用分摊法计算.
(2)可逆反应
①X(g)+2Y(g)2Z(g)
②2M(g)N(g)+P(g)
分别在密闭容器的两个反应室中进行, 反应室之间有无摩擦、可滑动的密封隔板.反应开始和达到平衡状态时有关物理量的变化如图1,达平衡时体系的压强与反应开始时体系的压强之比为14∶15(×)
图1
错解②反应前后气体化学计量数不变,压强的变化是反应①引起的.
根据
p1p2=
n1n2,
p后p前=
2.83=
1415.
错因在于此条气体定律成立条件是体积不变,左右两侧体积变化了.
正确解法隔板不动,左右两侧压强相等,
V左V右
=n左n右
2.82.2=
n左2 moln左=
2811,
整体的体积不变,
p后p前=
2+28113+2=1011.
(3)0.5 mol/L Na2CO3溶液中含有的CO2-3数目小于0.5 NA(×)
Na2CO3溶液的CO2-3水解离子浓度降低,但不知溶液的体积,无法计算确定离子数目是大于还是小于0.5 NA.
3.分散系模块
错因分析胶体胶粒不分,主观认为胶体只有氢氧化铁胶体,并将其性质应用到所有胶体,如电泳现象扩展到淀粉有机高分子溶于水形成的胶体,它的胶体粒子不带电荷.溶液中溶质若是非电解质,除了水的电离,不会有带电粒子.
(1)在含硅原子数为0.0010NA的硅酸胶体中,胶体粒子为0.0010 mol(×)
胶体中分散质有两种,一种是高分子微粒,一个分子就能达到1 nm~1001 nm,另一种胶体粒子是微粒的集合体,几十或几百个硅酸分子形成一个胶粒,其数目小于0.0010 mol.
(2)向硅酸钠溶液中滴入稀盐酸得到胶体:Na2SiO3+2HClH2SiO3(胶体)+2NaCl;离子方程式2H++SiO2-3H2SiO3(胶体) (√)
胶体制备实验,将Na2SiO3饱和溶液按1∶2或1∶3的体积比用水稀释,滴入酚酞,边逐滴加入稀盐酸边振荡至红色接近消失,化学方程式必须对硅酸标注胶体.水解法制备氢氧化铁胶体至红褐色,停止加热,防止胶体聚沉FeCl3+3H2O(沸水)△Fe(OH)3(胶体)+3HCl.
易错点3基本理论模块
1.物质结构和元素周期律
错因分析质量数与元素的相对原子质量概念不同,在计算物质的量时可以用质量数近似替代摩尔质量.质子数和电子数只有在净电荷为零才相等.核外电子排布中核外电子数、内层电子数、最外层电子数,利用它们之间的倍数、分数、和差关系推断易错.理解金属性非金属性强弱标准出现偏差.元素周期律在应用时共性与递变性不能兼顾.位构性推断时特性知识积累不足.
(1)已知A2-核内有x个中子,A原子的质量数为m,则n g A2-所含电子的物质的量是n(m-x+2)mmol(√)
质子数=质量数-中子数=m-x,阴离子核外电子数=质子数+离子电荷数,核外电子数=m-x+2.
(2)已知第三周期元素M,其原子最外层达到饱和时所需的电子数小于次外层与最内层电子数之差,且等于最内层电子数的正整数倍,M的最高价氧化物对应的水化物都是强酸(×)
第三周期元素第一层有2个电子,第二层有8个电子,最内层电子数的正整数倍分别为4、6,原子最外层达到饱和所需的电子数分别为4和2小于6,M可能是S,也可能是Si.
(3)Na2S溶液的pH大于NaCl溶液的pH说明氯元素的非金属性比硫元素强(×)
最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强(除氟元素之外).Na2SO4溶液的pH,小于Na2CO3溶液的pH,非金属性:S>C.
(4) Tl是某超导材料的组成元素之一, Tl3++2AgTl++2Ag+.推知Tl+的最外层有1个电子,Tl3+的氧化性比Al3+弱(×)
铊是第ⅢA元素,最外层电子数是3个,根据方程式可知Tl3+的氧化性强于Ag+,所以Tl3+的氧化性比Al3+强.(转下期)
(收稿日期: 2014-03-15)

