微囊化胰岛素产生细胞的胰岛素释放情况观察
王雅光 田鹤 穆长征
[摘要] 目的 微囊化后胰岛素产生细胞(IPCs)的分泌能力的观察。 方法 分离培养小鼠骨髓间充质干细胞(BM-MSCs)并传代纯化,应用大鼠胰腺损伤提取物(RPE)进行诱导分化,诱导后的细胞随机分成微囊化组和未微囊化组;分别在1、2、3、5、10、15、20、25、30天对微囊化组、未微囊组及BMMSCs组进行胰岛素释放的检测。 结果 1、2、3、5天微囊化组和未微囊化组都有胰岛素释放并呈上升趋势,两组之间没有明显差异;10 d以后未微囊化组胰岛素释放量有下降的趋势,而微囊化组在第20天胰岛素的释放量开始下降,BM-MSCs组没有胰岛素的释放。 结论 微囊不会影响细胞的存活,并且能够延长细胞的存活时间和增加细胞的分泌能力。
[关键词] 骨髓间充质干细胞;胰岛素产生细胞;微囊化
[中图分类号] R329.2 [文献标识码] A [文章编号] 1673-9701(2015)15-0008-03
[Abstract] Objective To study the effects of micro-capsule on the secretion capacity of insulin-producing cells(IPCs). Methods Stem cells from originate mouse bone marrow mesenchymal were isolated,induced and purified. Rat pancreatic extract(RPE) was extracted from pancreases of rats. BMMSCs were induced by rat pancreatic extract. The induced cells were randomly divided into micro-encapsulated group and non-micro-encapsulated group. The experiment of glucose stimulation was performed to detect the level of insulin,respectively, at different time points(1, 2, 3, 5, 10, 15, 20, 25, 30 day). Results The level of insulin secretion was increased after 1, 2, 3, 5 days of culture in micro-encapsulated IPCs and non-micro-encapsulated IPCs,but there were no significantly differences among the groups. The level of insulin secretion was declined in non-microencapsulated IPCs at 10 day,while there was no decreased in micro-encapsulated IPCs until 20 days. Conclusion The micro-capsule can promote the effect duration of IPCs,which supports the function of IPCs.
[Key words] Bone marrow mesenchymal stem cells(BMMSCs);Insulin-producing cells(IPCs);Micro-capsule
近年来糖尿病是影响人们健康的疾病之一,根据有关数据统计1型糖尿病患者约占10%。虽然可以使用外源性胰岛素来进行治疗,但血糖还是不能被控制到理想水平。近年随着干细胞技术的不断发展,为糖尿病的治疗开辟了一条新的途径。研究发现RPE能成功地将小鼠BMMSCs诱导为IPCs[1],诱导后的细胞毒性反应比较低,并且这种诱导方法的效率也比较高。前期的实验中本课题组也已经成功利用RPE将BMMSCs诱导成IPCs[2]。但是由于受到各种因素的影响,使IPCs的分泌时间不是很稳定;于是我们采用了新兴的微囊技术,微囊具有的半通透性且囊内细胞的自由空间可以控制[3];所以我们将在体外培养观察微囊包裹的IPCs的胰岛素分泌时间及分泌量的变化。现报道如下。
1 材料与方法
1.1 材料来源
于2009年3月~2011年3月期间由辽宁医学院实验动物中心提供的5 w龄SD大鼠(雌雄均可),由中国医科大学实验动物中心提供的SPF级4~8 w龄的昆明小鼠[雌雄均可,生产许可SCXK(辽)2008-0005]。IMDM培养基购自Hyclone公司,胰蛋白酶购自Amresco公司,胎牛血清购于Jibco公司,海藻酸钠购自Sigma公司,多聚赖氨酸购自Biosharp公司,胰岛素放射免疫试剂盒购自上海晨易生物公司,兔抗小鼠胰岛素抗体购自北京博尔西科技公司。
1.2大鼠胰腺损失提取物的制备
取SD大鼠(5 w龄),用10%水合氯醛腹腔麻醉,切除2/3的胰腺,待48 h后处死大鼠并取出损伤的胰腺,PBS冲洗、剪碎、速冻之后加PBS在4℃高速离心以后取上清,BCA法分析上清液的蛋白含量,将检测之后的上清液冻存、备用。
1.3 骨髓间充质干细胞的培养、诱导分化及鉴定
1.3.1 骨髓间充质干细胞的培养 昆明小鼠脱颈处死以后,在无菌状态用1 mL IMDM培养基(培养基中含15% FBS、12 μM的L-谷氨酰胺、1%抗生素)冲出股骨和胫骨骨髓腔中的骨髓。离心后接种到25 cm2培养瓶内(细胞密度为1×106/mL),放于37℃、5%CO2培养箱中培养。待90%的细胞融合后,进行传代纯化,此时的细胞记作P1,做诱导分化实验取P3细胞[4]。
1.3.2 诱导分化及鉴定 取出培养传代后的骨髓间充质干细胞加入50 mg/g的大鼠胰腺提取液,诱导分化1周后,一部分进行双硫腙检测,另一部分做细胞免疫荧光检测;双硫腙检测在原培养瓶内,加入双硫腙染色工作液(10 g/L),37℃,水浴10 min后,镜检[5];免疫荧光检测取分化后的细胞,离心、固定、PBS冲洗后,封闭1 h,加一抗(兔抗小鼠胰岛素抗体),室温孵育1 h,PBS冲洗,然后加二抗(FITC标记山羊抗兔IgG抗体)室温孵育1 h,镜检[6]。
1.4 微囊化IPCs的制备
将诱导以后的IPCs置于1.8%海藻酸钠溶液中,同时调节注射泵(70 mL/h)、气流的速度(5 L/min)、海藻酸钠浓度及液面的高度。使用气体微囊发生器,将含有IPCs的海藻酸钠溶液喷入100 mmol/L CaCl2溶液中,形成钙珠以后,用多聚赖氨酸包裹(浓度为0.05%),将其用生理盐水冲洗过后,再放入海藻酸钠溶液(浓度为0.14%)里,再经柠檬酸钠处理以后就获得了微囊化的IPCs,然后放入六孔板中培养箱培养。 1.5 微囊化IPCs、未微囊IPCs及BMMSCs胰岛素分泌情况的检测
分别取BMMSCs、微囊化IPCs和未微囊化的IPCs悬液各3 mL。根据前人提出的方法[7],刺激细胞和微囊用25 mM的葡萄糖,检测时间点分别是1、2、3、5、10、15、20、25、30天。在放免仪上测定各管沉淀的放射性计数(cpm)。经计算机数据处理以后,计算出样品的含量。
1.6 统计学处理
采用SPSS 13.0统计学软件进行分析,计量资料以(x±s)表示,不同时点比较采用F检验,P<0.05为差异有统计学意义。
2 结果
2.1骨髓间充质干细胞诱导分化的检测结果
原代的BMMSCs形状大不相同,经传代纯化后的BMMSCs形态比较规则均一,呈长梭形(a);RPE诱导分化后的BMMSCs经双硫腙检测呈猩红色(b),核不着色;提示细胞内含有锌离子,有胰岛素的合成;细胞免疫荧光显示细胞内有胰岛素表达,呈绿色荧光(c),见封三图1。
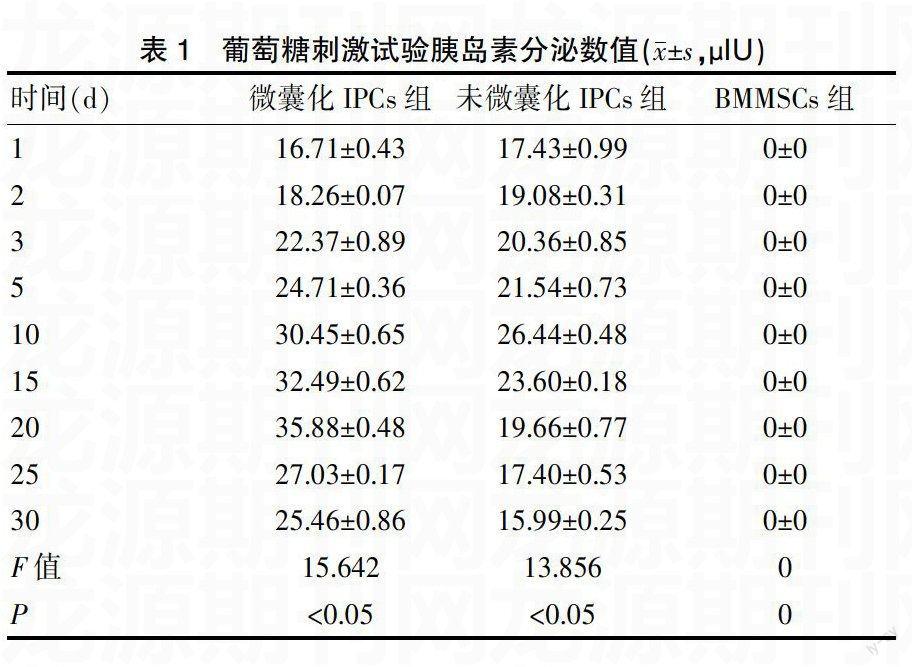
2.2不同时间点三组细胞胰岛素分泌结果的显示
在25 mM葡萄糖的刺激下,微囊化的IPCs和未微囊化IPCs均随着葡萄糖的刺激释放胰岛素,BMMSCs不分泌胰岛素,15 d的未微囊化组胰岛素释放量开始减少,25 d微囊化组胰岛素释放量开始减少;从结果上看IPCs是具有分泌胰岛素功能的,且微囊并不会影响胰岛素的释放,见表1。
3 讨论
BMMSCs具有较强的多向分化功能以及自我更新的能力,属于成体干细胞的一种[8-10]。RPE作为本实验所选用的诱导剂,是因其优点较多,如成本很低、作用温和,最主要的是胰岛素分泌的量较大、细胞存活率也较高。从双硫腙的染色和细胞免疫荧光结果来看,本实验诱导出的IPCs与小鼠胰岛细胞相比没有差别[11];微囊是一种半透膜,能够使小分子物质自由出入,同时又能阻止大分子进入;不但能满足细胞的生长需要且又不影响其功能,微囊有体积小、制作方法较简单等优点,并且膜内细胞的自由空间可控制[12];本实验通过对微囊化组、未微囊化组及BMMSCs组细胞葡萄糖刺激检测胰岛素的分泌情况显示,第1、2、3、5天微囊化组和未微囊化组胰岛素的释放量并没有明显差别,10 d未微囊化细胞组胰岛素释放量开始减少,15 d已明显看出两组之间的差别,未微囊化组胰岛素的释放量明显小于微囊化组;25 d时微囊化组胰岛素的释放量也开始有所下降,30 d时两组胰岛素释放量均已下降,但是微囊化组胰岛素的量明显高于未微囊化组。而不经过诱导分化的骨髓间充质干细胞始终是没有胰岛素释放的。而其他两组经检测均有胰岛素释放,且随着时间的延长微囊化组胰岛素释放会更长久一些。表明微囊不但可使细胞存活不影响胰岛素释放,且能延长其存活时间,增加其胰岛素释放量。说明微囊内部的三维立体空间给细胞提供一个良好的生长环境,可能由于微囊表面有很大张力,所以细胞不但能向微囊内部扩散,而且还可能会吸附在微囊表面,使其能够明显改善细胞的增殖和分泌的能力。
[参考文献]
[1] Choi KS,Shin JS,Lee JJ,et al. In vitro trans-differentiation of rat mesenchymal cells into insulin-producing cells by rat pancreatic extract[J]. Biochem Biophys Res Commun,2005,330(4):1299-1305.
[2] 穆长征,李宏丹. 尼克酰胺与胰腺损伤提取物诱导小鼠骨髓间充质干细胞分化为胰岛素产生细胞的比较[J]. 解剖学报,2010,41(6):852-856.
[3] Xing Y,Xu Q,Ma Y,et al. Effect of porous starch concentrations on the microbiological characteristics of microencapsulated lactobacillus acidophilus[J]. Food & Function,2014,5(5):972-983.
[4] Yang YM,Li P,Cui DC,et al. Effect of aged bone marrow microenvironment on mesenchymal stem cell migration[J]. Age(Dordrecht, Netherlands),2015,37 (2):9743.
[5] Jindal RM. The use of zinc binding dyes and fluorescence-activated islet sorters[J]. Pancreas,1995,11(3):316-318.
[6] 牛德亮,常彩红. 人工模拟胰腺微环境诱导骨髓间充质干细胞分化为胰岛素产生细胞[J]. 郑州大学学报(医学版),2009,44(5):960-963.
[7] Solomon TP,Malin SK,Karstoft K,et al. Determining pancreatic β-cell compensation for changing insulin sensitivity using an oral glucose tolerance test[J]. Am J Physiol Endocrinol Metab,2014,307(9):E822-829.
[8] 吕婧玉,许晓婷,陈晓佩,等. 5-aza-dc体外诱导骨髓间充质干细胞分化为胰岛细胞的研究[J]. 畜牧兽医学报,2014,45(9):1538-1543.
[9] Yu Q,Liu L,Lin J,et al. SDF-1α/CXCR4 axis mediates the migration of mesenchymal stem cells to the hypoxic-ischemic brain lesion in a rat model[J]. Cell J,2015,16(4):440-447.
[10] Borkowska P,Fila-Danilow A,Paul-Samojedny M,et al. Differentiation of adult rat mesenchymal stem cells to gabaergic,dopaminergic and cholinergic neurons[J]. Pharmacol Rep,2015,67(2):179-186.
[11] 李建国,宋海彬,周毅,等. 胰岛移植的研究进展[J]. 中国伤残医学,2011,19(6):108-109.
[12] Grigore A,Sarker B,Farbry B,et al. Behavior of encapsulated MG-63 cells in RGD and gelatine-modified alginate hydrogels[J]. Tissue Eng Part A,2014,20(15-16):2140-2150.
(收稿日期:2015-03-19)

