银杏叶提取物对慢性低O2高CO2大鼠空间学习记忆的影响
陈松芳等
[摘要] 目的 探讨银杏叶提取物对慢性低O2高CO2大鼠空间学习记忆的变化及影响。 方法 建立慢性低O2高CO2大鼠肺动脉高压模型。将SD大鼠72只,随机分为正常对照组(NC组)、慢性低O2高CO2 4周组(4HH组)、慢性低O2高CO2 4周组+EGb高剂量(100 mg/kg)组[4HH+EGb(H)组]、慢性低O2高CO2 4周组+EGb低剂量(50 mg/kg)组[4HH+EGb(L)组];大鼠空间学习记忆检测,采用经典Morris水迷宫结合跳台作业。 结果 4HH组大鼠学习与记忆能力下降明显,表现为游泳逃避潜伏期及游泳总距离延长,跳台作业错误次数明显增加;银杏叶提取物不同剂量干预组[4HH+EGb(H)组、4HH+EGb(L)组]逃避潜伏期及游泳总距离缩短,跳台错误次数减少。 结论 银杏叶提取物对慢性低O2高CO2大鼠空间学习记忆下降有改善或提高作用。
[关键词] 慢性低O2高CO2;银杏叶提取物;行为学;Morris水迷宫
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-9701(2015)15-0001-03
[Abstract] Objective To observe changes of spatial learning-memory in rats with chronic hypoxic hypercapnia and the effect of gingkgo biloba extra. Methods After established the rat model of chronic hypoxic hypercapnia,seventy-two rats were randomly divided into four groups: normal control (NC),hypoxic-hypercapnia 4-week (4HH),hypoxic-hypercapnia 4-week+gingkgo biloba extra (EGb) high dose (100 mg/kg) group[4HH+EGb(H)] and hypoxic-hypercapnia 4-week+EGb low dose (50 mg/kg) group[4HH+EGb(L)]. Praxiology in rats was asessed by the Morris water maze and step down test. Results The spatial learning-memory in rats exposed to chronic hypoxic-hypercapnia 4-week(4HH group)were displayed significant impairment in their performance,the longer mean escape latencies and swim path distances,the more error times. 4HH+EGb(H) and 4HH+EGb(L)groups shortened the reaction time of leaning, prolonged the latent time of memory, reduced times of mistakes. Conclusions EGb can enhance the capacity of learning-memory in the rats exposed chronic hypoxic hypercapnia.
[Key words] Chronic hypoxic hypercapnia; Gingkgo biloba extra; Praxiology; Morris water maze
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一类常见病和多发病,存在着很高的发病率和死亡率。近来许多研究相继报道了COPD 引起的认知损害,而且该类损害并非只是巧合或抑郁引起[1]。由于慢性低O2高CO2模型很好地模拟了COPD的病理生理学改变,使之成为研究肺动脉高压的发病机制和临床防治的理想工具,然而众多研究仅关注肺动脉高压的发生发展机制上,而对认知行为功能影响的关注较少。银杏(ginkgo biloba)为银杏科银杏属植物,其主要有效成分为黄酮类和萜内脂类,具有扩张血管、保护机体组织和抗氧化等作用,从而临床有用于缺血性脑血管病的治疗[2,3]。而其对COPD认知功能的影响未见报道。因此本研究拟通过建立慢性低O2高CO2肺动脉高压模型及银杏叶提取物(gingkgo biloba extra,EGb)干预后,观察动物行为学的改变。为临床银杏叶提取物对认知功能的影响提供理论依据。
1 材料与方法
1.1 主要材料
常压慢性低O2高CO2实验模拟舱(潍坊华信氧业有限公司)、M192519便携式O2和CO2气体测定仪(上海牧晨电子技术有限公司)、大鼠跳台仪、Morris 水迷宫(上海赞德医疗有限公司)、Medlab生物信号采集处理系统(南京美易科技有限公司)。
1.2 动物分组及模型制备
将72只SPF级雄性SD大鼠,体重180~220 g(由温州医科大学动物实验中心提供,wydy 2012-0079),根据随机数字表,分为四组:正常对照组(常压常氧组/NC组),低O2高CO2 4周组(4HH组),低O2高CO2 4周组+EGb低剂量(50 mg/kg)组[4HH+EGb(L)组]、低O2高CO2 4周组+EGb高剂量(100 mg/kg)组[4HH+EGb(H)组],每组随机抽取8只。参考文献[1]的方法,将后三组大鼠置于常压低O2高CO2舱内,舱内O2浓度使其降低并维持在9%~11%(根据便携式 O2和CO2气体测定仪结果,通过N2调节),CO2浓度为6%~7%,进舱时间为每天早上8:00~16:00,每周6 d。动物饲养到规定时间后, 用戊巴比妥钠(35 mg/kg BW)腹腔麻醉,右心导管法测定平均肺动脉(mPAP)、平均颈动脉压(mCAP)。银杏叶片(商品名:舒血宁片):每片含银杏叶提取物50 mg(广西半宙制药股份有限公司生产,国药准字Z20064166)。模型+银杏叶提取物组每天进舱前30 min灌服银杏叶混悬液,对照组、模型组均按灌服等量0.9%生理盐水。
1.3 行为学检测
1.3.1 Morris水迷宫 Morris水迷宫由圆形水池、圆柱形平台、摄像头记录及软件分析系统4部分组合而成。圆形水池是一个直径170 cm、高40 cm 的铁皮圆桶,池壁内侧用白色泡沫纸粘贴。水池分成4个象限,水温(25±1)℃,将站台固定置于第2象限中央,浸没于水下2 cm,撒入适量墨汁水变为不透明状,用以隐蔽水中的平台。池壁上悬挂两个以上物体作为近距离视觉参照物,并在水池外房间内有多种远距离视觉参照物。实验共进行5 d,每天上下午固定时间段两次训练。大鼠按顺序从4个等分象限的中点面向池壁放入池中,记录大鼠水中活动轨迹(摄像头)并计算其爬上平台时间,期间如超过120 s未找到平台,终止该象限检测,潜伏期记录为120 s。待大鼠平台上休息30 s再行下一象限检测。用平均逃避潜伏期(mean escape latency)和游泳总距离(swim path distance)两个参数反映大鼠的空间学习记忆成绩。
1.3.2 跳台试验 实验装置主要由回避反应箱(30 cm×30 cm×30 cm)及一圆形跳台组成。其中箱底为铜栅,可通刺激电流(0.5~0.6 mA)。圆形跳台可随机置于铜栅上,大鼠可在跳台上停留以回避电击。在实验前为消除大鼠探究反应,需先将其放置于箱内,适应3 min。在训练实验期间,多数动物受电击后,可能再次或多次跳至铜栅上,而后又重新跳回平台。每次训练5 min,记录大鼠训练时跳下台受电击次数,即第一次错误(EN1),作为训练成绩。24 h后以此作为记忆保持实验,记录每只动物3 min内跳下平台的错误次数,即第二次错误次数(EN2),并且第一次跳下平台的潜伏期(ST)。
1.4统计学处理
应用SPSS18.0统计学软件,计量资料以均数±标准差(x±s)形成表示,经正态性检验后,多组样本均数比较采用单因素方差分析(F 检验),均数两两比较采用 LSD-t检验。P<0.05为差异有统计学意义。
2 结果
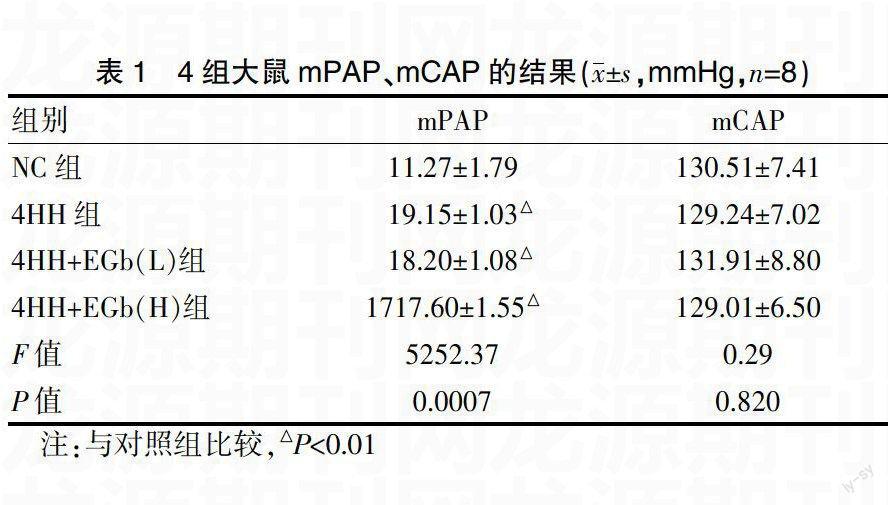
2.1 各大鼠mPAP、mCAP的变化
与NC组比较,4HH组及不同剂量EGb干预组mPAP有显著性差异(P均<0.01),而mCAP无显著性差异(P>0.05),见表1。
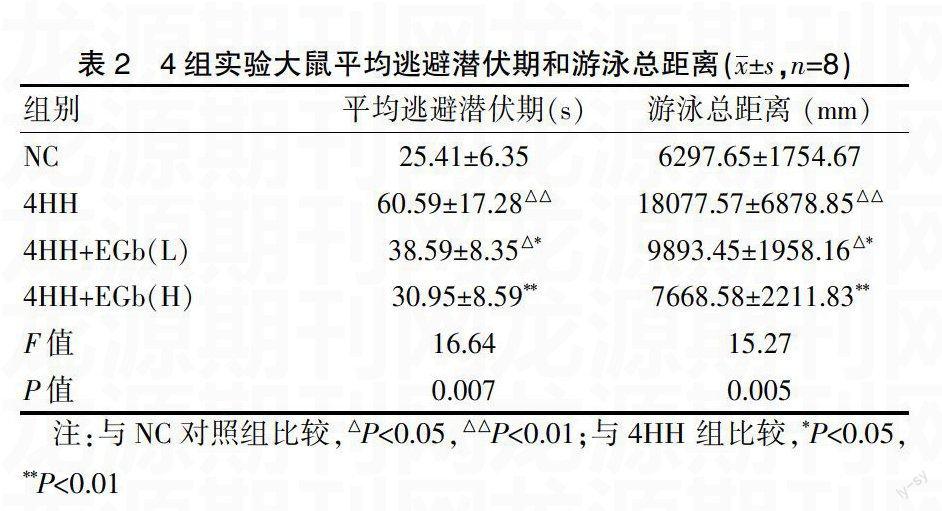
2.2 各组大鼠Morris水迷宫成绩
与NC对照组比较,4HH组平均逃避潜伏期延长和游泳总距离增加。EGb干预组(高剂量、低剂量)平均逃避潜伏期和游泳总距离均缩短,与4HH组比较,有显著性差异(P<0.05),见表2。
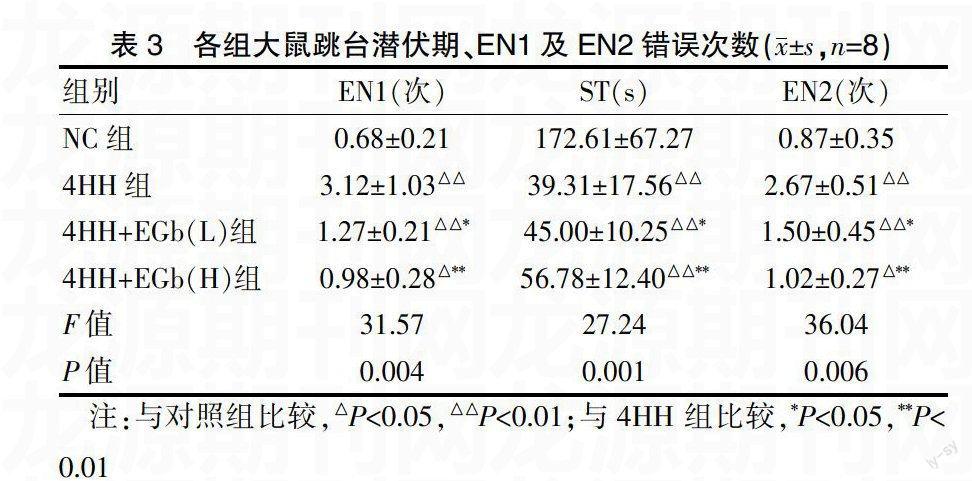
2.3各组大鼠跳台试验结果
与NC组比较,4HH组潜伏期明显缩短,EN1及EN2错误次数明显增加(P<0.01)。EGb高剂量干预组与4HH组相比,潜伏期延长,EN1及EN2错误次数减少,均有显著性差异(P<0.01)。见表3。
3 讨论
银杏(ginkgo biloba)为银杏科银杏属植物,其主要有效成分为黄酮类和萜内脂类。根据现代的药理学分析研究,EGb具有广泛的生物药理效应,如拮抗血小板凝聚、保护血管内膜、抑制微血栓形成、清除自由基等作用[2-4]。近年来的临床疗效观察也发现EGb可明显改善血管性痴呆患者的智能障碍,并认为该作用可能通过促进海马NR1受体蛋白及mRNA表达,而抑制兴奋性氨基酸的释放及钙超载,促进血管性痴呆大鼠海马组织钙调素、钙调素激酶Ⅱ表达的作用相关[5、6]。此外,也有进一步的相关研究提示,EGb能加速神经冲动的传导,对突触的传递产生易化作用,对信息加工、记忆的巩固和再现密切相关[7,8]。而EGb对于慢性低O2高CO2导致认知功能障碍的干预作用,未见报道。
近年来许多研究相继报道了COPD 引起的认知损害,而且该类损害并非只是巧合或抑郁引起[9]。尸检和动物学实验对存在这类认知障碍的患者或动物的海马区研究中发现了不同程度的损伤[10]。相对于国外单纯低O2性肺动脉高压动物模型,慢性低氧高二氧化碳模型很好地模拟了COPD 的病理改变[11]。本研究结果也表明,各模型组大鼠与正常对照组相比,mPAP明显升高,而mCAP无显著性差异,说明慢性低氧高二氧化碳肺动脉高压模型已复制成功,且动物的体循环压无明显变化,提示模型组动物脑血流未受明显影响。
在现代学习记忆研究中,Morris水迷宫往往被认为是非自我为中心的、空间参照的学习记忆研究可靠的理想的经典测试工具[12],但是由于动物在水中的本能逃生反应,且在游泳中消耗能量较大,从而影响学习记忆的检测。故此,本研究为了试验结果更稳定可靠,同时结合跳台作业实验。后者优点在于可较准确地反映动物空间的辨别性学习记忆能力, 简便易行,根据试验设备的不同,一次可同时试验多只动物,可实现组间平行操作。在该实验中同时采用了跳台潜伏期、错误次数等指标,排除了药物非特异性干扰,从而使实验结果更具说服性。从实验结果看,两个测试工具实验的结果相平行。模型组大鼠学习与记忆能力均下降,而EGb干预(高、低剂量组)后大鼠的学习记忆能力,有不同程度的提高,表现为平均逃避潜伏期和游泳总距离缩短、EN1及EN2错误次数减少。同时我们在两个剂量组间,未发现EGb在(50~100)mg/kg剂量区间,呈现干预作用有统计学意义。提示后续的该药物量效研究上剂量区间可能需进一步扩大。
当然,动物在该造模环境下也可能出现一些生理变化,如:睡眠结构的紊乱、体重、脑血流的变化,从而影响空间学习记忆能力等[13,14]。在本研究中,我们根据各组体重的改变及造模动物的mCAP的检测,可以排除体重及脑血流改变的影响。因实验技术条件约束,在本研究中未能采用视频监测,直观地观察实验因素:慢性低O2高CO2,对大鼠睡眠结构的影响。然而有研究[15]认为,慢性低O2对动物睡眠没有长期的影响,其在单纯间断低O2条件下,该研究通过皮层埋植的脑电图(EEG)监测动物的睡眠结构,发现慢性低氧环境下,第一天大鼠睡眠结构明显紊乱,总睡眠时间显著减少,其中以非快动眼睡眠相(NREM)缩短更加明显。但单纯间断低O2环境下第二日开始,大鼠的睡眠时间逐渐恢复,非快动眼睡眠相(NREM)和快动眼睡眠相(REM)逐步延长,第3~4天恢复到正常。
综上所述,说明实验动物在该造模环境下的一些生理反应是稳定的或变化甚微,也提示其不是导致模型组学习记忆能力下降主要因素。
[参考文献]
[1] Dodd JW,Charlton RA,van den Broek MD,et al. Cognitive dysfunction in patients hospitalized with acute exacerbation of COPD[J]. Chest,2013,144(1):119-127.
[2] 汪素娟,康安,狄留庆,等. 银杏叶提取物主要活性成分药动学研究进展[J]. 中草药,2013,25(5):36-38.
[3] 段长虹,付庆林,王崇军,等. 银杏提取物对大鼠脑缺血再灌注损伤bax、神经胶质纤维相关蛋白表达的影响[J]. 中华实验外科杂志,2012,29(1):97-99.
[4] 段长虹,付庆林,蕲国庆,等. 银杏提取物对大鼠局灶性脑缺血再灌注损伤诱导型一氧化氮合酶和血小板活化因子表达的影响[J]. 中华实验外科杂志,2012,29(2):259-261.
[5] PaganellIir A,Benetoli A,Milani H. Sustained neuroprotection and facilitation of behavioral recovery by the Ginkgo biloba extract,EGb761,after transient forebra in ischemia in rats[J]. Behav Brain Res,2006,174(1):70-77.
[6] 王怀颖,石少慧,史建红,等. 银杏叶片对衰老大鼠大脑皮层环腺苷酸反应元件结合蛋白表达的影响[J]. 中华行为医学与脑科学杂志,2011,10(2):887-889.
[7] Zoller B,Hock C,Kull HU. Rational therapy of Alzheimer dementia based on current clinical studies[J]. Schweiz Rundsch Med Prax,2001,90(3):827-829.
[8] DeFeudis FV,Drieu K. Ginkgo biloba extract (EGb761) and CNS functions:basic studies and clinical applications[J].Curr Drug Targets,2000,9(1):25-27.
[9] Kozora E,Make BJ,Kozora E,et al. Cognitive improvement following rehabilitation in patients with COPD[J]. Chest Journal,2000,117(51):2490-2495.
[10] Hota SK,Barhwal K,Singh SB,et al. Differential temporal response of hippocampus,cortex and cerebellum to hypobaric hypoxia:A biochemical approach[J]. Neurochemistry international,2007,51(6):384-390.
[11] Zheng G,Wang Y,Wang X. Chronic hypoxia-hypercapnia influences cognitive function:A possible new model of cognitive dysfunction in chronic obstructive pulmonary disease[J]. Medical Hypotheses,2008,71(1):111-113.
[12] Gozal D,Daniel JM,Dohanich GP. Behavioral and anatomical correlates of chronic episodic hypoxia during sleep in the rat[J]. J Neurosci,2001,21(7):2442-2450.
[13] Pierard C,Liscia P,Chauveau F,et al. Differential effects of total sleep deprivation on contextual and spatial memory:modulatory effects of modafinil[J]. Pharmacol Biochem Behav,2011,97(3):399-405.
[14] Repantis D,Schlattmann P,Laisney O,et al. Modafinil and methylphenidate for neuroenhancement in healthy individuals:A systematic review[J]. Pharmacol Res,2010, 62(3):187-206.
[15] Terada J1,Mitchell GS. Diaphragm long-term facilitation following acute intermittent hypoxia during wakefulness and sleep[J]. J Appl Physiol,2011,110(5):1299-1310.
(收稿日期:2015-01-26)

