趋化因子受体CCR7在胃癌转移中的作用研究
王欢等

[摘要] 目的 构建pLVX-Puro-CCR7稳定表达系统并研究CCR7基因在胃癌转移中的作用。 方法 采用PCR方法扩增CCR7基因并构建pLVX-Puro-CCR7重组质粒,通过脂质体转染法瞬时转染SGC7901细胞株,嘌呤霉素对该细胞株进行筛选并建立稳定表达细胞株。Western blot方法检测稳定转染的SGC7901细胞中CCR7表达情况。Transwell方法分析过度表达CCR7基因对SGC7901胃癌细胞体外迁移的影响。活体成像观察过度表达CCR7 的SGC7901胃癌细胞株在裸鼠体内转移能力。 结果 成功构建pLVX-Puro-CCR7重组质粒并稳定转染SGC7901细胞株,该细胞株能够正确翻译及表达CCR7蛋白。过度表达CCR7基因的SGC7901胃癌细胞株体外迁移能力和在裸鼠体内转移能力显著增强(P<0.05)。 结论 CCR7可能参与促进胃癌细胞转移的功能。
[关键词] 趋化因子受体CCR7;pLVX-Puro质粒;SGC7901细胞;胃癌;转移
[中图分类号] R735.2 [文献标识码] A [文章编号] 1673-9701(2015)15-0014-03
[Abstract] Objective To construct stable expression system of pLVX-Pro-CCR7 and study the function of CCR7 gene in metastasis of stomach cancer. Methods PCR method was used to amplify CCR7 gene and construct pLVX-Puro-CCR7 recombinant plasmid. Lipofection was used to infect SGC7901 cell strain immediately, and puromycin was used to screen the cell strain and establish a cell strain with stable expression. Western blot method was used to test the expression of CCR7 in SGC7901 cells which were stably infected. Transwell method was used to analyze the effect of overly expressed CCR7 gene on in vitro migration of stomach cancer cells of SGC7901. Living imaging was used to observe the metastasis ability of stomach cancer cell strain of SGC7901 which overly expressed CCR7 in nude mice. Results pLVX-Puro-CCR7 recombinant plasmid was successfully constructed and SGC791 cell strain was stably infected. The cell strain was able to correctly translate and express CCR7 protein. Metastasis ability in nude mice and in vitro migration ability of SGC7901 stomach cancer cell strain which overly expressed CCR7 gene significantly improved (P<0.05). Conclusion CCR7 may be involved in the function of promoting metastasis of stomach cancer cells.
[Key words] Chemokine receptor CCR7; pLVX-Puro plasmid; SGC7901 cell; Stomach cancer; Metastasis
胃癌是临床常见的消化道肿瘤,是我国发病率最高的恶性肿瘤[1]。早期胃癌治疗效果较好,但由于胃癌早期症状表现不明显,而大多数胃癌患者就诊时已达晚期,癌细胞已经发生转移,从而延误治疗的最佳时机。癌细胞可通过直接浸润、血道转移、淋巴道转移以及腹腔种植性转移等转移方式向邻近的肝、肺、胰腺、腹膜、卵巢等器官转移,给胃癌的治疗带来很大的困难[2,3]。已有研究显示趋化因子受体在肿瘤细胞的迁移、侵袭和转移过程中有着重要的作用,其中肿瘤细胞高表达趋化因子受体,并向释放趋化因子的远端靶器官进行转移[4,5]。研究提示趋化因子受体-7(chemokine receptor 7,CCR7)是7次跨膜受体G蛋白耦联受体,通过与其配体CCL21相互作用在淋巴细胞的归巢过程中起到重要作用,该蛋白表达异常与恶性淋巴细胞的浸润有关,在胃癌转移中扮演重要角色[6-8]。然而,CCR7 在胃癌细胞的迁徙及转移功能尚未完全阐明,本研究拟通过构建pLVX-Puro-CCR7的真核表达系统,并将其转染至SGC7901细胞株内使其稳定表达,初步探讨CCR7在胃癌细胞转移中的作用。
1材料与方法
1.1实验材料
实验所需pLVX-Puro质粒购自Clontech公司,稳定表达荧光素酶的SGC7901细胞和大肠杆菌DH5α为浙江省人民医院检验中心保存。实验中所用的BglⅡ和SalⅠ限制性内切酶,高保真pfu聚合酶以及T4连接酶购自Takara公司;质粒抽提试剂盒购自上海生工生物技术服务有限公司;高糖DMEM培养基购自Gibco公司;胎牛血清购自杭州四季青生物工程材料有限公司。荧光素酶底物购自美国Promega公司。真核细胞转染试剂LipofectamineTM2000购买于Invitrogen公司;嘌呤霉素为美国Life technology公司产品产品。抗人CCR7及β-actin抗体为eBioscience公司;辣根过氧化物酶标记的IgG购自美国CST公司。
1.2 SGC7901细胞的培养
荧光素酶标记的SGC7901细胞培养于含10%胎牛血清的DMEM高糖培养基中,37℃、5%CO2孵育箱中培养至贴壁,3 d后用0.25%胰酶消化传代培养一次。
1.3稳定表达CCR7的荧光素酶-SGC7901胃癌细胞株的建立
首先采用淋巴细胞分离液分离健康人外周血中单个核细胞并提取总RNA,在NCBI基因库中获取CCR7 基因的CDS序列并设计带有酶切位点的引物,由上海生工有限公司合成,使用高保真pfu聚合酶扩增CCR7基因的序列,并在1.5%琼脂糖凝胶进行电泳。将PCR反应电泳回收产物和pLVX-Puro质粒分别酶切进行电泳并回收,T4连接酶连接,使CCR7与pLVX-Puro质粒连接,将连接产物转化,LB固体培养基培养,提取pLVX-Puro-CCR7重组质粒。SGC7901胃癌细胞计数约为5×105接种于6孔板中,于37℃、5%CO2培养箱中6 h后使细胞融合度达到75%。将4 μg的质粒或10 μL的LipofectamineTM2000脂质体溶液分别用250 μL无血清DMEM培养基稀释混匀并放置30 min备用。弃去6孔板中培养液上清液,缓慢将上述混匀液加入6孔板中,于培养箱中孵育8 h后弃去转染液,加入2 mL含10%胎牛血清的DMEM高糖完全培养基继续培养,96 h后用含有0.25 μg/mL嘌呤霉素的DMEM高糖完全培养基筛选瞬时转染细胞株,并挑取单克隆细胞株进行培养,待细胞大量扩增后收集细胞并提取细胞总蛋白。
1.4 Western blot检测稳定转染CCR7的SGC7901细胞中CCR7的表达
常规培养荧光素酶-SGC7901或荧光素酶-CCR7-SGC7901细胞,吸去培养上清液,PBS洗涤3次,加入细胞裂解液裂解细胞提取细胞总蛋白。蛋白分离:首先95℃变性10 min处理样品,变性蛋白样本在SDS-PAGE胶上180 V,40 min进行分离电泳。转膜:将分离后的蛋白采用60 V,120 min转至硝化纤维膜;转膜后的纤维膜用0.1% Triton-PBS溶液洗涤3次,10 min/次,脱脂奶粉封闭30 min,加入CCR7和β-actin一抗4℃孵育过夜,1×TBST洗膜5次,10 min/次,充分洗涤后加入相应种属HRP-IgG二抗室温孵育30 min,再用1×TBST洗膜5次,15 min/次,ECL显色试剂盒进行显色和曝光。
1.5体外胃癌细胞迁移能力的检测
预先培养的细胞(荧光素酶-SGC7901或者荧光素酶-CCR7-SGC7901细胞)常规消化、离心,并用无血清培养基重悬取0.3×105细胞接种到Transwell培养板的上室中,在transwell下室中加入0.5 mL含10%FBS的完全培养基。置于37℃、5%CO2的环境下培养,24 h后将小室置于另一个24孔板中并加入100%甲醇并固定10 min,后用0.1%结晶紫染色30 min,双蒸水清洗残余染料,将固定胃癌细胞的薄膜在显微镜下进行拍照。
1.6 体内胃癌细胞转移能力的检测
荧光素酶-SGC7901或者荧光素酶-CCR7-SGC7901细胞常规消化、离心和计数后并调整为1×106细胞/100 μL PBS的细胞浓度,将100 μL细胞悬液分别注射到5只清洁级6周大小雄性BALB/c裸鼠(20~25 g)的尾静脉中。细胞悬液注射10周后,对小鼠气体麻醉后并在腹腔注射无菌PBS溶解的荧光素酶底物(小鼠体重150 μg/g),20 min后在小鼠活体成像仪(美国,Xenogen公司)进行小鼠体内胃癌细胞转移情况的检测。
1.7 统计学方法
荧光素酶-SGC7901及荧光素酶-CCR7-SGC7901细胞之间体外迁移能力差异比较采用Mann-Whitney U test分析。数据采用GraphPad Prism 5.1软件进行统计学分析。
2结果
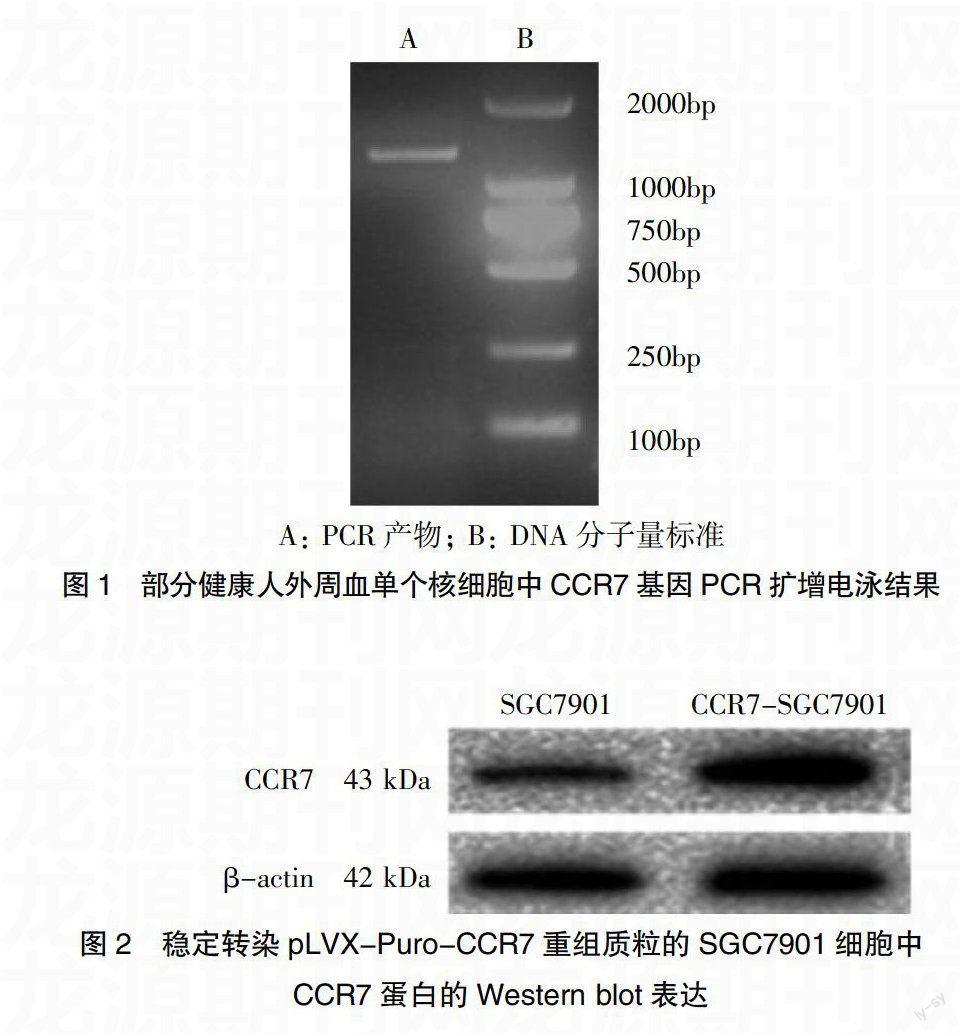
2.1 PCR产物电泳及测序
取5 μL扩增产物经1.5%琼脂糖凝胶电泳,90V电泳30 min后可在约1100 bp处观察到电泳条带。挑取阳性PCR扩增产物送至上海生物工程有限公司进行测序,测序结果经BLAST程序(http://www.ncbi.nlm.nih.gov/BLAST/)进行比对确定为CCR7基因。见图1。
2.2 稳定转染pLVX-Puro-CCR7重组质粒的SGC7901细胞中CCR7的蛋白水平的检测
研究结果发现在约43kDa(CCR7)和42kDa(β-actin)处可见到特异性条带,CCR7-SGC7901重组条带颜色相比SGC7901对照组颜色明显加深(图2),表明转染pLVX-Puro-CCR7质粒并进行嘌呤霉素筛选的稳转SGC7901细胞株能够正确表达及翻译。
2.3稳定表达CCR7对胃癌SGC7901细胞体外迁移能力的影响
Transwell实验表明,稳定表达CCR7的SGC7901细胞组体迁移细胞数目明显增多,见图3A和3B;荧光素酶-SGC7901(SGC7901)或者荧光素酶-CCR7-SGC7901(CCR7-SGC7901)每组随机抽取10个视野,计数结果发现SGC7901组迁移细胞数目为(18.4±1.51)个/HPF,而CCR7-SGC7901组迁移细胞数目为(69.6±9.59)个/HPF,统计学比较显示稳定表达CCR7对SGC7901显著增强胃癌细胞的体外迁移能力,图3C(P<0.05)。
2.4稳定表达CCR7对胃癌SGC7901细胞体内迁移能力的影响
小鼠尾静脉注射10周后进行活体成像,实验组荧光素酶-CCR7-SGC7901细胞在裸鼠体内的转移情况较对照组荧光素酶-SGC7901相比,其体内转移能力显著增强。见封三图2。
3讨论
转移是恶性肿瘤最基本的特征之一,也是临床上绝大多数恶性肿瘤患者死亡的主要原因。趋化因子(chemokine)是一类有多种不同类型细胞分泌、能使免疫细胞发生趋化运动的一类细胞因子,在淋巴细胞的定向迁移[9]、肿瘤的发生发展中均发挥重要作用[10]。研究表明肿瘤细胞的转移受趋化因子的严格调控,而且趋化因子及趋化因子受体在肿瘤的远端转移具有组织和器官的选择性[11],大量研究已经证实:趋化因子及其受体在肿瘤器官选择性转移的作用机制,与其机体淋巴细胞归巢中的作用机制十分相似[12]。CCR7属于CC类趋化因子受体的成员之一,在幼稚T细胞、B细胞及树突状细胞表面表达,CCR7的配体是CCL21,通过与其配体CCL21相互作用在淋巴细胞的归巢过程中起重要作用。已有研究表明CCR7 的表达与食管癌、胰腺癌以及胃癌淋巴管浸润和淋巴结转移密切关系[3,5,8,13,14]。但CCR7与胃癌的远端转移尚未见报道。
为了证实CCR7与胃癌远端转移的关系,本研究通过嘌呤霉素对转染CCR7重组质粒的胃癌细胞株进行筛选,建立带有荧光素酶并同时稳定过表达CCR7的SGC7901胃癌细胞株,并在此过表达细胞株的基础上,通过体外及体内实验证明了趋化因子受体在胃癌细胞的远端转移中发挥重要作用。CCR7不仅可以在体外促进SGC7901胃癌细胞的迁移,而且可以促进小鼠模型体内胃癌细胞的转移,从而对趋化因子受体CCR7在胃癌的远端转移的基础研究奠定了重要的实验基础。
然而,研究通过对裸鼠进行尾静脉建立胃癌转移模型,只模拟了胃癌细胞的血行及远端定植转移能力,具有一定的缺陷性,没有在胃中原位接种胃癌细胞反映胃癌细胞的原位转移能力。因此,CCR7细胞在胃癌细胞中如何被调控及通过淋巴系统进行转移仍需要进一步研究。
[参考文献]
[1] Luo ZY,Wang YY,Zhao ZS,et al. The expression of TMPRSS4 and Erk1 correlates with metastasis and poor prognosis in Chinese patients with gastric cancer[J]. Plos One,2013,8(7):e70311.
[2] Hashimoto T,Arai K,Yamashita Y,et al. Characteristics of intramural metastasis in gastric cancer[J]. Gastric Cancer,2013,16(4):537-542.
[3] Li W,Ye F,Wang D,et al. Protein predictive signatures for lymph node metastasis of gastric cancer[J]. Int J Cancer,2013,132(8):1851-1859.
[4] Forster R,Ohl L,Henning G. Lessons learned from lymphocytes:CC chemokine receptor-7 involved in lymphogenic metastasis of melanoma[J]. J Natl Cancer Inst,2001,93(21):1588-1589.
[5] Ding Y,Shimada Y,Maeda M,et al. Association of CC chemokine receptor 7 with lymph node metastasis of esophageal squamous cell carcinoma[J]. Clin Cancer Res,2003,9(9):3406-3412.
[6] Mashino K,Sadanaga N,Yamaguchi H,et al. Expression of chemokine receptor CCR7 is associated with lymph node metastasis of gastric carcinoma[J]. Cancer Res,2002, 62(10):2937-2941.
[7] Ishigami S,Natsugoe S,Nakajo A,et al. Prognostic value of CCR7 expression in gastric cancer[J]. Hepatogastroenterology,2007,54(76):1025-1028.
[8] Arigami T,Natsugoe S,Uenosono Y,et al. CCR7 and CXCR4 expression predicts lymph node status including micrometastasis in gastric cancer[J]. Int J Oncol,2009,35(1):19-24.
[9] Schaeuble K,Hauser MA,Singer E,et al. Cross-talk between TCR and CCR7 signaling sets a temporal threshold for enhanced T lymphocyte migration[J]. J Immunol,2011, 187(11):5645-5652.
[10] Chow MT,Luster AD. Chemokines in Cancer[J]. Cancer Immunol Res,2014,2(12):1125-1131.
[11] Cojoc M,Peitzsch C,Trautmann F,et al. Emerging targets in cancer management: role of the CXCL12/CXCR4 axis[J].Onco Targets Ther,2013,6:1347-1361.
[12] Roy I,Evans DB,Dwinell MB. Chemokines and chemokine receptors: update on utility and challenges for the clinician[J]. Surgery,2014,155(6):961-973.
[13] Nakata B,Fukunaga S,Noda E,et al. Chemokine receptor CCR7 expression correlates with lymph node metastasis in pancreatic cancer[J]. Oncology,2008,74(1-2):69-75.
[14] Ishida K,Iwahashi M,Nakamori M,et al. High CCR7 mRNA expression of cancer cells is associated with lymph node involvement in patients with esophageal squamous cell carcinoma[J]. Int J Oncol,2009,34(4):915-922.
(收稿日期:2014-12-01)

