miR—195表达调控对大肠癌细胞HT—29增殖和凋亡的影响及其机制探讨
吴巍芸


【摘要】 目的:探讨miR-195对大肠癌细胞HT-29增殖和凋亡的影响及可能的机制。方法:应用脂质体转染的方法,将miR-195 mimics转染入HT-29细胞,qRT-PCR检测转染后miR-195的表达,分别采用CCK-8法及流式细胞术检测细胞增殖和凋亡情况,qRT-PCR和Western blot检测转染后VEGFA mRNA和蛋白表达变化。结果:与NC组比较,miR-195 mimics转染组明显上调HT-29细胞miR-195的表达,抑制细胞增殖,促进细胞凋亡,下调VEGFA mRNA及蛋白表达,两组比较差异均有统计学意义(P<0.05)。结论:上调HT-29细胞的miR-195表达,可明显抑制细胞增殖、促进细胞凋亡,其机制可能与抑制其靶基因VEGFA表达相关。
【关键词】 微小RNA; 大肠癌; 血管内皮生长因子A; 增殖; 凋亡
【Abstract】 Objective: To investigate the effect of miR-195 on proliferation and apoptosis of colorectal cancer cell line HT-29 and its mechanism.Method: MiR-195 mimics was transfected into HT-29 cells by lipofectamine 2000. The miR-195 expression was measured by real-time quantitative reverse transcriptase-polymerase chain reaction (qRT-PCR),cell proliferation and apoptosis were respectively evaluated by CCK-8 assay and flow cytometry.VEGFA mRNA and protein were assessed by qRT-PCR and Western blot. Result:miR-195 mimics group was significantly increased miR-195 expression in HT-29 cells, inhibited cells proliferation and increased cells apoptosis and downregulation of mRNA VEGFA and protein expression, compared with the NC group,the differences were statistically significant(P<0.05).Conclusion:Overexpression of miR-195 in HT-29 cells may significantly suppress cells proliferation and induce cells apoptosis, probably via downregulating its target gene VEGFA expression.
【Key words】 MicroRNA; Colorectal cancer; VEGFA; Proliferation; Apoptosis
First-authors address:Affiliated Hospital of Guangdong Medical University,Zhanjiang 524001,China
doi:10.3969/j.issn.1674-4985.2015.35.008
大肠癌(Colorectal cancer,CRC)是消化道常见的恶性肿瘤,发病率逐渐增高,并呈现出年轻化的趋势,严重威胁人类健康。癌基因和抑癌基因及信号通路的调控、表达失常,导致肿瘤的发生。近年来,越来越多的研究者开始关注微小RNA(microRNA,miR)在大肠癌发生发展中的作用。miRNAs是一类具有调控功能的非编码小分子RNA,通过与靶基因mRNA的特定位点部分和完全结合,导致mRNA的降解和/或阻碍其翻译[1]。研究发现,多种肿瘤存在异常的miRNAs表达谱[2-4]。其中,与正常大肠组织相比,miR-195在CRC组织中表达降低,但miR-195在CRC中的作用及其机制尚未完全明确[5-6]。本实验通过上调HT-29细胞的miR-195表达,初步探讨miR-195在CRC中的作用及机制,现将其具体报告如下。
1 材料与方法
1.1 材料 HT-29细胞株(中科院上海细胞库)于含10%胎牛血清的RPMI 1640培养基中培养。人miR-195 模拟物(miR-195 mimics)、miR-195 mimics阴性对照(miR-195 mimics NC)购于广州锐博生物公司。转染前将HT-29细胞接种至6孔或12孔培养板,待细胞密度达60%~70%时进行转染。按miRNA mimics转染操作说明书混合Opti-MEM I培养基、miR-195 mimics或NC和lipofectamine 2000,将混合物加入铺好的6孔板中,放入37 ℃,5% CO2 的培养箱中培养6 h后,换为含10%胎牛血清的RPMI 1640培养基继续培养至所需时间,收集细胞进行后续各项相关检测。实验分为两组,miR-195 mimics转染组:转染miR-195 mimics(终浓度100 nmol/L);NC组:转染miR-195 mimics NC(终浓度100 nmol/L)。
1.2 实时荧光定量RT-PCR(qRT-PCR)检测miR-195和VEGFA mRNA的表达 各组细胞转染后48 h,用TRIzol提取总RNA。按RT-PCR试剂盒(Takara)说明书进行miR-195和VEGFA的逆转录及PCR反应。分别以U6 snRNA和β-actin作为内参。应用罗氏LightCycler 480型PCR仪进行定量PCR分析。miR-195上游引物:5-TAGCAGCACAGAAATATTGGC-3;U6上游引物:5-CTCGCTTCGGCAGCACA-3;VEGFA上游引物:5-GAGCAGCGAAAGCGACAG-3,VEGFA下游引物:5-CTCCGAAGCGAGAACAGC-3;β-actin上游引物:5-GGCGGCAACACCATGTACCCT-3,β-actin下游引物:5-AGGGGCCGGACTCGTCATACT-3。反应结束后得到各样本miR-195和U6的循环数(Ct值),根据2-△Ct法计算miR-195的相对表达量,实验重复3次。
1.3 CCK-8法检测细胞增殖情况 HT-29细胞接种于96孔培养板,培养液体积200 μL,按上述分组转染,分别培养24、48、72 h后,每孔加入20 μL CCK-8(Dojindo公司),37 ℃继续培养2 h后于酶标仪上450 nm测定各孔吸光度(A450)。每个时间点设3个复孔,实验重复3次,根据时间和吸光度值绘制增殖曲线。
1.4 流式细胞仪检测细胞凋亡情况 HT-29细胞接种于12孔培养板,分别转染miR-195 mimics和NC,培养48 h后收集细胞,PBS洗涤后依次分别加入Annexin V-FITC(碧云天公司)室温避光孵育10 min和碘化丙啶(PI)(碧云天公司)冰浴避光孵育30 min,上机检测,实验重复3次。
1.5 Western blot检测VEGFA蛋白的表达 转染72 h后,用Western及IP细胞裂解液提取细胞总蛋白,测定蛋白浓度后,每个泳道上样40 μg蛋白样品,SDS-PAGE电泳分离,电转到PVDF膜上,5%牛奶封闭非特异位点,抗VEGFA抗体(Santa Cruz,1∶500)4 ℃孵育过夜。相应的二抗(1∶1000)室温孵育1 h,暗室显影,以Tubulin作为内参,以VEGFA蛋白与Tubulin蛋白条带的光密度比值计算VEGFA蛋白的相对含量,实验重复3次。
1.6 统计学处理 使用SPSS 19.0统计软件进行分析,计量资料采用(x±s)表示,比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组细胞miR-195表达比较 miR-195 mimics转染组的miR-195表达水平明显高于NC组,两组比较差异有统计学意义(P<0.05),见图1。
2.2 两组细胞增殖情况比较 CCK-8检测两组转染后细胞增殖情况,miR-195 mimics转染组于48、72 h增殖率较相应时间点的NC组明显下降,两组比较差异均有统计学意义(P<0.05),见图2。
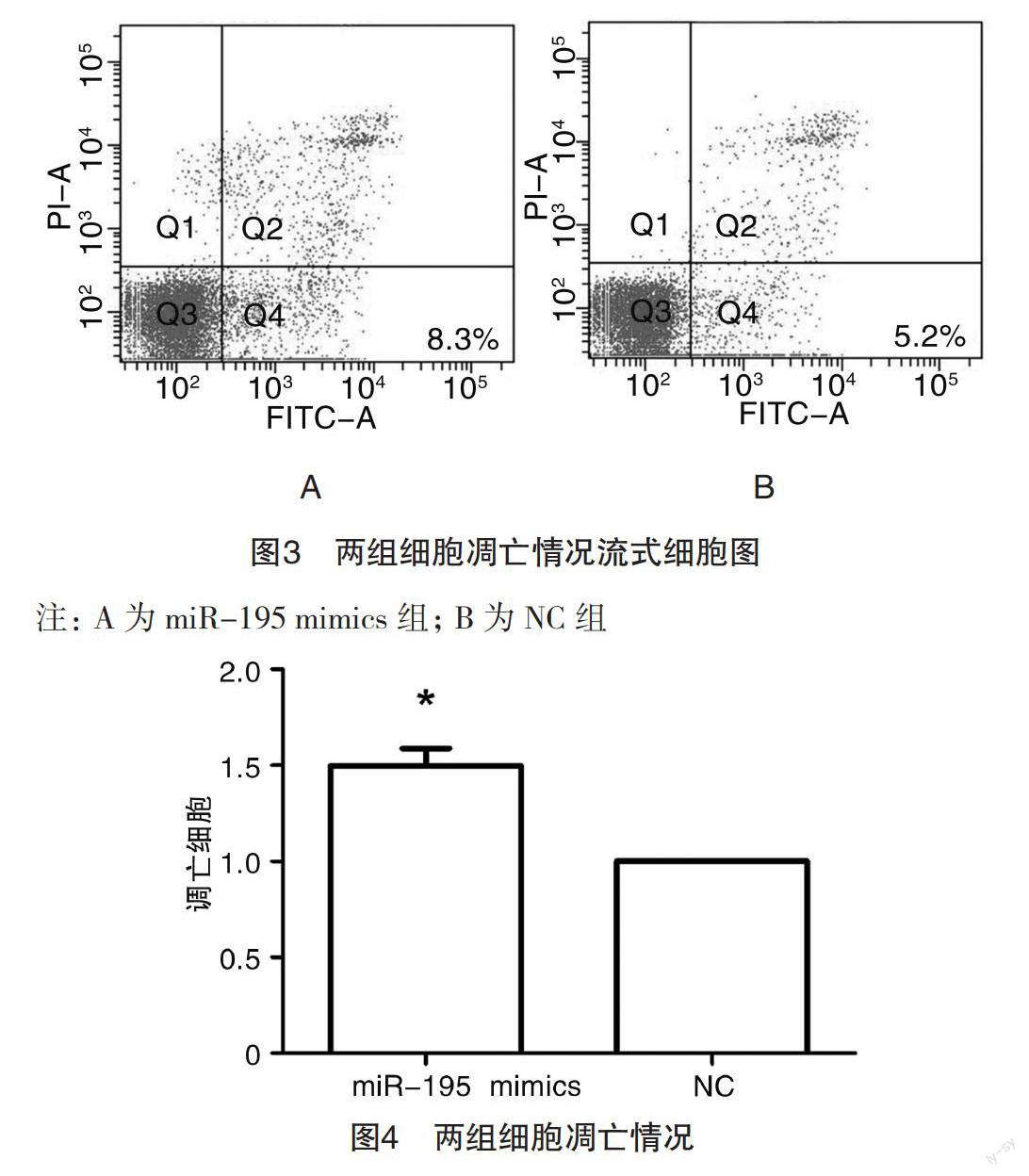
2.3 两组细胞凋亡情况比较 转染miR-195 mimics至HT-29细胞,培养48 h后行流式细胞仪检测,miR-195 mimics转染组凋亡细胞较NC组明显增加,两组比较差异有统计学意义(P<0.05),见图3~4。
2.4 两组细胞的VEGFA表达 qRT-PCR和Western blot检测显示,miR-195 mimics转染组细胞VEGFA mRNA和蛋白的表达水平均较NC组明显降低,两组比较差异均有统计学意义(P<0.05),见图5。
3 讨论
目前已有研究证实miRNAs在大肠癌的诊断、预后判断及治疗效果预测中均发挥作用[7-9]。另外,miRNAs在癌前病变发展,对大肠癌细胞生物学行为的影响,新生血管生成中的作用等基础领域研究亦不断有新的进展[10-12]。研究发现,miR-195在多种肿瘤的发生发展有关。Guo等[13]报道与正常组织比较,miR-195在非小细胞肺癌组织和细胞株的表达明显下调,过表达miR-195能抑制非小细胞肺癌细胞的增殖、转移和侵袭能力。miR-195通过作用于其靶基因脂肪酸合酶(FASN),抑制骨肉瘤细胞的转移和侵袭[14]。Yang等[15]亦报道,miR-195在乳腺癌细胞株和多药耐药的乳腺癌组织中均表达下降,上调miR-195的表达可以抑制乳腺癌细胞的活力,促进其凋亡,增加其对阿霉素治疗的敏感性。miR-195在肾上腺皮质癌患者的癌组织和血清中表达水平均降低,其血清低表达与较短的无复发生存和较短的总体生存有关,对于肾上腺皮质癌患者的预后预测有一定的价值[16]。多个研究显示,与正常组织比较,miR-195在CRC组织表达降低[5-6]。在本研究中,笔者转染miR-195 mimics使大肠癌细胞HT-29过表达miR-195,显示细胞增殖减少、凋亡增多,提示miR-195在CRC中发挥促凋亡的作用,与前面研究一致。
VEGFA是肿瘤血管生成的主要刺激因子之一,通过与其受体VEGFR-2作用,促进内皮细胞的增殖、侵袭、转移。VEGFA在CRC组织中表达上调,高表达的VEGFA与肿瘤进展及侵袭相关,是生存的一个重要预测因素[17]。使用VEGFA shRNA抑制RKO大肠癌细胞的VEGFA表达后,可使细胞周期停滞,减弱细胞增殖和侵袭能力,裸鼠种植瘤生长延缓[18]。Tai等[19]用siRNA抑制大肠癌Volo细胞的VEGFA表达后,亦可以抑制细胞增殖和转移,促进凋亡。于多种大肠癌细胞株,如SW620、HCT-116上使用RNAi技术干扰VEGFA表达也可得到类似的结果[20-21]。上述研究表明,VEGFA与大肠癌细胞的生物学特性相关。笔者通过电子信息学网站预测发现VEGFA是miR-195潜在靶基因之一。转染miR-195 mimics后,与阴性对照组相比,VEGFA mRNA和蛋白的表达水平均明显下调,说明在CRC中miR-195可能通过抑制VEGFA的表达,影响细胞的增殖和凋亡,可能是其参与肿瘤发生发展的机制之一。
综上所述,miR-195在CRC中发挥着类似抑癌基因的作用,随着研究的不断深入,阐明miRNA在肿瘤发生发展过程中的作用机制,以miRNA作为诊断和治疗的靶点,具有巨大的潜在价值。
参考文献
[1] Liu R,Yang M,Meng Y,et al.Tumor-suppressive function of mir-139-5p in esophageal squamous cell carcinoma[J].PLoS One,2013,8(10):e77 068.
[2] Collins A L,Wojcik S,Liu J,et al.A differential microRNA profile distinguishes cholangiocarcinoma from pancreatic adenocarcinoma[J].Ann Surg Oncol,2014,21(1):133-138.
[3] Yang O,Huang J,Lin S.Regulatory effects of miRNA on gastric cancer cells[J].Oncol Lett,2014,8(2):651-656.
[4] Li X,Shi Y,Yin Z,et al.An eight-miRNA signature as a potential biomarker for predicting survival in lung adenocarcinoma[J].J Transl Med,2014,12(4):159.
[5] Corté H,Manceau G,Blons H,et al.MicroRNA and colorectal cancer[J].Dig Liver Dis,2012,44(3):195-200.
[6] Wu W K,Law P T,Lee C W,et al.MicroRNA in colorectal cancer: from benchtop to bedside[J].Carcinogenesis,2011,32(3):247-253.
[7] Komatsu S,Ichikawa D,Takeshita H,et al.Circulating miR-18a: a sensitive cancer screening biomarker in human cancer[J].In Vivo,2014,28(3):293-297.
[8] Chu D,Zheng J,Li J,et al.MicroRNA-630 is a prognostic marker for patients with colorectal cancer[J].Tumour Biol,2014,35(10):9787-9792.
[9] Schou J V,Rossi S,Jensen B V,et al.miR-345 in metastatic colorectal cancer: a non-invasive biomarker for clinical outcome in non-kras mutant patients treated with 3rd line cetuximab and irinotecan[J].PLoS One,2014,9(6):e99 886.
[10] Ueda Y,Ando T,Nanjo S,et al.DNA methylation of microrna-124a is a potential risk marker of colitis-associated cancer in patients with ulcerative colitis[J].Dig Dis Sci,2014,59(10):2444-2451.
[11] Wang L,Qian L,Li X,et al.MicroRNA-195 inhibits colorectal cancer cell proliferation,colony-formation and invasion through targeting CARMA3[J].Mol Med Rep,2014,10(1):473-478.
[12] Zhang Y,Wang X,Xu B,et al.Epigenetic silencing of miR-126 contributes to tumor invasion and angiogenesis in colorectal cancer[J].Oncol Rep,2013,30(4):1976-1984.
[13] Guo H,Li W,Zheng T,et al.miR-195 Targets HDGF to inhibit proliferation and invasion of NSCLC cells[J].Tumour Biol,2014,35(9):8861-8866.
[14] Mao J H,Zhou R P,Peng A F,et al.microRNA-195 suppresses osteosarcoma cell invasion and migration in vitro by targeting FASN[J].Oncol Lett,2012,4(5):1125-1129.
[15] Yang G,Wu D,Zhu J,et al.Upregulation of miR-195 increases the sensitivity of breast cancer cells to Adriamycin treatment through inhibition of Raf-1[J].Oncol Rep,2013,30(2):877-889.
[16] Chabre O,Libé R,Assie G,et al.Serum miR-483-5p and miR-195 are predictive of recurrence risk in adrenocortical cancer patients[J].Endocr Relat Cancer,2013,20(4):579-594.
[17] Ishigami S I,Arii S,Furutani M,et al.Predictive value of vascular endothelial growth factor (VEGF) in metastasis and prognosis of human colorectal cancer[J].Br J Cancer,1998,78(10):1379-1384.
[18] Qiu J F,Zhang Z Q,Wang Y,et al.Lentivirus-mediated RNAi knockdown of VEGFA in RKO colorectal cancer cells decreases tumor formation and growth in vitro and in vivo[J].Int J Clin Exp Pathol,2012,5(4):290-298.
[19] Tai J,Wang G,Liu T,et al.Effects of siRNA targeting c-myc and vegf on human colorectal cancer volo cells[J].J Biochem Mol Toxicol,2012,26(12):499-505.
[20] Wang S,Liu H,Ren L,et al.Inhibiting colorectal carcinoma growth and metastasis by blocking the expression of VEGF using RNA interference[J].Neoplasia,2008,10(4):399-407.
[21] Yin Y,Cao L Y,Wu W Q,et al.locking effects of siRNA on VEGF expression in human colorectal cancer cells[J].World J Gastroenterol,2010,16(9):1086-1092.
(收稿日期:2015-08-20) (本文编辑:周亚杰)

