解读:化学教材必修1、2中的实验
黄颖
一、化学实验基础知识
1.安全知识。能识别化学品安全使用标志,了解实验室一般事故的预防和处理方法。如:用后多余的药品不能放回原瓶,但多余的钠、钾、白磷要放回原瓶;钾、钙、钠、镁等非常活泼的金属着火时,不能使用水或CO2灭火器灭火,可用沙土覆盖灭火。
2.常用仪器。了解常用仪器的主要用途和使用方法。如:平底烧瓶一般不用作加热仪器;加热圆底烧瓶时要垫石棉网,或水浴加热;加热蒸馏烧瓶时要垫石棉网,或水浴加热;蒸馏时蒸馏烧瓶中液体的体积不能超过容器容积的÷,液体也不能蒸干;容量瓶在使用前要检查是否漏水,要在所标温度下使用,加液体时要用玻璃棒引流,定容时液体的凹液面的最低处与刻度线相切,不能长期存放溶液。
3.试剂保存。掌握常用试剂的保存方法。①固体药品要盛放在广口瓶中,液体试剂一般盛放在细口瓶中。②见光易分解的物质要盛放在有色玻璃瓶中。③碱性物质盛放在玻璃瓶中时,应使用橡皮塞;强酸、强氧化性试剂、有机溶剂,要保存在玻璃瓶中,且不能用橡皮塞或软木塞。④易燃、易爆的物质保存时要远离火源。⑤特殊的化学试剂要有特殊的保存措施。如:氢氟酸易腐蚀玻璃,应保存在塑料瓶中;少量白磷要保存在水中;液溴挥发性很强,要在试剂瓶中加入少量水,并在瓶口处熔上石蜡;锂常保存在液体石蜡中,钠、钾保存在煤油中。
4.基本操作。掌握化学实验的基本操作。如:液体物质的溶解(稀释),一般把密度较大的液体加入到密度较小的液体中;浓硫酸与水或硝酸等混合,都应是浓硫酸倒人其他液体中。
例l下列有关实验的叙述错误的是()。
A.液溴易挥发,在存放液溴的试剂瓶中应加水密封
B.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
C.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
D.一旦金属汞洒落,必须尽可能地收集起来,放在水中保存以防挥发,并将硫磺粉撒在洒落汞的地方,使会属汞转变成不挥发的硫化汞
解析
B项,pH试纸不能用蒸馏水润湿,不能放到溶液中;c项,由于浓硫酸溶于水时放出大量的热,稀释浓硫酸时需要将浓硫酸慢慢地滴加到水中,并不断用玻璃棒搅拌,使放出的热量及时散失,防止酸液飞溅。本题选BC。
练习1:下列说法不正确的是()。
A.易燃试剂与强氧化性试剂分开放置并远离火源
B.盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容器容积的2/3,液体也不能蒸干
D.金属钠着火时,用细沙覆盖灭火
二、物质的检验
能对常见的物质进行检验,掌握常见物质(气体、阳离子、阴离子)的检验试剂和现象。
1.常见气体的检验。①C12:用湿润的淀粉碘化钾试纸检验,变蓝。②SO2:用品红溶液检验,红色褪去,再加热又出现红色。③NO:与空气接触,立即变为红棕色。④NH3:用湿润的红色石蕊试纸检验,变蓝。
2.常见阳离子的检验。①Na-:利用焰色反应检验,火焰呈黄色。②Fe2+:取少量试液,滴加NaOH溶液,先生成白色沉淀,很快变为灰绿色,最后变为红褐色,离子方程式为Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+2H2O+O2=4Fe(OH)3。或者是取少量试液,滴加KSCN溶液,不变色,加氯水后变红色,离子方程式为2Fc2++Cl2=2Fe3++2Cl-, Fe3++3SCN-=Fe(SCN)3③Fe3+:取少量试液,滴加NaOH溶液,出现红褐色沉淀,离子方程式为Fe3++30H-=Fe(OH)3↓。或者是取少量试液,滴加KSCN溶液,溶液呈红色,离子方程式略。④NH+4:取少量试液,与NaOH溶液混合,加热,产生能使湿润的红色石蕊试纸变蓝的无色、有刺激性气味的气体,离子方程式为NH+4+。⑤Al3-:取少量试液,滴加NaOH溶液,生成白色沉淀,继续滴加NaOH溶液,沉淀溶解,继续加氨水,沉淀不溶解,离子方程式为Al3++30H-=AI(OH)3↓,Al(OH)3+OH=A1O-2+2H2O。
3.常见阴离子的检验。①CI (Br-、T-):取少量试液,滴加AgNO3溶液,产生白(淡黄、黄)色沉淀,向沉淀中滴加稀硝酸,沉淀不溶解,离子方程式为②:取少量试液,滴加稀盐酸,无沉淀产生,再加BaCI2溶液,产生白色沉淀,离子方程式为③:取少量试液,滴加稀硫酸,产生无色、有刺激性气味的气体,该气体能使品红溶液褪色,离子方程式为。④:取少量试液,滴加稀盐酸,产生无色、无味的气体,该气体能使澄清石灰水变浑浊,离子方程式为
例2 下列说法正确的是()。
A.为鉴别KCl、AICl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
B.向某溶液中加入稀盐酸,能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有
C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D.检验某溶液中是否含有时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
B项,可使澄清石灰水变浑浊的气
体为SO2或CO2,而与酸作用能产生CO2的可能是,也可能是;C项,做焰色反应时,用稀盐酸洗涤铂丝;D项,检验某溶液中是否含有时,应取少量该溶液,先滴入稀盐酸,无沉淀牛成,冉加入BaCl2溶液,生成白色沉淀,这样可以防止Cl的干扰。本题选人。
练习2:下列说法正确的是()。
A.能使湿润的淀粉碘化钾试纸变蓝色的物质一定是Cl2
B.取少量X溶液,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2
C,向某无色溶液中加入Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定含有
D.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性
三、物质的分离、提纯与除杂
能对常见的物质进行分离、提纯与除杂,常见混合物分离、提纯、除杂的方法主要有以下几种:
1.过滤。分离互不相溶的固液混合物,如除去NaCI溶液中的BaCO3。注意事项:“一贴、二低、三靠”,即滤纸紧贴漏斗内壁;滤纸低于漏斗边缘,液面低于滤纸边缘;上烧杯口紧靠玻璃棒,玻璃棒末端紧靠t层滤纸处,漏斗末端紧靠下烧杯内壁。
2.蒸发。加热使溶质从溶液中结晶分离出来,如从NaCl溶液中分离出NaC1。注意事项:加热过程中要用玻璃棒不断搅拌,以免局部过热;较多晶体析出时停止加热,利用余热把剩余的水蒸干。
3.蒸馏。根据物质的沸点不同分离互溶的几种液体,如石油的分馏。注意事项:需加沸石以防止暴沸,温度计的水银球保持在蒸馏烧瓶的支管口处,冷凝水从冷凝管的下口进、上口出。
4.萃取。利用溶质在互不相溶的两种液体J|I溶解度差别很大进行分离,如用苯(或CCl;)从溴水中提取溴。注意事项:分液漏斗下端紧靠烧杯内壁,打开分液漏斗上口玻璃塞,旋开活塞,让下层液体从卜.口流出,再关闭活塞,上层液体由上几倒入另一烧杯。萃取剂的选择要遵循“与原溶剂可互不溶、互不反应,溶质在萃取剂中的溶解度比在原溶刹中大得多且与萃取剂不反应”的原则。
5.掌握除杂的原则:不引入新的杂质;被提纯物质易与杂质分离;所用试剂只与杂质反应;若除去气体杂质后带有水分,还应干燥;最好在除杂的同时能增加被提纯物质的量。常见的除杂方法有吸收法、转化法、沉淀法、气化法、热分解法、溶解法、结晶法等。
例3 下列实验操作正确的是()。
A.将碘水倒人分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.乙酸与乙醇的混合液可用分液漏斗进行分离
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
D.蒸发结晶NaCI溶液时,蒸发皿中有晶体析出并剩余少量液体时即停止加热
解析
A项,乙醇溶于水,不能作萃取剂;B项,乙酸与乙醇互溶,不分层,不能用分液漏斗分离;C项,苯的密度比水小,用苯萃取溴水中的溴时,溴的苯溶液在上层,从分液漏斗的上口倒出。本题选D。
练习3:下列除去杂质的方法正确的是()。
①除去乙烷中少量的乙烯:在光照条件下通人C12,气液分离 ②除去乙酸乙酯中少量的乙酸:川饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏 ⑧除去CO2中少量的S02:将气体通过盛饱和碳酸钠溶液的洗气瓶 ④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
A.①②
B.②④
C.③④
D.②③
四、化学计量在实验中的应用
能根据要求配制溶液,明确配制溶液时需要的仪器、步骤,能对错误的操作进行误差分析。①仪器:天平(溶质是液体时用量筒或移液管)、烧杯、玻璃棒、容量瓶、胶头滴管。②步骤:计算→称量(溶质是液体时采用“量取”)→溶解→转移→洗涤→振荡→定容→摇匀→装瓶。③误差分析:根据可知,凡是导致溶质减少的操作都会使浓度偏小,导致溶质增多的操作会使浓度偏大;而凡是导致多加水的操作都会使浓度偏小,导致少加水的操作会使浓度偏大。
例4下列叙述正确的是()。
A.将固体加入容量瓶中溶解并稀释至刻度线,配制成一定物质的量浓度的溶液
B.配制溶液时,若加水超过容量瓶的刻度线,应用胶头滴管将多余溶液吸出
C.在50ml.量筒中配制O.IOmol·L-1碳酸钠溶液
D.配制一定物质的量浓度的氢氧化钠溶液,若氢氧化钠固体溶解后没有冷却直接转入容量瓶中,会导致浓度偏大
固体不能直接在容量瓶中溶解,A
项错误;配制溶液时,若加水超过容量瓶的刻度线,需要倒掉溶液重新配制,B项错误;量筒是用来量取液体的,一般不用来配制溶液,C项错误;NaOH固体溶解过程中会放热,使液体膨胀,待冷却后,液体会冷缩,液面一定低于刻度线,相当于少加了水,会导致浓度偏大,D项正确。本题选D。
练习4:下列叙述正确的是()。
A.用容量瓶配制溶液时,没有洗涤玻璃棒和烧杯,会使所配溶液浓度偏小
B.用容量瓶配制溶液,定容时俯视刻度线,会使所配溶液浓度偏小
C.用量筒量取5.00ml。1.00mol·L-1的盐酸置于50ml。容量瓶中,加水稀释至刻度线,可配制0.10mol·L-1盐酸
D.欲配制1L1.00mol·L-1的CuSO4溶液,需要称量160gCuSO4·H2O
五、实验原理的设计与评价
能根据实验题的要求,做到了解控制实验条件的方法,设计、评价或改进实验方案。解答该类试题,注意以下基本要求:①科学性:实验原理科学,操作程序、方法正确。②安全性:避免有毒气体泄漏和危险性的实验操作。③可行性:条件允许,效果明显,操作方便。④简约性:装置简便,步骤简短,完成实验所需的时间短。
例5下列说法正确的是()。
A.除去铁粉中混有的少量铝粉,可加入过量的NaOH溶液,完全反应后过滤
B.为测定熔融NaOH的导电性,可在瓷坩埚中熔化NaOH固体后进行测量
C.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCI3饱和溶液并长时间煮沸
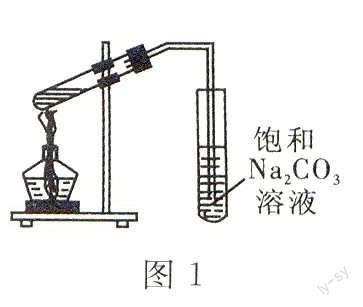
D.实验室常用图1所示的装置制取少量的乙酸乙酯
解析
铁粉不与
NaOH溶液反应,而铝粉可溶于NaOH溶液,A项正确;陶瓷中含有SiO2、硅酸盐等,SiO2可与NaOH溶液反应,B项错误;配制Fe(OH)3胶体,只需向沸水中滴人几滴饱和FeC13溶液并加热至呈红褐色即可,C项错误;实验室制备少量乙酸乙酯时,产生的蒸气经导管通到饱和Na2CO3溶液的液面上,D项错误。本题选人。
练习5:下列说法正确的是()。
A.制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中
B.做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放人烧杯中,滴人两滴酚酞试液,再加入少量水,然后观察并记录实验现象
C.锌与稀硫酸反应时,要加快反应速率,可滴加少量CuSO4溶液
D.在含FeCl2杂质的FeCl3溶液中通人足量Cl2后,充分加热,除去过量的C12,即可得到较纯净的FeCl3溶液
练习参考答案与提示:I.B 2.D 提示:A项,除C12外,其他的如O。也可以将KI氧化成I2;B项,应先向X溶液中滴人KSCN溶液,溶液不呈红色,再滴人适量新制氯水,溶液变红,才能说明X溶液巾一定含有Fe2-;C项,加入稀盐酸后,有强氧化性,若沉淀是BaS03,能被氧化成BaSO4。 3.B 提示:①在光照条件下,乙烷与Cl2发生取代反应,乙烯与Cl2发生加成反应,不能除去乙烷中少量的乙烯;②发生反应CH3COOH+;③饱和Na2CO3溶液与SO2、CO2均反应;④乙酸与生石灰反应生成乙酸钙,并且生石灰又吸水,蒸馏得到乙醇。 4.A 提示:B项,用容量瓶配制溶液,定容时俯视刻度线,相当于少加了水,使溶液浓度偏大;C项,配制溶液时,要先在烧杯中将盐酸稀释并冷却至室温,再转入容量瓶中;D项,应该称量250gCuS04·SH20。 5.C 提示:A项,只能得到沉淀,Fe(OH)3胶体的制备通常是将饱和FeCl3溶液滴入沸水中;B项,做“钠与水的反应”实验时,应向一只盛有水的小烧杯中滴加几滴酚酞试液,然后将绿豆大小用滤纸吸干其表面煤油的金属钠投入小烧杯中,观察并记录实验现象;C项,锌能置换出铜,构成了原电池,加快了反应速率;D项,加热FeCl3溶液,使Fe3+的水解程度增大,生成Fe(OH)3得不到纯净的FeC13溶液。

