静电场对白切鸡中微生物总数的影响
陈文波 胡宏海 张春江 黄峰 张雪 刘倩楠 张泓
摘 要:借助平板菌落计数、变性梯度凝胶电泳分析和纯种微生物分离鉴定等手段研究静电场在白切鸡贮藏过程中对微生物总数、微生物多样性、纯种微生物生长的影响,通过比较分析静电场在纯种微生物生长中的作用,揭示静电场延长白切鸡货架期的机理。结果表明:白切鸡是一种原始带菌量比较高的产品,通过静电场处理可以延长白切鸡产品的货架期。白切鸡中的微生物以来源于产品原料的假单胞菌属的微生物为主。静电场对纯种微生物生长的抑制存在种属差异性。
关键词:白切鸡;变性梯度凝胶电泳;假单胞菌;静电场;抑制作用
Influence and Mechanism of Electrostatic Field on Total Microbial Count in Chopped Cold Chicken
CHEN Wenbo, HU Honghai, ZHANG Chunjiang, HUANG Feng, ZHANG Xue,LIU Qiannan, ZHANG Hong*
(Comprehensive Key Laboratory of Agro-products Processing, Ministry of Agriculture, Institute of Agro-products Processing Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract: The influence of electrostatic field on total microbial count and microbial diversity in chopped cold chicken was investigated by plate count and denatured gradient gel electrophoresis (DGGE) and the growth characteristics of pure cultures of Pseudomonas isolated from chopped cold chicken were tested to reveal the mechanism of electrostatic field for extending its shelf life. The results of this study revealed chopped cold chicken itself had high microbial load and its shelf life could be prolonged by electrostatic field treatment. Pseudomonas was the dominant microbe in chopped cold chicken, which was derived from the raw materials. The inhibitory effect of electrostatic field treatment on the growth of pure cultures of Pseudomonas was species-dependent.
Key words: electrostatic field; chopped cold chicken; DGGE; Pseudomonas; inhibition
中图分类号:TS251.55 文献标志码:A
doi: 10.7506/rlyj1001-8123-201506001
白切鸡素有“鸡中第一鲜”的美誉[1]。这是因为白切鸡的烹制过程仅使用热水浸烫,而不是沸水煮制。这样的烹制方法保证了白切鸡的鸡肉处于熟而不烂的鲜嫩状态,同时也增加了白切鸡产品携带大量微生物的风险[2]。因此,由于微生物的大量存在,白切鸡产品的货架期都很短,不适合大规模的商业化生产。
为了解决食品因微生物而导致的货架期过短的问题,研究人员提出了众多新型的灭菌方法,如辐照、超声波、高压脉冲电场等[2-4]。与传统的热杀菌技术相比,这些新型的灭菌方法不产热,可极大限度地保留灭菌对象的原有品质,具有一定的优势。但是这些方法存在设备昂贵、应用范围较窄、安全性能较低等的特点。
低压静电场是一种新型的食品保鲜技术,它可以产生最高达3 000 V左右的空间电势,借以影响置身其中的微生物等营养细胞的生命活力,达到食品保鲜、延长食品货架期的目的。而且,当前已经开发出小巧轻便的低压静电压场产生设备,拓宽了这种新型的食品保鲜技术的应用范围。然而,当前关于这种低压静电场影响食品中微生物的研究相对较少,而且也缺乏这种技术在白切鸡中的应用实例。因此,本研究目的主要集中在低压静电场对白切鸡中微生物总数及多样性的影响上,通过纯种微生物分离进一步揭示低压静电场对不同微生物生长影响的机制。
1 材料与方法
1.1 材料与试剂
三黄鸡(1 kg左右)、葱、姜 市购。
平板计数琼脂(PCA)培养基 北京奥博星生物技术有限责任公司;NaCl、KH2PO4、NaOH、HCl 国药集团化学试剂有限公司;DNA Marker、PCR试剂、pMD19-T Vector Systems、限制性内切酶 宝生物(大连)工程有限公司;pGEM-T Easy Vector Systems 美国 Promega公司;琼脂糖凝胶回收试剂盒、质粒提取试剂盒、质粒连接试剂盒 美国Omega Bio-Tek公司;琼脂糖、丙烯酰胺、甲叉双丙烯酰胺、去离子甲酰胺、尿素、Tris碱、乙二胺四乙酸二钠(EDTA)、十二烷基硫酸钠 生工生物工程(上海)股份有限公司;胰蛋白胨、酵母粉 英国Oxoid公司;引物合成 生工生物工程(上海)股份有限公司;DNA提取试剂盒 天根生化科技有限公司。
1.2 仪器与设备
灭菌锅、恒温培养箱、干燥箱 上海博迅实业有限公司;超净工作台 苏州苏洁净化设备有限公司;天平 梅特勒-托利多仪器(上海)有限公司;移液器 美国Eppendorf公司;Beadbeater细胞破碎仪 美国Biospec公司;PCR仪、电泳仪、变性梯度电泳仪、凝胶成像仪 美国Bio-Rad公司;核酸浓度测定仪 通用(上海)有限公司;冷冻高速离心机 美国Sigma-Aldrich公司;超低温冰箱 美国Thermo 电子仪器公司;电子天平 上海天平仪器厂;测序仪 美国ABI公司;真空干燥箱 上海一恒科技有限公司;电热恒温水浴锅 上海华连医疗器械有限公司;空间静电场发生器 日本Agua公司;HR2105绞肉机 荷兰Philips公司。
1.3 方法
1.3.1 白切鸡的制作
白切鸡的制作方法参照陈文波等[1]的方法。
1.3.2 白切鸡样品的贮存与电场处理
白切鸡样品的贮存方法参照Novak等[5]的方法,并略加修改。具体的操作方法如下:取白切鸡的鸡腿肉和鸡胸肉放入绞肉机中,以最高速率(12 000 r/min)打碎1 min。然后,取50 g放入无菌袋中并置于装有空间静电场和未安装空间静电场的4 ℃的冰箱中进行贮藏。为了避免环境中微生物的染污,白切鸡样品的准备过程均在超净工作台中进行。空间静电场的强度控制在600~1 000 V之间。
1.3.3 细菌总数的测定
白切鸡中细菌总数的测定方法参照Chen Jinru等[6]的方法及GB 4789.2—2010《食品微生物学检验 菌落总数测定》[7],并略做修改。具体的操作方法如下:取贮藏不同时间的白切鸡样品5 g置于45 mL灭菌生理盐水中并充分剪碎,于振荡器上持续振荡混匀15 min后按体积比1:10的比例进行系列稀释。最后选择适合稀释梯度的样品悬液进行平板涂布并置于37 ℃的培养箱中保温24~48 h。培养结束后计数平板上细菌克隆的总数并计算原始样品中的微生物总数(以lg(CFU/g)表示)。
1.3.4 白切鸡中细菌总DNA的提取
在生物安全柜内用无菌剪刀剪取肉样,放在无菌的平板内准确称量25 g,剪碎肉样置于80 mL无菌离心管内,加入50 mL无菌双蒸水,3 000 r/min离心10 min,上清液转入80 mL无菌离心管内,12 000 r/min离心10 min,弃掉上清,用1 mL无菌水清洗菌体沉淀,将菌体沉淀转移到1.5 mL离心管内,继续12 000 r/min离心5 min,弃上清,菌体沉淀用于提取DNA。
菌体总DNA的提取方法按照细菌基因组DNA提取试剂盒提供的方法进行。
1.3.5 目的片段的PCR扩增
对细菌的16S rDNA的V6~V8 区片段进行聚合酶链反应(polymerase chain reaction,PCR)扩增。上游引物为带有GC夹子的U968,下游引物是L141。U968-GC夹子为:5 -CGC CCG GGG CGC GCC CCG GGC GGG GCG GGG GCA CGG GGG GAA CGC GAA GAA CCT TAC-3 。下游引物L141为:5 -CGG TGT GTA CAA GAC CC-3 。上述引物均由生工生物(上海)技术有限公司合成。
PCR扩增体系(50 μL)为:10×PCR缓冲液5 μL;dNTP(2.5 mmol/L)4 μL;ExTaq(5 U/μL)0.5 μL;U968-GC(20 μmol/L)0.5 μL;L141(20 μmol/L)0.5μL;模板DNA 100 ng;补充双蒸水至50 μL。
PCR扩增程序为:94 ℃预变性5 min;94 ℃变性30 s、55 ℃复性30 s、72 ℃延伸30 s、30个循环;最终72 ℃延伸10 min。
PCR产物采用美国Axygen公司DNA Gel Extraction Kit纯化回收。
1.3.6 PCR产物的变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)分析
取10 μL PCR的产物进行DGGE分析。采用变性梯度为35%~55%、浓度为8%的聚丙烯酰胺凝胶(化学变性剂为100%尿素7 mol/L和体积分数40%的去离子甲酰胺)在1×TAE缓冲液中200 V预电泳8 min,随后85 V电泳16 h。DGGE完毕后,采用银染法进行染色。
1.3.7 DGGE图谱中优势条带的回收与测序
用无菌的手术刀切下待回收DGGE条带,采用美国Omega 公司Poly-Gel DNA Extraction Kit回收目的条带。
以2 μL回收产物为模板,U968/L141为引物进行PCR扩增。
PCR扩增体系(50 μL)为:10×PCR缓冲液5 μL;dNTP(2.5 mmol/L)4 μL;rTaq酶(5 U/μL)0.5 μL;U968(20 μmol/L)0.5 μL;L141(20 μmol/L)0.5 μL;模板DNA 100 ng;补双蒸水至50 μL。
PCR扩增程序为:94 ℃预变性5 min;94 ℃变性30 s、55 ℃复性30 s、72 ℃延伸30 s、30个循环;最终72 ℃延伸10 min。
将重新扩增的DNA片段切胶回收、纯化后,连接到Pmd18-T载体上,并转化至E. coli DH5α感受态细胞中,筛选阳性克隆,进行序列测定。
1.3.8 白切鸡中可培养兼性嗜冷微生物的分离
取5 g腐败的白切鸡样品加入45 mL无菌的生理盐水中,用无菌剪刀将其中的鸡肉样品剪碎后制备10倍稀释的样品悬液。然后对该样品悬液进行系列梯度稀释之后,选择适合浓度的稀释液进行平板涂布并于4 ℃冰箱中倒置培养7~10 d。待平板上的克隆生长出之后,对细菌总数在50 CFU/mL左右的平板上的全部克隆进行划线纯化。纯化的菌株的鉴定通过16S rDNA序列的测定进行。
1.3.9 静电场对纯种微生物生长速度的影响
静电场对纯种微生物生长速度的影响,主要参考Ercolini等[8]的方法并略做修改。将纯种微生物克隆制备成细胞浓度约为1 000 CFU/mL的悬液,取100 μL悬液涂布平板。每个克隆稀释液制备6 个平板,处理组和对照组各使用3 个平板。通过观察平板上的生物量评价微生物的生长速率。
1.4 数据分析及作图
实验数据分析主要通过Microsoft Excel 2013及SPSS 19.0进行;数据作图使用Origin 9.0和Sigmaplot 12.0软件;实验照片的处理使用Adobe Photoshop CS6进行。
2 结果与分析
2.1 电场对白切鸡中微生物总数的影响
静电场可以明显地影响白切鸡中微生物总数的变化。由图1可知,在贮藏1~3 d中,白切鸡中微生物的总数表现出下降的趋势。随着贮藏时间的延长,白切鸡中的微生物总数开始增加,在贮藏时间达到5~6 d时,白切鸡中的微生物总数达到80 000 CFU/g,已经不再适合食用。
白切鸡中微生物总数之所以出现这样的变化趋势与白切鸡中微生物群落的更替密切相关。在贮藏的前期,白切鸡中原有一些中温微生物因为不能适应4 ℃的环境条件相继死亡,致使此时其中的微生物总数表现出下降趋势。随后,白切鸡中的一些嗜冷和兼性嗜冷微生物开始大量繁殖,微生物总数升高。由于在4 ℃的环境中嗜冷和兼性微生物的生长速率较低,所在微生物总数下降后的一段时间里,微生物总数的变化较小。虽然未加静电场处理的对照组中微生物总数也表现与处理组相近的趋势,但是在贮藏前期,静电场处理组的微生物总数下降更快,在贮藏后期微生物总数上升也较慢,而且上升与下降之间的过渡期也比对照组长1 d左右。这些结果表明,静电场的处理可能会加速微生物死亡、减缓微生物的生长速率,但是,静电场并不会引起微生物的死亡。这与当前诸多文献中所使用的电场装备明显不同[9-11]。
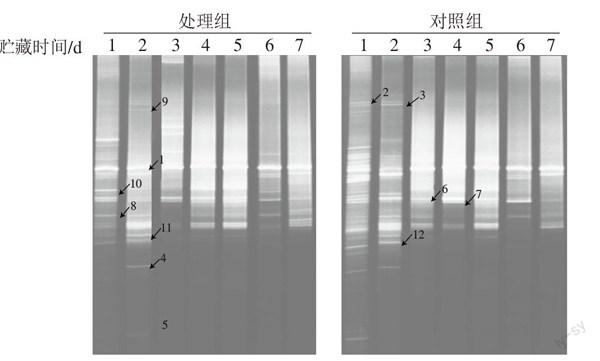
2.2 电场对白切鸡中微生物多样的影响
白切鸡处理组与对照组中的微生物多样性随着贮藏时间的延长发生了较大变化。在贮藏初期检测到较后期更多的条带,这表明白切鸡在烹制结束之后会带有种类众多的微生物[2,12]。这些种类众多的微生物主要来源于原料鸡,因为白切鸡烹制时间较短,未能完全杀灭其中的微生物[12]。在贮藏进入第3、4 天时,微生物的种类急剧下降。这主要是因为在4 ℃的环境中不能适应的微生物大量死亡,而适应该环境的微生物还未大量增殖。随着贮藏时间的继续延长,适应贮藏条件微生物大量繁殖,从而在DGGE图谱中表现出更多的条带。白切鸡中微生物总数的这种变化均势与其他肉类产品类似[13-14]。
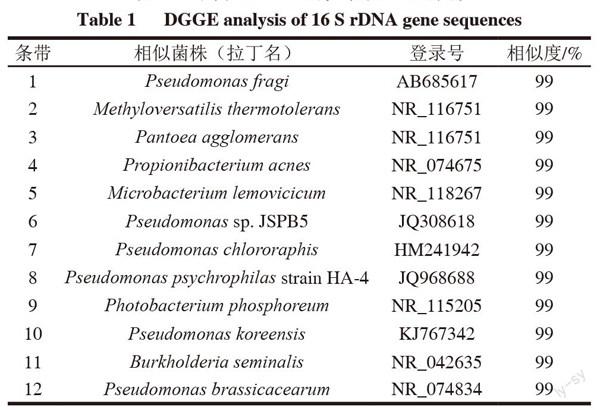
2.3 DGGE中主要条带的鉴定
条带 相似菌株(拉丁名) 登录号 相似度/%
1 Pseudomonas fragi AB685617 99
2 Methyloversatilis thermotolerans NR_116751 99
3 Pantoea agglomerans NR_116751 99
4 Propionibacterium acnes NR_074675 99
5 Microbacterium lemovicicum NR_118267 99
6 Pseudomonas sp. JSPB5 JQ308618 99
7 P. chlororaphis HM241942 99
8 P. psychrophilas strain HA-4 JQ968688 99
9 Photobacterium phosphoreum NR_115205 99
10 Pseudomonas koreensis KJ767342 99
11 Burkholderia seminalis NR_042635 99
12 Pseudomonas brassicacearum NR_074834 99
假单胞菌是白切鸡中主要的腐败微生物,占鉴定条带的50%,它在白切鸡的整个贮藏过程中一直是优势菌株,这与王志江等[2]的研究结果一致。此外,本研究在白切鸡中还检测到了泛菌属、微杆菌属、发光杆菌属、伯克霍尔德菌属及克雷伯氏属等的微生物。这些结果再次表明白切鸡中的微生物具有较高的多样性。
虽然王志江[2]、蒋宇飞[12]等也对白切鸡贮藏过程的微生物总数的变化做了研究,但是这些研究的对象多是经过超高压、微波等减菌手段处理过的真空包装产品,没有真实地反应出白切鸡中原有微生物的组成。本研究虽然也使用静电场处理的手段,但是与对照组相比静电场的作用并没有从DGGE的条带上明显地表现出来,这也表明静电场是一种比较温和的处理方式,它不能彻底地杀死白切鸡中的微生物。
2.4 白切鸡中腐败微生物的分离鉴定
通过DGGE分析,确定了白切鸡中主要的腐败微生物为假单胞菌,但是此方法并不能获得纯的肉源性假单胞菌。因此,对白切鸡中的假单胞菌进行了分离和鉴定。通过多次纯化和鉴定,共获得了5 种假单胞菌,分别为P. koreensis、P. fragi、P. chlororaphis、Pseudomonas sp. JSPB5和P. psychrophilas strain HA-4。其中,P. koreensis、P. chlororaphis和P. fragi是生肉及其制品中最主要的腐败微生物[8, 16-19]。分离、鉴定的结果与DGGE分析结果基本一致,这也表明假单胞菌是引起白切鸡腐败的主要微生物。本研究的结果也再次证实了“鸡中第一鲜”的白切鸡确实存在杀菌不彻底的问题[12]。
2.5 静电场对纯种微生物的影响
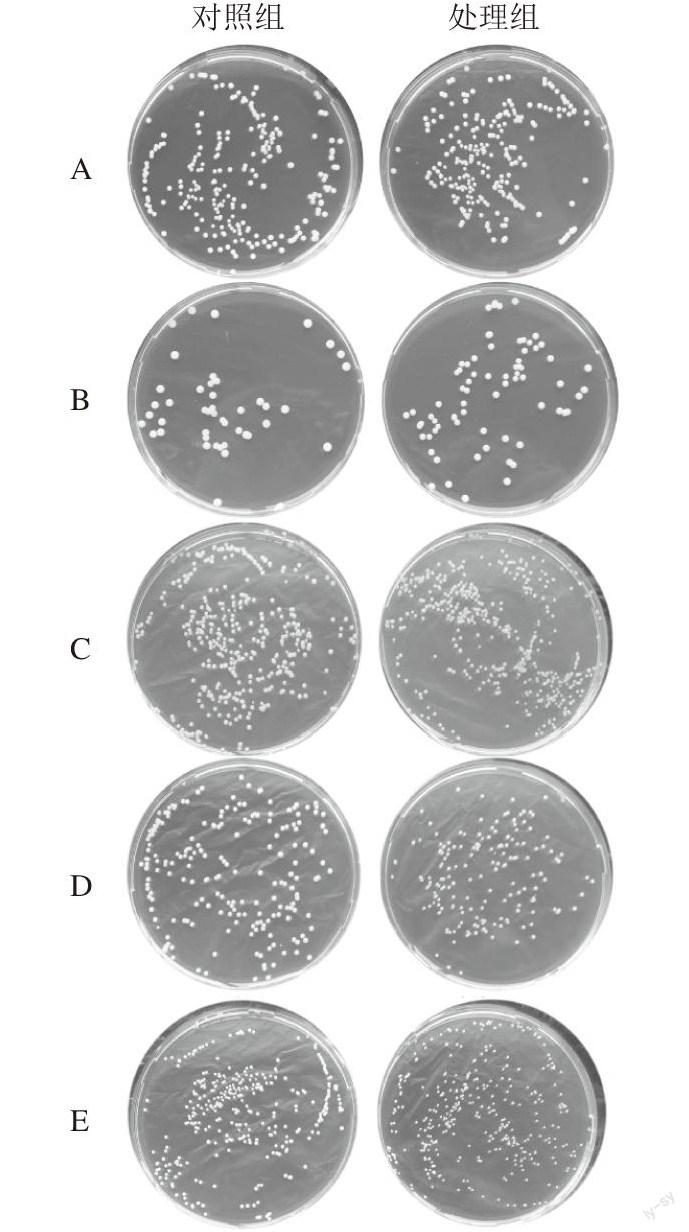
为以获得的5 种假单胞菌为研究对象,研究静电场对它们在固体培养基上生长时的特性,结果如图3所示。
A. P. koreensis;B. Pseudomonas sp. JSPB5;C. P. chlororaphis;D. P. psychrophilas strain HA-4;E. P. Fragi。
不同假单胞菌株对静电场的响应方式差异较大。与对照组相比,静电场中培养的P. koreensis和Pseudomonas sp. JSPB5几乎没有表现出明显的生长抑制,而P. chlororaphis、P. psychrophilas和P. fragi则表现出了明显的生长抑制。这表明静电场对微生物生长的影响是有种属差异性的。
静电场对微生物菌株的影响是通过改变微生物及其内部生命大分子的电荷分布来达到的[20]。在真核生物中,微管蛋白通常很容易受电场作用而导致真核细胞的分裂出现异常[21]。作为原始生物的假单胞菌虽然不存在真核生物那样的微管结构,但是存在与微管功能类似的FtsZ[22],从而使其成为电场作用的一个目标[11]。另外,电场也可能会干扰到酶与底物分子的结合及酶的正常功能,从而影响到微生物细胞的正常代谢活动[19]。
3 结 论
白切鸡是一种原始带菌量比较高的产品,通过静电场处理可以延长白切鸡产品的货架期。白切鸡中的微生物以来源于产品原料的假单胞菌属的微生物为主。静电场对纯种微生物生长的抑制存在种属差异性。
参考文献:
[1] 陈文波, 郭昕, 徐芬, 等. 不同制作工艺对白切鸡食用与卫生品质的影响[J]. 肉类研究, 2014, 28(5): 16-19.
[2] 王志江, 何瑞琪, 蒋爱民, 等. 超高压处理白切鸡在冷藏过程中微生物和品质的变化[J]. 食品与机械, 2010, 26(2): 43-47.
[3] CRAVEN H M, SWIERGON P, NG S, et al. Evaluation of pulsed electric field and minimal heat treatments for inactivation of Pseudomonads and enhancement of milk shelf-life[J]. Innovative Food Science and Emerging Technologies, 2008, 9(2): 211-216.
[4] AKDEMIR E G, BAYSAL T, ICIER F, et al. Processing of fruits and fruit juices by novel electrotechnologies[J]. Food Engineering Reviews, 2012, 4(1): 68-87.
[5] NOVAK J S, JUNEJA V K. Effects of refrigeration or freezing on survival of Listeria monocytogenes Scott A in under-cooked ground beef[J]. Food Control, 2003, 14(1): 25-30.
[6] CHEN Jinru, BRODY A L. Use of active packaging structures to control the microbial quality of a ready-to-eat meat product[J]. Food Control, 2013, 30(1): 306-310.
[7] 中华人民共和国卫生部. GB 4789.2—2010 食品微生物学检验 菌落总数测定[S]. 北京: 中国标准出版社, 2010.
[8] DANILO E, REDERICA R, ANTONELLA N, et al. Mesophilic and psychrotrophic bacteria from meat and their spoilage potential in vitro and in beef[J]. Applied and Environmental Microbiology, 2009, 75(7): 1990-2001.
[9] del POZO J L, ROUSE M S., MANDREKAR J N, et al. The electricidal effect: reduction of Staphylococcus and Pseudomonas biofilms by prolonged exposure to low-intensity electrical current[J]. Antimicrobial Agents and Chemotherapy, 2009, 53(1): 41-45.
[10] OBERMEIER A, MATL FLORIAN D, FRIESS W, et al. Growth inhibition of Staphylococcus aureus induced by low-frequency electric and electromagnetic fields[J]. Bioelectromagnetics, 2009, 30(4): 270-279.
[11] GILADI M, PORAT Y, BLATT A, et al. Microbial growth inhibition by alternating electric fields[J]. Antimicrob Agents Chemotherapy, 2008, 52(10): 3517-3522.
[12] 蒋宇飞, 芮汉明. 白切鸡微波杀菌后在冷藏过程中的品质变化[J]. 食品工业科技, 2007, 29(4): 258-261.
[13] NYCHAS G J, SKANDAMIS P N, TASSOU C C, et al. Meat spoilage during distribution[J]. Meat Science, 2008, 78(1/2): 77-89.
[14] ZHAO Fan, ZHOU Guanghong, YE Keping, et al. Microbial changes in vacuum-packed chilled pork during storage[J]. Meat Science, 2015, 100: 145-149.
[15] GILADI M, PORAT Y, BLATT A, et al. Microbial growth inhibition by alternating electric fields in mice with Pseudomonas aeruginosa lung infection[J]. Antimicrobial Agents and Chemotherapy, 2010, 54(8): 3212-3218.
[16] HINTON JR. A, CASON J A, INGRAM K D. Tracking spoilage bacteria in commercial poultry processing and refrigerated storage of poultry carcasses[J]. International Journal of Food Microbiology, 2004, 91(2): 155-165.
[17] OLOFSSON T C, AHRN? S, MOLIN G. Composition of the bacterial population of refrigerated beef, identified with direct 16S rRNA gene analysis and pure culture technique[J]. International Journal of Food Microbiology, 2007, 118(3): 233-240.
[18] MERTZ A W, KOO OK K, O'BRYAN C A, et al. Microbial ecology of meat slicers as determined by denaturing gradient gel electrophoresis[J]. Food Control, 2014, 42: 242-247.
[19] CASABURI A, PIOMBINO P, NYCHAS G J, et al. Bacterial populations and the volatilome associated to meat spoilage[J]. Food Microbiology, 2014, 45A: 83-102.
[20] JAIN S, SHARMA A, BASU B. Vertical electric field induced bacterial growth inactivation on amorphous carbon electrodes[J]. Carbon, 2015, 81: 193-202.
[21] KIRSON E D., GURVICH Z, SCHNEIDERMAN R, et al. Disruption of cancer cell replication by alternating electric fields[J]. Cancer Research, 2004, 64: 3288-3295.
[22] FELDER C E., PRILUSKY J, SILMAN I, et al. A server and database for dipole moments of proteins[J]. Nucleic Acids Research, 2007, 35: W512-521.

