不同健脾中药对饮食诱导肥胖大鼠肥胖程度及胰岛素抵抗的影响
张佳琪等

摘要:目的 观察运脾、升清、补脾中药对饮食诱导肥胖(DIO)大鼠肥胖程度及脂肪激素、胰岛素抵抗(IR)的影响,从不同健脾中药中进一步筛选抗肥胖药物。方法 Wistar大鼠130只,10只作为空白组,给予基础饲料,其余120只给予高脂饲料13周喂饲,按体质量得到DIO大鼠50只和饮食诱导肥胖抵抗(DIO-R)大鼠10只,DIO大鼠分为模型组、西布曲明组、运脾组、升清组、黄芪组,每日分别给予生理盐水、西布曲明、运脾药(苍术和厚朴)、升清药(柴胡和枳实)、补气健脾药(黄芪)灌胃,空白组与DIO-R组予生理盐水灌胃。灌胃期间空白组予基础饲料,余6组继续予高脂饲料喂饲。取血测定胰岛素抵抗指数(IRI)、血糖、三酰甘油、胆固醇、肿瘤坏死因子-α(TNF-α)、脂联素,取脂肪匀浆测定TNF-α、脂联素。结果 模型组体质量、IRI、胆固醇升高(P<0.01),脂肪匀浆中脂联素降低(P<0.01),血清和脂肪匀浆TNF-α升高(P<0.01);与模型组比较,DIO-R组治疗前后体质量、IRI、胆固醇均明显降低(P<0.01),脂肪匀浆脂联素升高(P<0.01);西布曲明组治疗后体质量、胆固醇均明显降低(P<0.01),血清和脂肪中TNF-α减低(P<0.05);升清组治疗后体质量、IRI、胆固醇降低(P<0.05,P<0.01),血清和脂肪匀浆中TNF-α均减低(P<0.05,P<0.01),脂肪匀浆中脂联素升高(P<0.05);运脾组IRI、胆固醇和血清中TNF-α降低(P<0.05,P<0.01),血清和脂肪中脂联素升高(P<0.05);黄芪组体质指数、血糖、IRI、胆固醇降低(P<0.05,P<0.01),血清和脂肪中TNF-α降低、脂联素升高(P<0.05,P<0.01)。结论 黄芪可以抑制高脂饲料诱导的肥胖,改善糖脂代谢紊乱和IR优于运脾、升清中药,其机制与降低TNF-α和升高脂联素水平相关。
关键词:健脾中药;饮食诱导肥胖;饮食诱导肥胖抵抗;胰岛素抵抗;脂联素;肿瘤坏死因子-α;大鼠
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2015)06-0064-05
肥胖患者常有不同程度的胰岛素抵抗(insulin resistance,IR)。IR促使糖耐量正常人群糖耐量恶化,促进肥胖机体进一步增重,同时也在高血压、高血脂、动脉粥样硬化等发病中起着重要作用[1-2]。我们前期实验发现,运脾、升清、补脾药物可抑制饮食诱导肥胖(DIO)大鼠的肥胖和IR,其机制可能与降低脂肪肿瘤坏死因子-α(TNF-α)和升高脂联素有关[3-5]。《本草蒙筌》言:(黄芪)入足太阴经……中补脾胃;柴胡透达少阳之邪以升清,枳实攻破阳明之邪以降浊,两药配用可升清降浊;苍术苦温主升,厚朴苦温主降,二者配伍可恢复脾运。因此,本研究对黄芪、柴胡与枳实、苍术与厚朴进行比较,进一步探索不同健脾中药对DIO大鼠肥胖和IR的影响。
1 材料与方法
1.1 动物及饲料
普通级Wistar大鼠130只,雄性,4周龄,体质量150~195 g,山东中医药大学实验动物中心提供,动物合格证号SCXK(鲁)2008-0002。基础饲料由山东大学实验动物中心提供;高脂饲料:自购原料,采用本实验室饲料制作方法[5],山东大学实验动物中心加工。配方为基础饲料82%加猪油8%、豆粉2%、蔗糖8%。
1.2 主要试剂与仪器
胰岛素、TNF-α放免试剂盒及脂联素酶免试剂盒,美国abcam,批号GR70529-3;ELX808酶标仪、ELX50型洗板机,美国BIO-TEK INSTRUMENTS,INC;DDL-5冷冻离心机,上海安亭科学仪器厂;SN-695型智能放免γ测量仪,上海核所日环光电食品有限公司;OLYMPUS AU2700全自动生化分析仪,日本OLYMPUS有限公司;ME235P电子分析天平,德国赛多利斯。
1.3 药物
本实验所用药材,经山东中医药大学天然药物重点实验室李峰教授鉴定,苍术为茅苍术或北苍术的干燥根茎,厚朴为木兰科植物厚朴或凹叶厚朴的干燥干皮、根皮及枝皮,柴胡为伞形科植物柴胡或狭叶柴胡的干燥根或全草,枳实为芸香科植物酸橙及其栽培变种或甜橙的干燥幼果,黄芪为豆科植物黄芪或内蒙黄芪的干燥根。对苍术和厚朴(各15 g)、柴胡和枳实(各15 g)、黄芪(30 g)3组药物进行粉粹,10倍量水煎2次,2次药液混合,低温浓缩至浓度为1 g原药材/mL (山东中医药大学附属医院制剂室提供)。盐酸西布曲明胶囊(太极集团涪陵制药厂,批号0309002)。
1.4 造模、分组与给药
130只实验大鼠适应性饲养1周后,随机选择10只为空白组,给予基础饲料,其余120只给予高脂饲料。造模期间,每周测体质量(精确到0.1 g),观察大鼠造模情况。13周后,根据文献[6],造模组大鼠体质量≥基础组体质量均值加1.4倍标准差者为DIO大鼠,体质量<基础组体质量均值加1倍标准差者为DIO-R大鼠。对DIO大鼠按照体质量从高到低取50只,随机分为5组,即模型组、西布曲明组、运脾组、升清组、黄芪组,每组10只。对DIO-R大鼠,取状态良好、体质量较小者10只。各中药组以30 g作为成人(60 kg体质量)使用剂量,西布曲明15 mg/d作为成人使用剂量,根据“常用动物与人体表面积比值”计算大鼠灌胃药量。空白组、DIO-R组和模型组予生理盐水2 mL/d,西布曲明组予西布曲明8 mg/(kg·d),运脾组、升清组、黄芪组各组分别给予苍术和厚朴3.2 g原药材/(kg·d)、柴胡和枳实3.2 g原药材/(kg·d)、黄芪3.2 g原药材/(kg·d),共12周。
1.5 动物处理
实验期间,每日观察大鼠生长情况、饮食、粪便,每周记录给食量、体质量(精确到0.1 g)。12周后,去除动物撕咬、灌胃等原因死亡后,存留动物数见表1。禁食12 h后,麻醉测量各组大鼠体质量,体长(从鼻尖到肛门的长度)。常规解剖,腹主动脉取血,测空腹血糖,低温离心,分离血清待测。动物处死后,剥离腹腔内(腹后、大网膜、睾丸)全部脂肪,同一部位取脂肪组织,每克脂肪组织加5 mL生理盐水,10 000 r/min离心10 s×3次,制备20%脂肪组织匀浆,4000 r/min离心10 min,取上清液,-20 ℃保存待测。
1.6 观察指标
1.6.1 肥胖程度 参考文献[7]方法计算体质量指数(Lee's指数)。
1.6.2 血脂、血糖和胰岛素抵抗指数检测 取待测血清,用全自动生化分析仪测定胆固醇、三酰甘油、血糖,采用放射免疫竞争法测定血清胰岛素含量,并计算胰岛素抵抗指数(IRI)=空腹血糖×空腹血胰岛素÷22.5。
1.6.3 血清和脂肪匀浆中脂联素、肿瘤坏死因子-α检测 放射免疫法测定血清和脂肪匀浆中TNF-α,酶联免疫法测定血清和脂肪匀浆中脂联素,严格按照试剂盒操作方法进行。
1.7 统计学方法
采用SPSS17.0统计软件进行分析。计量资料以—x±s表示,多组比较用方差分析,组间比较采用SNK检验。P<0.05表示差异有统计学意义。
2 结果
2.1 不同健脾中药对大鼠肥胖程度的影响
高脂饮食造模后,DIO各组体质量明显升高(P<0.01)。与空白组比较,模型组治疗前后体质量均升高(P<0.05,P<0.01);与DIO-R组比较,DIO组造模后、治疗后体质量均升高(P<0.05,P<0.01)。药物干预后,西布曲明组治疗后体质量明显减低(P<0.01);升清组治疗后体质量降低(P<0.05);黄芪组治疗后体质量、Lee's指数均降低(P<0.05)。西布曲明干预后体质量减轻效果比升清、运脾和黄芪组明显(P<0.05,P<0.01),但黄芪在降低Lee's指数方面优于其他3组(P<0.05,P<0.01)。结果见表1。
2.2 不同健脾中药对大鼠胰岛素抵抗指数及血糖、血脂的影响
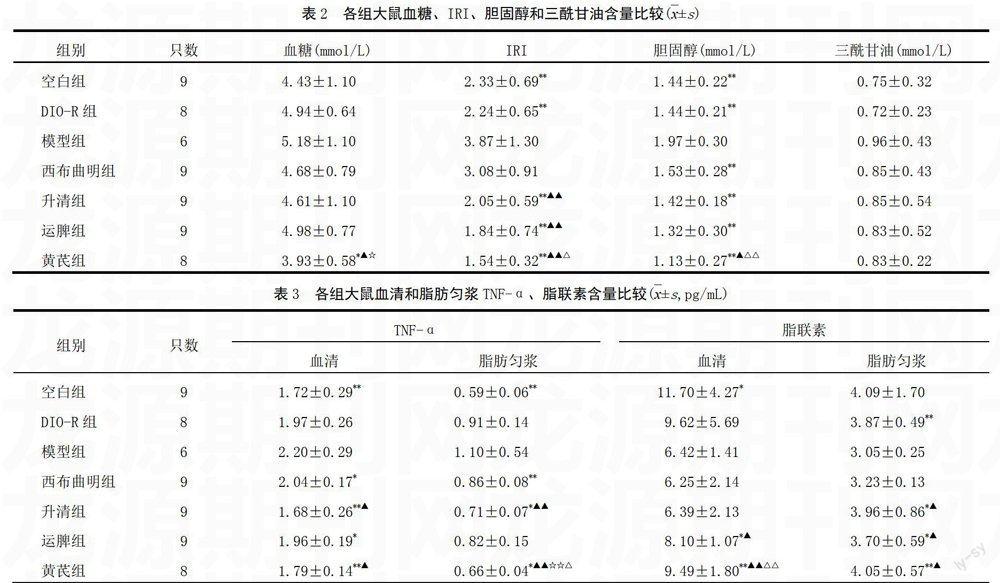
模型组IRI、胆固醇明显高于空白组与DIO-R组(P<0.01)。药物干预后,4组胆固醇明显低于DIO组(P<0.01);升清组、运脾组和黄芪组IRI明显低于DIO组(P<0.01);黄芪组降低血糖效果优于DIO组(P<0.05)。各给药组间比较发现,升清组、运脾组和黄芪组IRI低于西布曲明组(P<0.01);黄芪降低胆固醇方面优于西布曲明组(P<0.05)。与升清组比较,黄芪组IRI、胆固醇明显降低(P<0.05,P<0.01);与运脾组比较,黄芪组血糖明显降低(P<0.05)。结果见表2。
2.3 不同健脾中药对大鼠血清及脂肪肿瘤坏死因子-α、脂联素含量的影响
模型组血清和脂肪TNF-α高于空白组(P<0.01),脂联素降低于空白组(P<0.05);与模型组比较, DIO-R组脂肪中脂联素升高(P<0.05)。药物干预后,与模型组比较,西布曲明组血清和脂肪TNF-α降低(P<0.05,P<0.01);升清组血清和脂肪TNF-α降低(P<0.05,P<0.01),脂肪脂联素升高(P<0.05);运脾组血清TNF-α降低(P<0.05),血清和脂肪脂联素降低(P<0.05);黄芪组血清和脂肪TNF-α降低、脂联素升高(P<0.05,P<0.01);与西布曲明组比较,升清组血清和脂肪TNF-α降低(P<0.05,P<0.01),脂肪脂联素升高(P<0.05);运脾组血清和脂肪脂联素升高(P<0.05);黄芪组血清和脂肪TNF-α降低、脂联素升高(P<0.05,P<0.01);与升清组比较,黄芪组脂肪TNF-α降低、血清脂联素升高(P<0.05,P<0.01)。见表3。
3 讨论
IR被认为是肥胖、糖尿病、高血压及动脉粥样硬化等多种疾病的病理生理基础,是中心性肥胖和代谢紊乱性疾病的共同病理机制[8-9]。目前普遍认为,IR对代谢紊乱性疾病的预测和诊治更具有指导意义。长期高脂饮食是诱导IR的重要原因,本实验采用DIO大鼠模型,能够较好地模拟肥胖患者IR的发病过程。
肥胖患者高水平的TNF-α在IR的形成中起着重要作用,其机制与TNF-α减少胰岛素受体底物IRS的酪氨酸磷酸化,降低胰岛素敏感性;抑制葡萄糖转运蛋白-4的表达,进而抑制胰岛素刺激的葡萄糖转运,削弱葡萄糖的摄取和利用;促进脂肪分解,致游离脂肪酸增高等有关。脂联素是一种胰岛素增敏剂,它可以抑制糖异生酶,减少肝糖原输出[10];还可以通过磷酸化激活骨骼肌和肝脏的腺苷酸活化蛋白激酶,使过氧化物酶体增殖物激活受体-γ作用增加,从而刺激糖利用和脂肪酸氧化来增加胰岛素敏感性。在胰岛素抵抗相关疾病,如2型糖尿病、肥胖和脂代谢紊乱中,血浆脂联素水平均明显下降[11-12]。本实验中,模型大鼠胆固醇、TNF-α均明显升高,脂联素水平降低,血糖和三酰甘油有升高趋势,这与IRI升高相一致,表明高脂饮食可影响TNF-α和脂联素的合成与分泌,导致IR、糖脂代谢紊乱。
脂肪激素异常,导致IR,从而导致脂肪蓄积,这种代谢紊乱与传统中医学的脂膏沉积不能被机体所用的“脾失健运、脾不升清”有非常大的相关性。脾胃为后天之本,主运化,主升清,脾气健运,才能将化生的气、血、津液,输布到全身脏腑组织,中医学早在金元时期即认识到肥胖和脾虚的关系,如《脾胃论·脾胃盛衰论》言:“脾胃俱旺,则能食而肥。脾胃俱虚……或少食而肥,虽肥而四肢不举。”因此,治脾是治疗肥胖的根本大法,我们欲从运脾、升清和补气健脾方面探讨中药对肥胖及IR的影响作用。“脾健不在补贵在运”,《本草崇原》明确指出“凡欲运脾,则用苍术”,并认为厚朴可“运土而助脾”,所以本实验选择苍术、厚朴作为运脾药。《本草纲目》有:“升麻,柴胡,引生发之气上行……柴胡引少阳清气上行”,柴胡配枳实作为升清组是取其升清降浊之效。黄芪味甘,性微温,入脾肺经,《本草新编》言“黄芪乃补气之圣药”,《神农本草经百种录》有“黄芪,甘淡而温,得土之正味、正性,故其功专补脾胃”,可见黄芪有补气健脾、恢复脾运的功效,更好地输布水谷精微,使蓄积的膏脂重新被机体利用,此外《药性赋》谓其“味甘……升也,阳也……”,黄芪亦可升清气,故用黄芪单独成组,用以补气健脾,升举清气,从整体调整肥胖患者的形盛而气不足的病理状态,探索其在治疗肥胖及对胰岛素抵抗的影响。
本实验结果表明,与模型组比较,西布曲明、升清药物、运脾药物和黄芪均能抑制体质量和胆固醇增加,且黄芪在降低Lee's指数方面优于其他药物。前期实验和本实验均显示,运脾、升清药物可以改善胰岛素的敏感性,抑制IR的发生,且其机制与降低TNF-α、升高脂联素水平相关。本研究发现,升清药物抑制IR主要是降低了TNF-α水平,运脾药物抑制IR主要是升高脂联素水平,而黄芪对降低TNF-α和升高脂联素均有影响。
参考文献:
[1] 陈家伟.2型糖尿病胰岛素抵抗与心血管疾病[J].心脑血管病防治, 2003,3(2):2-4.
[2] 邹大进,田建卿.胰岛素抵抗与心血管疾病的关系[J].诊断学理论与实践,2009,8(3):252-255.
[3] 姜萍,姜月华.运脾与化湿祛痰药物对饮食诱导肥胖大鼠肥胖程度及脂肪激素、瘦素抵抗的影响[J].中国中西医结合杂志,2014,25(8):997-1002.
[4] 姜萍,林海青,李晓.补脾与醒脾药物抗DIO大鼠肥胖疗效及对脂肪激素和炎症因子的影响[J].中华中医药杂志,2014,29(6):1830-1834.
[5] 姜萍,宋钦兰.升清中药对饮食诱导肥胖大鼠瘦素抵抗的影响[J].中国中医药信息杂志,2014,21(8):60-63.
[6] LI Xiao, Jiang Ping, Fu Chang-geng. Preliminary comparative study on the effect of different Chinese drugs for strengthening pi in Antagonizing diet induced obesity[J]. Chin J Integr Med,2010, 16(2):138-144.
[7] 施万英,姚兴家,董丹娜,等.饮食诱导肥胖大鼠血清TNF-α水平探讨[J].中国公共卫生,2002,18(5):573-574.
[8] Shi HL, Zheng QL, WU DZ. The preventive effect of evodia-mine on vascular hypertrophy in obese rats[J]. Chin Pharmacol Bull, 2011,27(12):1687-1692.
[9] Muse ED, Obici S, Bhanot S, et al. Role of resistin in diet- induced hepatic insulin resistance[J]. J Clin Invest,2004,114:232-239.
[10] Furukawa N, Araki E. Type 2 diabetes and impaired glucose tolerance[J]. Nihon Rinsho,2013,71(2):270-274.
[11] Berg AH, Combs TP, Du X, et al. The adipocyte-secreted protein Acrp30 enhances hepatic insulin action[J]. Nat Med,2001,7(8):947-953.
[12] Fang X, Sweeney G. Mechanisms regulating energy metabolism by adiponectin in obesity and diabetes[J]. Biochemical Society Transactions,2006,34(5):798-801.
(收稿日期:2014-10-28)
(修回日期:2014-11-10;编辑:华强)

