枇杷果皮中多酚物质提取和纯化工艺的优化
林建城 林海兰 黄书斌 张燕清

摘 要 以枇杷果皮为材料,提取分离和纯化枇杷多酚类物质,试验确定乙醇为多酚浸提溶剂,通过正交试验优化乙醇浸提枇杷果皮多酚的工艺参数。结果表明:液料比10.0 ∶ 1(mL ∶ g),80 ℃下,在50%体积分数的乙醇中浸提90 min,连续浸提2次,多酚得率可达34.76 mg/g DW(干重)。运用静态吸附和动态吸附试验对大孔吸附树脂及对多酚纯化工艺条件进行筛选,从AB-8、LX-1、NKA-9、D101、XAD-5和DM301等6种大孔吸附树脂中筛选出的XAD-5型树脂具有较好的吸附及解吸性能,吸附率和解吸率分别达到76.44%和74.32%。XAD-5型树脂纯化枇杷多酚的工艺条件为:进样浓度1.50 mg/mL,样液体积5 BV,进样流速1.5 BV/h,洗脱剂乙醇体积分数为70%,洗脱流速1.5 BV/h,洗脱体积1.2 BV,此工艺下枇杷果皮多酚纯度可达76.52%,回收率为56.44%。
关键词 枇杷果皮;多酚;提取与纯化;乙醇;大孔吸附树脂
中图分类号 TS209 文献标识码 A
Abstract The polyphenols were extracted and purified from loquat pericarp(Eriobotrya japonica Lind1.). The extraction and purification technology for loquat pericarp polyphenols were determined through orthogonal experiments based on single factors. Results showed the ethanol was a suitable extraction solvent. The optimal polyphenols extraction conditions were as follows: liquid-to-material ratio 10.0 ∶ 1(mL ∶ g), extraction temperature 80 ℃, ethanol volume fraction 50%(V/V), extraction time 90 min, and two successive extraction, and the extraction amount of polyphenols reached 34.76 mg/g(dry weight). Meanwhile, six different types(XAD-5, NKA-9, LX-1,DM301, AB-8 and D101)of macroporous resin were selected under the condition of static adsorption, and finally the optimum purification parameters were established with dynamic adsorption. Results indicated that XAD-5 was selected as the ideal adsorbent as it had a strong adsorption ability and a high desorption rate. The final adsorption rate and desorption rate was 76.44% and 74.32%, respectively. The best adsorption conditions were found to be 1.50 mg/mL of polyphenols sample solution concentration, poyphenols sample solution volume was five times of the bed volume(BV), and a flow rate of 1.5 BV/h. Whereas the optimal desorption conditions were found to be a flow rate of 1.2 BV ethanol of 70% volume fraction for elution. The purity of loquat pericarp polyphenols was 76.52% and the recovery was 56.44%.
Key words Loquat pericarp; Polyphenols; Extraction and purification; Ethanol; Macroporous absorbent resin
doi 10.3969/j.issn.1000-2561.2015.07.027
枇杷(Eriobotrya japonica Lind1.)系蔷薇科枇杷属常绿乔木,是福建省的六大名果之一。枇杷成熟期集中,为了解决枇杷鲜果的供求关系,枇杷深加工产品越来越多,如枇杷罐头、枇杷果汁、枇杷膏及枇杷酒等,这些生产加工后剩余的枇杷果皮,除少量被加工成饲料或作为肥料、燃料使用外,绝大部分被当成垃圾深埋,严重污染了环境,造成了资源的巨大浪费,所以综合利用枇杷资源、开发新型的枇杷深加工产品具有重要意义。
“植物多酚”是由Haslam[1]根据单宁分子结构和分子量提出的,涵盖所有单宁及其衍生物,是植物的次生代谢产物,可分为简单酚类、酚酸类、羟基肉桂酸类和黄酮类化合物等[2]。现已从茶叶、葡萄、苹果、梨等多种植物中获取了黄酮类、儿茶素类、白藜芦醇、酚酸类等多种酚类物质[3]。植物多酚物质除具有抗氧化和抗菌作用外,还表现出抗肿瘤、抗突变和抗病毒等多种生物活性[4]。近年来,植物叶、花、果中多酚的开发和利用已成为了研究热点,Nawaz等[5]用乙醇为浸提溶剂从葡萄核中提取多酚,多酚得率达到11.4%;黄阿根等[6]从茶树花中提取纯化出多酚,纯度达86.32%;而枣核、枣果、苹果中多酚的抗氧化性、苹果多酚组分及其多酚在抗过敏反应中的作用也已阐明[7-8];茶多酚和葡萄多酚等已被广泛运用在医药、保健品、化妆品和食品行业。此外,从枇杷叶中已提取到类黄酮与绿原酸,且具有较强的抗氧化作用[9];同时发现枇杷叶多酚能抑制口腔鳞状上皮细胞瘤和唾液腺瘤细胞的生长[10]。然而,对枇杷果实多酚鲜有研究,枇杷加工副产物的利用研究还是空白。本课题以枇杷果皮为原料,采用浸提法提取枇杷果皮多酚,确定浸提溶剂和浸提技术参数,并对以大孔吸附树脂纯化的工艺进行优化,为枇杷果皮深加工利用提供参考。
1 材料与方法
1.1 材料
选取‘解放钟枇杷(Eriobotrya japonica Lindl. cv. Jiefangzhong)果皮,清洗干净、沥干,50 ℃下烘干后粉碎,经100目过筛,得果皮干粉,4 ℃储藏。
1.2 方法
1.2.1 枇杷果皮多酚提取 将一定量枇杷果皮干粉装入具塞试管,加入乙醇,振荡(120 r/min)提取,2 150×g下离心10 min,上清液定容至50 mL,待测。
1.2.2 枇杷多酚含量测定 采用Folin-Ciocalteu法[11]测定枇杷总酚含量,以没食子酸为标样,测定标准曲线,建立了回归方程:y=44.028 6x-0.020 9,R2=0.996 7。
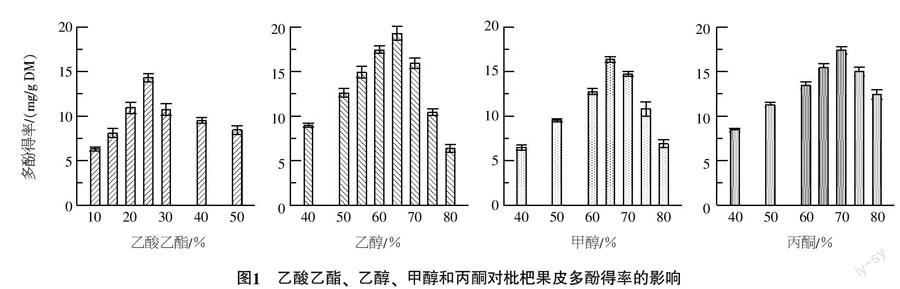
1.2.3 浸提溶剂的确定 选择水、乙酸乙酯、乙醇、甲醇和丙酮5种溶剂,研究体积分数为10%、15%、20%、25%、30%、40%、50%的乙酸乙酯对枇杷多酚浸提得率的影响;研究体积分数为40%、50%、60%、65%、70%、75%、80%的乙醇、甲醇和丙酮对枇杷多酚浸提得率的影响,确定合适的浸提溶剂。
1.2.4 浸提工艺参数的确定 先进行单因素试验,研究乙醇体积分数(40%~80%)、液料比(5.0 ∶ 1~20.0 ∶ 1)、温度(40~90 ℃)、浸提时间(30~120 min)和提取次数等5个因素对枇杷多酚得率的影响。再确定4个主要影响因素,A:乙醇体积分数(%);B:液料比(mL ∶ g);C:温度(℃);D:浸提时间(h),选用L16(45)正交试验设计(表1),优化枇杷果皮多酚浸提的工艺参数。
1.2.5 大孔树脂静态吸附试验 按王思新等[12]的方法,对AB-8、LX-1、NKA-9、D101、XAD-5和DM301等6种大孔树脂进行预处理。再将各树脂分别与枇杷多酚样液混合,25 ℃下振荡(120 r/min)5 h,每隔1 h取样1次,测定OD765nm,计算吸附量(mg/g),绘制静态吸附曲线,筛选吸附树脂。
1.2.6 大孔树脂静态解吸附试验 在3 g已饱和吸附的树脂中加入30 mL的解吸剂,比较70%体积分数的乙酸乙酯、丙酮、甲醇及乙醇等4种解吸剂的静态解吸效果,25 ℃下振荡(120 r/min)解吸2 h,计算解吸率(%),确定适宜的解吸剂(洗脱剂)。
1.2.7 进样流速对树脂动态吸附效果的影响 将样品溶液经过大孔树脂玻璃层析柱(床体积BV,1 BV=22.4 mL)纯化,在进样浓度为1.5 mg/mL下,以多酚漏出率为考察指标,研究1.0、1.5和2.0 BV/h 3种不同进样流速对树脂吸附枇杷多酚动态吸附效果的影响。
1.2.8 进样浓度对树脂动态吸附效果的影响 选择0.75、1.50、3.00 mg/mL 3种进样浓度,研究其对树脂吸附枇杷多酚的动态吸附效果的影响,考察适宜的进样浓度。
1.2.9 乙醇体积分数对多酚解吸效果的影响 选择50%、60%、70%、80%、90%、100%体积分数的乙醇,研究其对大孔树脂吸附枇杷多酚解吸效果的影响,确定乙醇洗脱剂的浓度。
1.2.10 乙醇洗脱速度对多酚解吸效果的影响 洗脱剂乙醇以1.0、1.5、2.0、3.0 BV/h 4种洗脱速度,考察洗脱流速对大孔树脂吸附枇杷多酚解吸效果的影响。
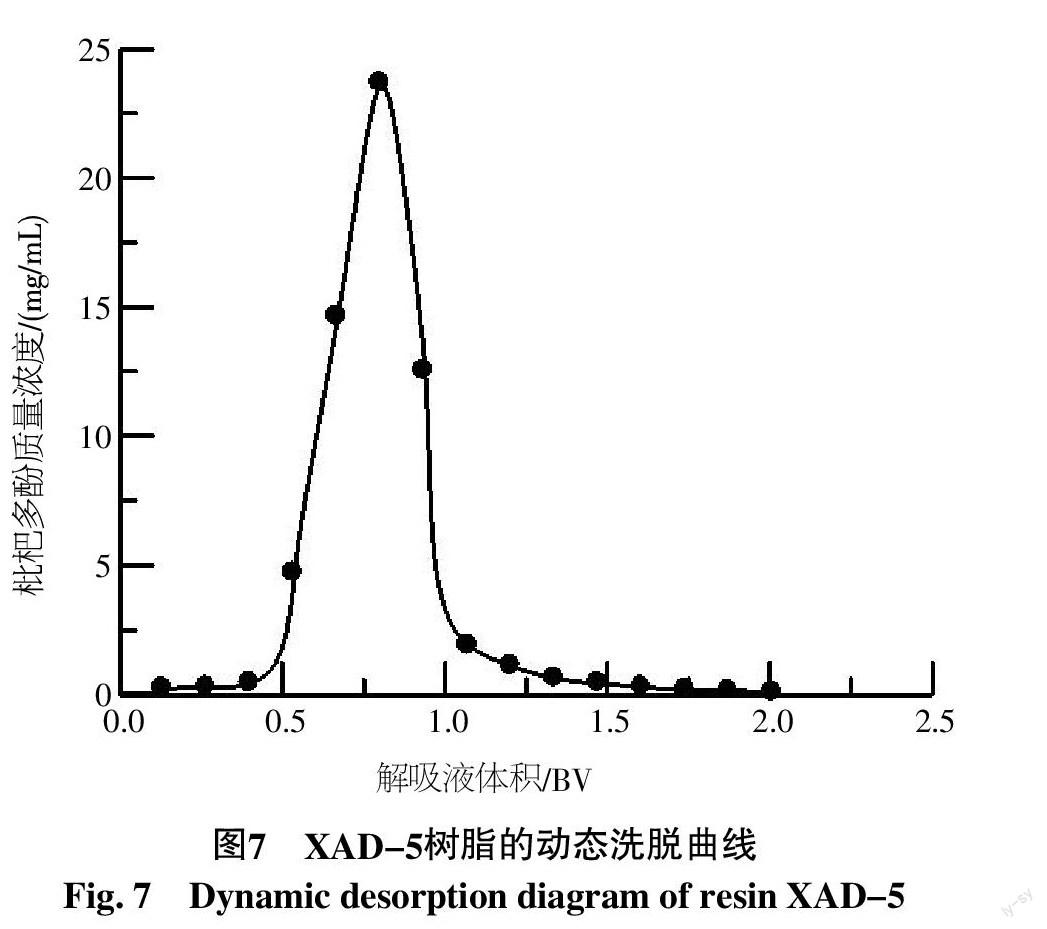
1.2.11 XAD-5树脂的动态洗脱曲线测定 以乙醇为解吸剂(洗脱剂),解吸树脂吸附柱,测定部分收集的流出液中多酚含量,绘制动态洗脱曲线,收集洗脱峰溶液,浓缩后冷冻干燥,求枇杷多酚的回收率(%)与纯度(%)。
1.3 数据处理
(1)枇杷果皮多酚浸提得率计算式。
多酚得率=(枇杷多酚浸提量)/(枇杷果皮干粉量)×100,多酚得率以mg/g DW(干重)表示。
(2)大孔树脂静态吸附试验的吸附量计算式。
吸附量/(mg/g)=(C0-C1)V/W ①
式①中:C0为吸附前供试液多酚浓度(mg/mL);C1为吸附后供试液多酚浓度(mg/mL);V为多酚供试液体积(mL);W为树脂的质量(g)。
(3)大孔树脂静态解吸附试验的解吸率计算式。
解吸率/%=[(C×V)/W]×100 ②
式②中:C为解吸液中枇杷多酚的浓度(mg/mL);V为解吸液总体积(mL);W为吸附总量(mg)。
(4)大孔树脂动态吸附试验的漏出率计算式。
漏出率/%=C1/C0×100 ③
式③中:C0为吸附前供试液多酚浓度(mg/mL);C1为吸附后流出液多酚浓度(mg/mL)。
(5)大孔树脂的动态洗脱的回收率与纯度计算式。
回收率/%=[(C2×V2)/(C1×V1)]×100 ④
纯度/%=[(C2×V2)/W]×100 ⑤
式④、⑤中:C1为进样前多酚溶液浓度(mg/mL);V1为进样前多酚溶液总体积(mL);C2为纯化后多酚浓度(mg/mL);V2为纯化后多酚溶液总体积(mL),W为纯化后多酚干重(mg)。
采用SPSS17.0数据分析软件对以上数据进行统计分析,采用grapher7.0数据绘图软件绘图。
2 结果与分析
2.1 枇杷果皮多酚的浸提工艺
2.1.1 浸提溶剂的确定 比较研究水、乙酸乙酯、乙醇、甲醇和丙酮5种溶剂对枇杷果皮多酚浸提得率的影响,结果(图1)显示:65%体积分数乙醇浸提的多酚得率较高,70%丙酮、65%甲醇和25%乙酸乙酯依次降低,蒸馏水浸提效果最差。甲醇、丙酮和乙酸乙酯3种溶剂均有毒性,因此,筛选出65%乙醇为枇杷果皮多酚的浸提溶剂。
2.1.2 浸提工艺参数的确定 研究乙醇浓度、液料比、浸提时间、浸提温度和提取次数等5种单因素条件下对枇杷多酚得率的影响。结果表明(表1、2):在乙醇体积分数为65%,液料比为10.0 ∶ 1,浸提60 min,80 ℃条件下具有较好的提取效果,且连续浸提2次的利用率较高。进一步采用L16(45)正交试验优化枇杷多酚浸提的最佳工艺参数,结果表明(表3):各因素列的极差R值均明显大于空列,说明乙醇浓度、液料比、浸提时间和浸提温度4个因素对枇杷多酚浸提得率均有影响。比较4个影响因素的极差R值大小为:B>C>A>D,即液料比>浸提温度>乙醇浓度>浸提时间,优化组合为A1B3C4D4,即80 ℃下,液料比10.0 ∶ 1,在体积分数50%乙醇中浸提90 min,连续浸提2次,多酚得率达34.76 mg/g DW。同时,方差分析与显著性检验表明(表4):液料比对多酚浸提得率的影响达到极显著水平(p<0.01),乙醇体积分数和温度的影响均达到显著水平(p<0.05),浸提时间的影响无显著性意义(p>0.05)。
2.2 大孔吸附树脂纯化枇杷果皮多酚工艺
2.2.1 大孔树脂静态吸附试验 从图2可知,6种树脂在前1 h内树脂的吸附量迅速增加,后随吸附时间延长,吸附量缓慢增加。XAD-5树脂对枇杷多酚的吸附量最大,而NKA-9、LX-1、DM301和D101树脂依次降低,AB-8树脂的吸附量最小。XAD-5树脂吸附1 h达到了总吸附量的76.44%;吸附2 h,达吸附总量的85.40%,说明该树脂对枇杷多酚的选择性较强。XAD-5树脂对多酚的饱和吸附量为7.71 mg/g,饱和吸附时间为5 h。
2.2.2 大孔树脂静态解吸附试验 研究6种大孔吸附树脂对枇杷多酚的解吸性能,结果表明:70%体积分数的乙醇解吸剂对XAD-5、NKA-9、LX-1、DM301、AB-8和D101等6种大孔树脂吸附多酚的解吸率分别为74.32%、72.89%、71.87%、62.1%、56.01%和54.22%,而且发现在解吸2 h内均达到解吸平衡。可见,XAD-5大孔树脂对枇杷多酚不仅静态吸附量大,乙醇对XAD-5树脂解吸率也最大,且吸附和解吸效果均好,价格便宜,适合用于枇杷多酚的纯化工艺中。以XAD-5大孔树脂为吸附树脂,进一步比较研究乙酸乙酯、丙酮、甲醇及乙醇4种解吸剂的静态解吸效果。结果显示:体积分数均为70%的乙酸乙酯、丙酮、甲醇及乙醇对XAD-5树脂吸附多酚的解吸率分别为50.23%、65.83%、68.80%和75.82%,乙醇的静态解吸效果好于另外3种解吸剂。因此,乙醇不仅是枇杷多酚良好的浸提剂,也适宜作为多酚的解吸剂(洗脱剂)。
2.2.3 进样流速对树脂动态吸附效果的影响 从图3可看出,随流出液体积的增大,流出液中多酚含量也逐渐增大,漏出率不断提高,以2.0 BV/h进样流速的多酚漏出率较高,1.5 BV/h流速下流出液体积为5.0 BV时吸附逐渐趋于饱和,而1.0、2.0 BV/h进样流速此时漏出率还有所增大,未达到饱和吸附。流速主要是影响溶质向树脂表面的扩散,当进样流速大,多酚与树脂间接触时间短,多酚分子来不及扩散到树脂表面,漏出率则提高;若进样流速慢,吸附量提高,漏出率则下降,但流速太慢又会降低生产效率[4]。为了有效提高树脂的吸附效果和提高生产效率,枇杷多酚浸提液以1.5 BV/h进样流速较为适宜。
2.2.4 进样浓度对树脂动态吸附效果的影响 图4结果显示,0.75、3.00 mg/mL两种进样浓度的漏出率高于1.50 mg/mL进样浓度的漏出率。样品浓度太高,因发生多层吸附,影响树脂内孔的吸附作用,漏出率也会提高[13];同时,样品浓度高,溶液中含有的竞争吸附的杂质也增多,影响了对多酚的吸附。因此,应选择1.50 mg/mL的进样浓度。
2.2.5 乙醇体积分数对多酚解吸效果的影响 图5结果表明,随乙醇浓度增大,多酚解吸率不断提高,70%体积分数的乙醇为洗脱剂时,解吸率达93.36%;而后随乙醇浓度增大,解吸率反而下降。因此,可选用体积分数70%的乙醇溶液为解吸剂。不同乙醇浓度对多酚呈现不同解吸性能,主要原因之一是多酚在不同极性的乙醇溶液中溶解度不同[14]。树脂吸附多酚主要是依靠它们之间所形成的如氢键等次级键的结合力,随乙醇浓度减小溶液极性增大,环境中溶液极性的适当增大会削弱这种结合力,多酚得以解吸,解吸率增大;而当乙醇溶液极性提高到一定程度,与多酚极性相差较大时,可能反而减少了这种削弱作用,解吸作用呈现下降,解吸率也下降。
2.2.6 乙醇洗脱速度对多酚解吸效果的影响 从图6可见,洗脱剂乙醇以1.5 BV/h的流速洗脱,多酚的解吸效果最好,解吸率达到92.17%;后随流速增大,解吸率反而有所下降。乙醇的解吸附作用可能还取决于它与多酚之间的相互作用程度,流速太快,乙醇与被吸附的多酚之间未能进行充分的作用,多酚被置换出来速率下降,解吸率反而降低[4];洗脱剂流速慢,乙醇与多酚间进行了充分作用,但多酚不能及时从大孔树脂微孔表面离开,可能导致多酚与乙醇间的置换量有所减少,解吸率则出现降低现象,而且流速太慢,又延长了生产周期。因此,选择乙醇以1.5 BV/h的流速洗脱。
2.2.7 XAD-5树脂的动态洗脱曲线 枇杷多酚浸提液以1.5 BV/h进样流速上柱,进样浓度为1.5 mg/mL,70%乙醇洗脱剂以1.5 BV/h的流速洗脱。从XAD-5树脂的动态洗脱曲线(图7)可知,乙醇对树脂吸附多酚具有良好的解吸性能,仅0.5 BV就开始洗脱枇杷多酚,到0.8 BV时洗脱的多酚达到最大值23.63 mg/mL,洗脱液达到1.2 BV时枇杷多酚洗脱基本完成。收集洗脱峰多酚溶液,离心后浓缩,冷冻干燥得多酚制品,测得多酚纯度为76.52%,回收率为56.44%。
3讨论与结论
3.1 枇杷果皮多酚的浸提工艺
多酚类物质在植物组织中通常与蛋白质、多糖以氢键和疏水键形式结合成化合物,多酚分子间也是如此。甲醇、乙醇、丙酮、乙酸乙酯等有机溶剂,由于能破坏多酚所形成的氢键,从而减弱了多酚的缔合作用,促进多酚的溶出,且不与多酚物质发生化学反应,浸出的杂质少,易于分离,所以它们是提取多酚中最常用的溶剂。此外,提取温度、时间、料液比以及溶剂浓度等因素都会直接影响酚类物质提取效果,对植物多酚的充分溶出,以及对多酚有效成分的保护作用产生影响,所以浸提多酚的最佳工艺参数研究成为一个重要的课题。胡婉珊等[15]采用正交试验研究了乙醇浸提磨盘柿多酚的工艺参数,确定的最佳工艺条件是:乙醇体积分数60%,温度55 ℃,提取时间30 min,液固比15 ∶ 1(mL ∶ g)时,此条件下多酚得率为3.07 mg/g(鲜柿);而范济民等[16]研究了葡萄皮多酚的乙醇浸提最佳条件为:浸提温度80 ℃,乙醇体积分数50%,浸提时间30 min,液料比9 ∶ 1(mL ∶ g),连续浸提2次,葡萄皮多酚浸提量达13.07 mg/g DW。可见,不同来源的多酚采用乙醇浸提的工艺存在差别,提取率也有差异,这可能与原料固有的多酚含量、原料本身细胞壁的厚度及通透性、所含多酚的种类及性质等影响因素密切相关。本试验结果表明:乙醇为枇杷果皮多酚适宜的浸提溶剂,在浸提温度80 ℃,乙醇体积分数50%,液料比为10.0 ∶ 1(mL ∶ g),浸提时间90 min,连续浸提2次,多酚得率可达34.76 mg/g DW。
3.2 枇杷果皮多酚的纯化工艺
大孔吸附树脂是一类有机高分子聚合物吸附剂,不同树脂网状孔径大小不同,对通过微孔的化合物根据其分子量的不同和吸附力的不同而进行筛选,再经一定溶剂洗脱而达到分离的目的。不同来源的多酚分离纯化采用的树脂不尽相同,目前AB-8、NKA-9、D101、DM301等大孔吸附树脂常用于多酚类物质的分离纯化中。郭雄飞等[17]采用超声波结合乙醇浸提提取到葡萄籽多酚,利用D101树脂进一步纯化,多酚总得率达80%以上;吕群金等[18]运用AB-8型树脂分离杨桃渣多酚物质,纯化样品多酚含量达58.82%;郭丽萍等[19]的研究结果表明:DM301树脂对香蕉皮多酚具有良好的吸附和解吸性能,适合用于对香蕉皮多酚的分离纯化;而NKA-9型大孔树脂对沙枣多酚表现出较好的吸附与解吸性能[20],饱和吸附量为19.58 mg/g,解吸率最高值达87.07%,NKA-9 树脂也是苹果多酚的较佳吸附树脂[21],以60%乙醇浓度为洗脱剂,多酚回收率可达85.39%。而本试验选取6种不同极性的聚苯乙烯型树脂,从中筛选出了XAD-5树脂,其对枇杷多酚的吸附率和解吸率分别达到76.44%和74.32%,具有较好的吸附与解吸附性能,是分离纯化枇杷多酚的理想树脂。结果表明,XAD-5树脂纯化枇杷多酚的工艺条件为:进样浓度1.50 mg/mL,样液体积5 BV,进样流速1.5 BV/h;洗脱剂乙醇体积分数为70%,洗脱流速1.5 BV/h,洗脱体积1.2 BV,此工艺下枇杷果皮多酚纯度可达76.52%,回收率为56.44%。
参考文献
[1] Haslam E. Plant polyphenols-vegetable tannins revisited[M]. England: Cambridge University Press, 1989: 170-170.
[2] 曲恩超, 魏福祥. 苹果多酚的研究进展[J]. 河北化工, 2006 (1): 5-8.
[3] Ismail A, Marjan Z M, Foong C W. Total antioxidant activity and phenolic content in selected vegetables[J]. Food Chemistry, 2004, 87(4): 581-586.
[4] 刘 荣, 何 娇, 王振宇. 大孔树脂对樟子松树皮多酚的纯化工艺的研究[J]. 食品工业科技, 2013, 34(11): 201-205.
[5] Nawaz H, Shi J, Mittal G S, et al. Extraction of polyphenols from grape seeds and concentration by ultrafiltration[J]. Separation and Purification Technology, 2006, 48: 176-181.
[6] 黄阿根, 董瑞建, 谢凯舟. 茶树花多酚大孔树脂纯化工艺研究[J]. 农业工程学报, 2007, 23(9): 239-245.
[7] Xue Z P, Feng W H, Cao J K, et al. Antioxidant activity and total phenolic contents in peel and pulp of chinese jujube(Ziziphus jujuba Mill)fruits[J]. Journal of Food Biochemistry, 2009, 33(5): 613-629.
[8] Seyda K, Esam T, Kevser S B, et al. Comparison of total antioxidant capacity and phenolic composition of some apple juices with combined HPLC-CUPRAC assay[J]. Food Chemistry, 2010, 120(4): 1 201-1 209.
[9] Jung H A, Park J C, Chung H Y, et al. Antioxidant flavonoids and chlorogenic acid from the leaves of Eriobotrya japonica[J]. Archives of Pharmacal Research, 1999, 22(2): 213-218.
[10] Ito H, Kobayashi E, Takamatsu Y, et al. Polyphenols from Eriobotrya japonica and their cytotoxicity against human oral tumor cell lines[J]. Chemical and Pharmaceutical Bulletin, 2000, 48(5): 687-693.
[11] 石 碧, 狄 莹. 植物多酚[M]. 北京: 科学出版社, 2000: 19-21.
[12] 王思新, 刘杰超, 焦中高, 等. 树脂法吸附分离苹果汁中多酚物质的研究[J]. 果树学报, 2005, 22(1): 11-15.
[13] 艾志录, 王育红, 王 海, 等. 大孔树脂对苹果渣中多酚物质的吸附研究[J]. 农业工程学报, 2007, 23(8): 245-248.
[14] 包 辰, 郑宝东. 有机溶剂法提取茶树菇多酚工艺的研究[J]. 热带作物学报, 2012, 33(11): 2 070-2 074.
[15] 胡婉珊, 郭琳博, 李宇华, 等. 磨盘柿中多酚类物质的提取及大孔树脂纯化工艺研究[J]. 中国食品学报, 2011, 11(1): 112-118.
[16] 范济民, 赵志换, 穆瑞娜. 葡萄皮中多酚的提取及其抗氧化活性研究[J]. 化学与生物工程, 2010, 27(10): 59-61.
[17] 郭雄飞, 倪 慧, 卿德刚, 等. 葡萄籽中多酚类物质的提取和纯化工艺[J]. 西北农业学报, 2009, 18(4): 351-354.
[18] 吕群金, 衣杰荣, 丁 勇. 大孔吸附树脂对杨桃渣多酚吸附分离的优化[J]. 食品科学, 2010, 31(6): 39-42.
[19] 郭丽萍, 卢家炯, 韦 霁. 大孔吸附树脂对香蕉皮多酚吸附特性的初步研究[J]. 食品与机械, 2006, 22(2): 56-58, 112.
[20] 王 雅, 樊明涛, 赵 萍, 等. 大孔树脂对沙枣多酚的动态吸附解析性能研究[J]. 西北农林科技大学学报(自然科学版), 2010, 38(12): 215-220.
[21] 艾志录, 王育红, 王 海, 等. 大孔树脂对苹果渣中多酚物质的吸附研究[J]. 农业工程学报, 2007, 23(8): 245-248.

