法医DNA常量检材Chelex—100提取法探究
吴俊蓉 李宗壮
【摘要】目的:对Chelex-100提取法在常量检材DNA提取中的应用情况进行研究。方法:选取20份送检的常量检材,包括烟蒂、染血棉签、纱条、FTA卡片等检材,采用Chelex-100提取法对唾液、血痕进行检测,并对检测情况进行整理分析。结果:1组DAN浓度为2.31±0.2ng/μl;2组DNA浓度为2.28±0.4ng/μl;3组DNA浓度为2.49±0.3ng/μl,不同浓度的Chelex-100检测的DNA浓度比较无明显差异,且均能够达到检验目的。结论:低浓度Chelex-100在常量检材DNA提取中即可取得良好的效果,能够准确的提取DNA。
【关键词】常量检材;Chelex-100提取法;DNA
法医DNA检验技术是一种分子生物学检验方式,其主要是利用DNA的独有性和个体识别性进行亲子鉴定和嫌疑人鉴定。法医DNA检验的主要对象为生物物证,也就是人体中的细胞核基因组,其通常存在于血液、唾沫中。目前,最常用的检测方法为Chelex-100提取法,主要是由于此种检测方式成本较低、操作方便、时间较短。笔者将对Chelex-100提取法在常量检材DNA提取中的作用进行研究。
1.资料与方法
1.1一般资料
选取20份送检的常量检材,包括烟蒂、染血棉签、纱条、FTA卡片等检材,其中烟蒂5份、棉签5份、纱条5份、FTA卡片5份。根据Chelex-100的浓度将所有检材分为三组,浓度5%为1组;10%为2组;15%为3组。1组将5gchelex-100溶液加纯水溶解至100ul;2组将10g chelex-100加纯水溶解至100ul;2组将15g chelex-100溶液加纯水溶解至100ul。
1.2检测方法
1.2.1血液DNA检测:将适量检材放置于离心管内震荡30s,放置于温室中浸泡,而后在13,000rpm条件下进行离心震荡,留取20μl基底液,而后加入Chelex-100和PK5-20μl,在56摄氏度下放置30-90min;在100摄氏度下放置5-20分钟,最后在10,000rpm条件下离心震荡2min,取上层清液备用。
1.2.2唾液DNA检测:将唾液斑检材将之与离心管中,加入0.5ml纯水,混匀,温室中浸泡30min,在13,000rpm条件下离心震荡3min,去除上清液;而后加入Chelex-100和PK5-20μl,在56摄氏度下放置30-90min;在98摄氏度下放置15分钟,震荡混匀,最后在13,000rpm条件下离心震荡2min,在4摄氏度下保存。而后将所有样本进行DNA扩增、电泳处理。
1.3效果比较
对三组检测的DNA浓度进行比较。
1.4数据统计
数据采用spss17.0软件处理,计量资料采用±S表示,资料采用t值检验,P<0.05认为差异具有统计学意义。
2.结果
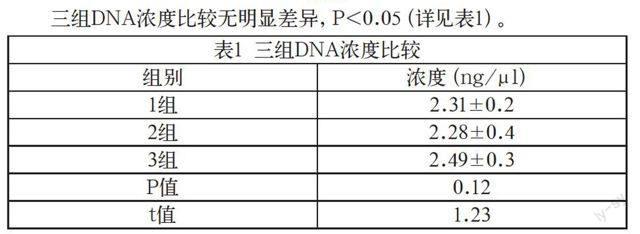
三组DNA浓度比较无明显差异,P<0.05(详见表1)。
表1 三组DNA浓度比较
组别 浓度(ng/μl)
1组 2.31±0.2
2组 2.28±0.4
3组 2.49±0.3
P值 0.12
t值 1.23
3.讨论
近年来由于医学科技不断的发展,DNA检测技术逐渐普及,同时DNA检测方式也越来越多,目前主要有Chelex-100提取法、有机法、二氧化硅法、碱裂解法和盐析法。Chelex-100是一种树脂,对多价金属离子具有非常高的亲和力,其在低离子强度、碱性温浴的作用下能够裂解细胞膜,改变与DNA结合蛋白的性质[1]。通常来说,常量检材基质中含有大量的金属离子,在低离子强度和加热条件下能够降解DNA,同时能够抑制PCR反应,因此在提取DNA时加入Chelex-100能够阻止DNA降解,同时提升PCR扩增率[2]。但此种方式在临床中也存在一定的不足,Chelex-100提取法检测很容易受到基质中杂质的干扰,导致部分DNA丢失。但其在实践中操作非常方便,且时间非常短,在提取的过程中无需更换试管,大大降低了污染发生率[3]。此外,在研究中也可以看出,低浓度的Chelex-100与高浓度Chelex-100提取的DNA浓度并无明显差异,因此可以认为低浓度Chelex-100能够有效的提取常量检材DNA,降低了不必要的浪费和污染。
有机提取法主要是采用饱和酚、氯仿等物质按照不同比例进行混合,而后提取DNA的方式。DNA非常容易溶于水中,但不溶于有機溶剂中[4]。此种提取方式提取的DNA纯度非常高,不会受到杂质干扰,但此种方式由于在提炼过程中需要利用大量有机试剂进行辅助,有机试剂多存在较大的毒性,会对人体造成影响,且容易造成环境污染。此外,有机提取方式操作复杂、提取时间较长,已经很少被采用。
二氧化硅法在提取DNA的过程中同样存在操作复杂的特点,且此种检测方式的改良方式主要应用于微量检材的检测中,很少应用于常量检材的检验中[5]。碱裂解法在提取DNA时必须要及时进行DNA扩增处理,但对于法医检验来说,通常要将DNA模板保存一段时间,以进行重复检验和鉴定,因此碱裂解法在实践中不具备较强的可行性。盐析法的操作成本较低,非常适合进行大批量样本检测,且此种方式的提取的DNA纯度非常高,可以视为结果无蛋白质干扰。但此种方式在使用中也存在较大的限制,盐析法不仅需要大量的检材,同时无法对低于3cm×3cm的检材进行检测,此外,盐析法虽然提取的DNA纯度较高,但其DNA提取率非常低,因此利用率也非常低。
总的来说,Chelex-100常量检材DNA提取方式具有较高的可行性,是一种有效的DNA提取手段。
参考文献
[1]杨电.接触DNA检材提取纯化方法的比较及法医学应用[D].南方医科大学,2010.
[2]成振.Chelex-100 DNA模板用于H19印记基因座遗传多态性的检测及其在山西汉族人群中分布研究[D].山西医科大学,2012.
[3]Katie L, William, RMark D,et a1.Developmental validationof a multiplex qPCR assay for assessing the quantity and quality ofnuelegr DNA in forensic samples [J].Forensic Sci Int, 2007,170,35—45.
[4]姜伯玮,赵兴等.Qubit快速荧光定量系统在法医学中的应用[J].证据科学,2009,17(1),123-128.
[5]袁丽,鲁涤,刘耀.低拷贝DNA模板检验方法研讨[J].中国法医学杂志,2010,24(06),383-385.
——卡文迪什测定万有引力常量