SCoT分子标记技术在木薯遗传多样性分析中的应用
周慧文 单建伟 冯斗 严华兵
摘 要 应用SCoT标记对不同来源的28份木薯种质资源进行遗传多样性和亲缘关系分析。结果表明:从36条引物中筛选出19条重复性好、条带清晰的引物对28份木薯材料进行PCR扩增。共扩增出171条带,其中多态性条带123条,平均每条引物扩增多态性条带6.5条,多态性条带比率为71.9%。经NTSYS-pc2.10e软件计算分析,28份木薯种质间遗传相似系数在0.631~0.930之间。利用UPGMA法进行聚类的结果显示:在系数0.68处,木薯材料分为2大类,品种BRA354单独成为一类;在系数为0.734处,28份木薯种质资源主要聚为5大类,聚类结果与材料来源有一定相关性。SCoT标记能在木薯种质间检测出一定程度的遗传多样性,可为木薯遗传育种提供新的技术支持。
关键词 木薯;SCoT;分子标记;遗传多样性
中图分类号 S533 文献标识码 A
Application of SCoT Molecular Marker in the
Genetic Diversity Analysis of Cassava
ZHOU Huiwen1,2, SHAN Jianwei1, FENG Dou1, YAN Huabing2 *
1 Guangxi University, Nanning, Guangxi 530004, China
2 Cash Crops Research Institute, Guangxi Academy of Agricultural Sciences, Nanning, Guangxi 530007, China
Abstract In this paper,SCoT molecular marker technique,which can be used to detect markers associated with functional genes,was applied in the analysis of genetic diversity and relationships among 28 cassava accessions from different geographic locations. The results showed that,a total of 171 loci were detected with 19 primers screened from 36 SCoT primers in the tested accessions. In the 171 bands,123 were polymorphic with the polymorphism of 71.9%; and the average polymorphic number was 6.5 per primer. The genetic similarity coefficient among the accessions were calculated with NTSYS-pc2.10e software, and the value was between 0.631 and 0.930. The results of UPGMA clustering analysis showed that,28 cassava germplasms could be divided into two groups where the coefficient was 0.68; The accession BAR354 alone was clustered into one group,and the rest accessions were clustered into another group. The accessions could be divided into five groups where the coefficient was 0.734. This paper revealed that SCoT molecular marking technique could be used to detect some DNA polymorphism in cassava germplasms,which could provide a technical support for cassava breeding.
Key words Cassava; SCoT; Molecular marker; Genetic diversity
doi 10.3969/j.issn.1000-2561.2015.08.013
木薯(Manihot esculenta Crantz)是大戟科木薯属植物,耐旱抗贫瘠,广泛种植于非洲、美洲和亚洲等100多个国家或地区[1]。木薯是三大薯类作物之一,热带地区第三大粮食作物,全球第六大粮食作物,被誉为“淀粉之王”,是世界近六亿人赖以生存的粮食。木薯用途广泛,可食用、饲用和加工成各种工业产品,如淀粉、酒精等[2]。
作物种质资源评价是作物遗传改良的重要基础,只有充分了解种质资源,才能为育种工作提供科学依据。木薯是一种遗传背景复杂、基因型高度杂合,有性子代严重分离的作物,这为木薯品种选育提供了众多选择机会。然而由于木薯种质系谱不清,在杂交亲本选配时存在很大的盲目性,育种效率低,造成大量人力、物力和财力的浪费。结合植物学性状调查与分析,利用分子标记技术可为木薯杂交育种亲本的选择提供理论指导。随着近年来分子标记技术的发展,SSR、RFLP、RAPD等分子标记技术都曾相继被应用于木薯的遗传多样性分析中。早在1993年,Beeching等[3]就利用RFLP对木薯种质资源进行遗传多样性分析。在国内,李开绵、王文泉等专家团队在木薯分子标记技术应用方面做了大量工作,邹积鑫等[4]利用微卫星标记(SSR)对中国89个木薯品种进行遗传多样性分析;韦祖生等[5]利用EST-SSR标记对木薯种质库进行遗传多样性检测;齐兰等[6]也曾利用SRAP标记对木薯品种进行分类鉴定。
目标起始密码子多态性分子标记(start condon targeted polymorphism,SCoT)是Collard和Mackill[7]在水稻上提出的基于SPAR(单引物扩增反应)的新的目的基因分子标记方法,其原理是根据植物基因中的ATG翻译起始位点侧翼序列的保守性,设计单引物并对基因组进行扩增。SCoT标记结合了ISSR标记和RAPD标记的优点,操作简单,成本低廉,多态性丰富,能有效地产生与性状联系的标记,是一种能跟踪性状的新的分子标记,有利于分子标记辅助育种[8-9]。已有前人将该技术成功应用于龙眼[10]、柑橘[11]、花生[12]、菊花[13]、兰花[14]、牡丹[15]和菠萝[16]等作物的遗传多样性分析中。虽然国内外陆续有人对木薯做了分子标记研究,但尚未见SCoT分子标记应用于木薯种质遗传多样性分析中的相关研究报道。
本文利用SCoT技术分析28份木薯种质资源的遗传多样性,以期通过该实验,弥补该技术在木薯中应用的空白,并为木薯的亲缘关系研究、资源鉴定及分子标记辅助育种等提供新的可操作利用的分子标记技术方法。
1 材料与方法
1.1 试验地点与材料
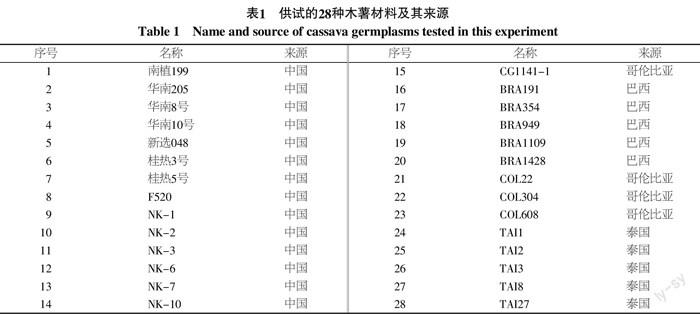
本实验在广西大学亚热带农业生物资源保护与利用国家重点实验室进行。供试28份木薯种质由广西农业科学院经济作物研究所提供(表1)。36条SCoT 引物序列参照Collard和Mackill(2009)文中所列[7],由上海生工生物工程有限公司合成。DL 15 000 Marker、dNTPs、Taq DNA聚合酶等试剂均购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 DNA提取 2014年6月,在广西农科院建木薯育种基地,从编号材料采集自顶端起第三片展开叶,装袋编号后放置冰盒,带回实验室冰箱保存待提取DNA。DNA的提取参考改良CTAB提取法[17]。将提取好的DNA稀释成50 ng/μL,放于-20 ℃摄氏度冰箱保存。
1.2.2 SCoT-PCR扩增与检测方法 PCR反应在Bio-rad T100 Thermal Cycler PCR仪上进行。采用20 μL PCR扩增体系,其中包含10×PCR buffer(Mg2+)2.0 μL、引物0.6 μL(10 μmol/L)、dNTPs 2 μL(2.5 mmol/L)、Taq DNA聚合酶1.5 U、DNA 2 μL(30 ng/L),其余用灭菌的ddH2O补充。PCR程序设定为:94 ℃预变性4 min;94 ℃变性30 s,50 ℃退火1 min,72 ℃延伸1.5 min,共35个循环;72 ℃最后延伸5 min。扩增反应结束后,取6 μL扩增产物,经0.8%琼脂糖凝胶中电泳、GoldView核酸染色剂染色后在紫外凝胶成像系统上拍照保存。使用的电泳仪为Bio-rad厂家生产的PowerPac universal,电泳槽为北京六一厂的DYCP-34A,设定电压为120 V,运行时间为80 min。
1.2.3 数据分析方法 SCoT产物按同一迁移水平下的条带有无分别赋值,有带记为1,无带记为0,建立SCoT标记的0、1矩阵。将矩阵输入NTSYS-pc2.10e软件中,计算遗传相似系数,并用不加权成对算术平均法(UPGMA)进行聚类分析。
2 结果与分析
2.1 SCoT扩增结果分析
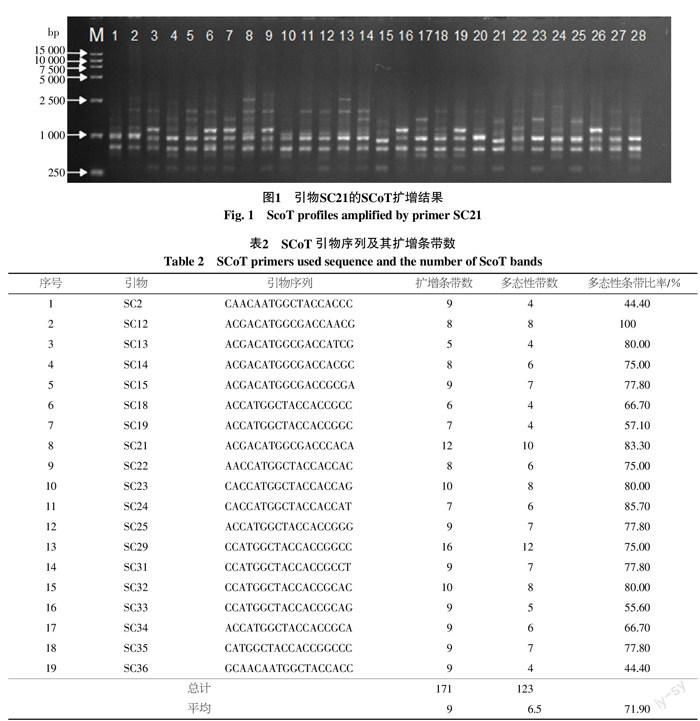
从36条SCoT引物中筛选出19条扩增条带清晰、多态性丰富的引物进行扩增。扩增产物多介于250~2 500 bp之间(图1)。19条引物共扩增出171条带,每条引物扩增条带数在5~16条之间,平均每条引物能扩增出9条带。每条引物扩增出的多态性条带数介于4~12条之间,平均每条引物扩增多态性条带为6.5条,总体多态性条带比率达71.9%。扩增结果表明利用SCoT 标记进行扩增可检测到较多的遗传位点,扩增条带清晰分明,重复性好,表现出了丰富的多态性(表2)。
2.2 相似性分析
用NTSYS-pc2.10e软件计算19条SCoT引物扩增结果在28份木薯种质之间的相似系数,得到相似性矩阵。华南205与南植199的相似系数最大,为 0.930;其次为NK-1与华南8号的遗传相似系数,为0.924;新选048与华南10号的相似系数为0.860;相同来源的几个材料相似系数较高,如NK-6与NK-7、NK-6与NK-3、NK-7与NK-3的相似系数分别为0.819、0.826、0.877,TAI27与TAI2、TAI8与TAI1的相似系数均为0.813;其余相似系数较高的种质有TAI2与COL608的相似系数为0.836;TAI27与桂热5号的相似系数为0.836;NK-6与新选048的相似系数为0.825;NK-10与新选048的相似系数为0.860。遗传相似系数最低的是BRA354与CG1141-1,仅为0.631;COL22与BRA949的遗传相似系数为0.637;TAI27与 BRA354的遗传相似系数为0.655。
2.3 聚类分析
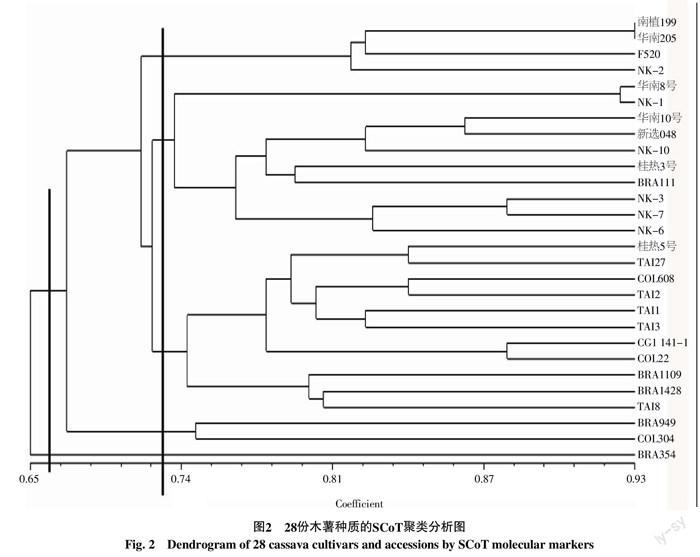
用NTSYS-pc2.10e软件对19条引物标记的171个遗传位点进行聚类分析,构建28个木薯品种的聚类树状图(图2)。从图2中可知,在相似系数0.68处,可将28份木薯种质分为两大类。第一类只包含一个材料,即BRA354,其余南植199等27份种质归为一类。在相似系数0.734的水平,可将第二大类的27份种质分为4个亚组。第I亚组包括南植199、华南205、F520及NK-2 4份种质。第II亚组含华南8号、NK-1、华南10号、新选048、NK-10、桂热3号、BRA191、NK-3、NLK-7及NK-6 共10份种质。第III亚组包括桂热5号、TAI27、COL608、TAI2、TAI1、TAI3、CG1141-1、COL22、BRA1109、BRA1148及TAI8 共11份种质。第IV亚组包括BRA949和COL304 共2份种质。
3 讨论与结论
随着分子标记技术的发展,植物种质资源遗传多样性的评价已不再局限于形态学、细胞学以及生化标记,RAPD、SSR、ISSR、AFLP、SRAP 及新近开发的 SCoT 分子标记技术已广泛应用于植物遗传多样性的分析及评价[18]。RFLP、RAPD、SSR、ISSR及AFLP 4种标记都是传统意义上的随机分子标记,而 SRAP、SCoT标记为目的基因分子标记,得到的位点可能是目的基因的一部分或与目的基因紧密联锁,更利于分子标记辅助育种[19]。本实验运用SCoT技术分析了28份不同来源的木薯种质资源的遗传多样性,获得了良好的实验结果。在实验中所参照的36条引物也被前人应用于柑橘、菊花、牡丹等植物的SCoT扩增,可见SCoT引物通用性强,可在不同物种中使用。本研究中筛选出的19条引物在28份木薯种质中检测出了丰富的遗传多样性,平均多态比率达71.9%,低于曾霞等[20]利用RAPD技术研究木薯遗传背景的所得的实验结果(多态性比率为83.9%),仅次于齐兰等[6]利用SKAP标记对木薯进行分类鉴定的实验结果(多态性比率为73.4%),与夏秀忠[21]使用AFLP进行木薯遗传多态性研究的实验结果相当(多态性比率为71.7%)。可见,SCoT能检测出一定程度的多态性,可满足对木薯进行遗传多样性检测的需要。因此,可利用SCoT技术进行木薯遗传多样性检测及分子标记辅助育种。
从聚类结果可以看出,分组具有一定的地域性,来源于同一国家或同一地区的种质组成一组,但同一组中也包含不同国家地区的材料,如第III亚组含来自中国、泰国、哥伦比亚及巴西的材料。从品种来源看,在中国审定的桂热5号品种即是从泰国大田作物研究中心引入的木薯品系编号Huay-Bong-60(R5×KU50的杂交后代),而泰国的很多品种也是从哥伦比亚国际热带农业研究中心(CIAT)直接引进或从引起材料后代选育而来。因此,由于木薯种质资源引种交流频繁,不同来源的资源间也存在交叉聚类的现象。来自同一地理位置材料的遗传相似系数较高,而来自不同地理位置材料的遗传相似系数普遍偏低,说明木薯的遗传变化与地理区域的远近呈现一定的相关性。在本实验的聚类结果中,BRA354单独聚到了一类。经查明,该木薯材料通用名是Mandiocaba,疑似为甜木薯品种,与其它栽培种可能存在较大的遗传差异。在前人的研究中,华南205与南植199两份材料并未聚在一起。而在本实验中,它们表现出高度相似的遗传背景,可能原因在于,由于SCoT标记是与性状紧密联系的标记,2份材料在某些性状上存在较高的相似性而聚在一起。另外,中国的木薯种质间遗传相似系数较高,大部分达0.750以上,这与曾霞等[20]利用RAPD标记技术对中国44份木薯主要种质遗传多样性进行分析的研究结果一致,说明中国木薯品种遗传背景较为狭窄,遗传多样性还不够丰富,还需进一步增大引种力度,从其他地区引进种质资源,以丰富木薯种质资源多样性,提高遗传改良潜力,为中国培育优良品种木薯奠定良好基础。
参考文献
[1] El-Sharkawy M A. Cassava biology and physiology[J]. Plant Molecular Biology, 2004, (56): 481-501
[2] Balagopalan C. Cassava utilization in food, feed and industry[A]. In: Hillocks R J, Thresh J M, Bellotti A C(eds). Cassava: biology, production and utilization[C]. CAB International, 2002: 301-318.
[3] Beeching J R, Marmey P, Gavdda M C, et al. An assess ment of genetic diversity with a collec-tion of cassava(mani hot esudenta Crantz)germplasm using molecular markers[J]. Annals of Botany, 1993, 72: 515-520.
[4] 邹积鑫, 李开绵, 王文泉. 微卫星分子标记在木薯种质资源遗传分析中的应用[J]. 华南热带农业大学学报, 2005, 11(2): 1-5.
[5] 韦祖生, 夏志强, 李开绵. 木薯种质库遗传多样性的EST- SSR标记[J]. 热带作物学报, 2008, 29(3): 304-309.
[6] 齐 兰, 王文泉, 张振文, 等. 利用SRAP标记构建18个木薯品种的DNA指纹图谱[J]. 作物学报, 2010, 36(10): 1 642-1 648.
[7] Collard B C Y, Mackill D J. Start codon targeted(SCoT)polymorphism: a simple, novel DNA marker technique for generating gene-targeted markers in plants[J]. Plant Molecular Biology Reporter, 2009, 27(1): 86-93.
[8] 陆才瑞, 喻树迅, 于霁雯, 等. 功能型分子标记(ISAP)的开发及评价[J]. 遗传, 2008, 30: 1 207-1 216.
[9] Andersen J R, Lubberstedt T. Functional markers in plant[J]. Trends Plant Sci, 2003, 8: 554-560.
[10] 陈 虎, 何新华, 罗 聪, 等. 龙眼24个品种的SCoT遗传多样性分析[J]. 园艺学报, 2010, 37(10): 1 651-1 654.
[11] 韩国辉, 向素琼, 汪卫星, 等. 柑橘SCoT分子标记技术体系的建立及其在遗传分析中的应用[J]. 园艺学报, 2011, 38(7): 1 243-1 250.
[12] 熊发前, 蒋 菁, 钟瑞春, 等. 目标起始密码子多态性(SCoT)分子标记技术在花生属中的应用[J]. 作物学报, 2010, 36(12): 2 055-2 061.
[13] 李丕睿, 蒋甲福, 陈素梅, 等. 菊属植物SCoT分子标记技术在遗传多样性分析中的应用[J]. 园艺学报, 2013, 40(10): 2 015-2 025.
[14] 高 岭, 冯尚国, 何仁锋, 等. 兰属植物目标起始密码子(SCoT)遗传多样性分析[J]. 园艺学报, 2013, 40(10): 2 026-2 032.
[15] 侯小改, 王 娟, 贾 甜, 等. 牡丹SCoT分子标记正交优化及引物筛选[J]. 华北农学报, 2011, 26(5): 92-96.
[16] 陈香玲, 苏伟强, 刘业强, 等. 36份菠萝种质的遗传多样性SCoT分析[J]. 西南农业学报, 2012, 25(2): 625-62.
[17] 闫庆祥, 黄东益, 李开绵, 等. 利用改良CTAB法提取木薯基因组DNA[J]. 中国农学通报, 2010, 26(4): 30-32.
[18] 贾巧君, 朱靖环, 汪军妹, 等. 浙江赤霉病抗性不同的大麦地方品种遗传多样性分析[J]. 植物遗传资源学报, 2013, 14(3): 472-478.
[19] 蒋晓梅, 黄琳凯, 张新全, 等. 利用SCoT分析柳枝稷遗传资源的多样性[J]. 植物遗传资源学报, 2014, 15(1): 89-95.
[20] 曾 霞, 庄南生, 李开绵. 应用RAPD技术对44份木薯材料遗传背景的研究[J]. 热带作物学报, 2003, 24(2): 59-64.
[21] 夏秀忠. 木薯品种的AFLP和SSR遗传多态性研究[D]. 南宁: 广西大学, 2005.

