47份菠萝种质遗传多样性的RAPD分析
王健胜 贺军虎 陈华蕊 陈业渊
摘 要 利用RAPD分子标记对来自9个不同国家或区域47份菠萝种质的遗传多样性进行分析,结果表明,RAPD标记在菠萝种质中具有较好的多态性,引物多态性条带百分比平均达到82.26%,引物的有效等位基因数(Ne)、Neis基因多样性指数(H)、Shannons信息指数(I)和多态性信息含量(PIC)表现都较好,其平均值分别为1.46、0.26、0.39和0.24。基于RAPD分子检测数据对菠萝种质进行聚类分析,在GS=0.66水平上,47份菠萝种质被划分为4大类群。菠萝种质的主成分分析获得了与聚类分析基本一致的结论。
关键词 菠萝;遗传多样性;RAPD标记
中图分类号 S668.3 文献标识码 A
Genetic Diversity Analysis of Forty Seven Pineapple
[Ananas comosus(L.)Merr]Germplasm
with RAPD Marker
WANG Jiansheng2, HE Junhu1 *, CHEN Huarui1, CHEN Yeyuan1
1 Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Science, Danzhou, Hainan 571737, China
2 Pingdingshan University, Pingdingshan, Henan 467000, China
Abstract The genetic diversity of forty seven pineapple germplasm originated from nine countries/regions was analyzed using RAPD molecular markers. Results showed that RAPD had better polymorphsim in pineapple and the mean value for the percentage of polymorphism bands was 82.26%. RAPD primers had better performance on other genetic parameters as well, the mean value for effective number of allele, Neis gene diversity, Shannons information index and polymorphism information content was 1.46, 0.26, 0.39 and 0.24, respectively. Based on the genetic similarity coefficient between pineapple germplasm generated from RAPD markers, all the germplasms were clustered into four groups at the genetic similarity of 0.66. The similar results were also obtained by principal component analysis. All these results would provide an important scientific basis for breeding, preservation and effective utilization of pineapple in China.
Key words Pineapple; Genetic diversity; RAPD marker
doi 10.3969/j.issn.1000-2561.2015.08.005
菠萝[Ananas comosus(L.)Merr]属凤梨科凤梨属,是一种重要的多年生常绿草本植物,与香蕉、芒果、椰子并称四大热带水果。菠萝在中国也具有较长的种植历史,其主要分布于台湾、海南、广西、云南等热带亚热带地区,据最新统计显示,中国菠萝种植面积在2013年已达到5.8×104 hm2(Faostat 2013),这也使中国成为世界上菠萝的主要生产国之一。虽然如此,与其他菠萝主要种植国相比,我国的菠萝产业发展相对滞后,而加快菠萝育种是提升菠萝产业发展的重要工作。
种质研究是菠萝育种的重要基础。虽然我国不是菠萝的起源国,但经过多年的有效引种,我国已保存了较为丰富的菠萝种质资源,因此,开展菠萝种质研究已显得尤为重要。目前,菠萝种质研究中有关田间表型性状的研究较多[1-5],利用分子标记进行菠萝种质研究的报道较少。刘卫国等[6]利用8对AFLP引物对39份菠萝种质作了研究,结果表明,菠萝种质间的遗传关系较近,其遗传相似系数为0.73~0.98,基于遗传相似系数,39份菠萝种质被分为4类。窦美安等[7]利用SRAP标记研究了61份菠萝种质的遗传多样性,发现供试菠萝品种的多态性比率都较低,其分布在47.32%~68.90%之间,菠萝种质之间遗传差异也较小,其遗传相似系数都在0.80以上,61份菠萝种质最终被划分为5种类型。童和林等[8]利用菠萝EST-SSR标记构建了31份菠萝种质DNA指纹图谱。陈香玲等[9]、张如莲等[10]分别利用SCoT和ISSR对菠萝种质进行了分子鉴定及亲缘关系分析。国外学者在相关方面也作了较好的研究[11-12]。
RAPD标记是一种较早开发的分子标记技术,由于其具有易扩增、多态性高、操作简便、无种属限制等优点而被广泛应用于不同类型植物遗传多样性研究中,另外,由于菠萝其他类型分子标记开发数量仍较少,因此,本研究采用RAPD分子标记技术对来自不同国家的47份菠萝栽培种质进行了遗传多样性分析,在初步掌握不同菠萝种质间亲缘关系的同时,发现具有优良变异的菠萝种质,为我国菠萝种质的科学鉴定、保护和高效利用提供一定的基础。
1 材料与方法
本实验于2013年在中国热带农业科学院热带作物品种资源研究所农业部热带作物资源遗传改良与创新重点实验室完成。
1.1 材料
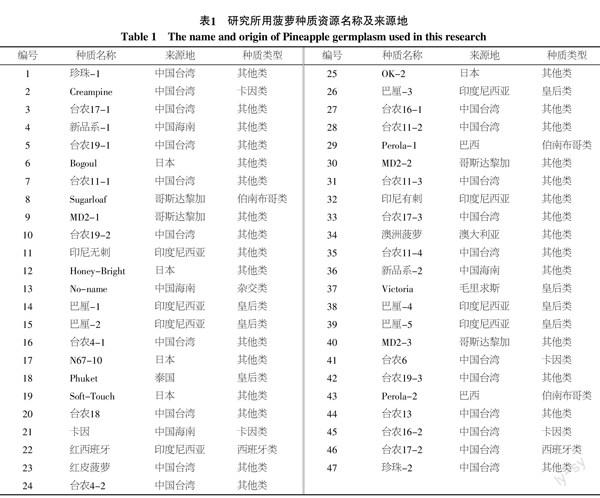
试验所利用的47份菠萝种质材料来源于9个不同国家或区域(表1),主要包括中国台湾、中国海南、巴西、日本、印度尼西亚、澳大利亚、泰国、哥斯达黎加、毛里求斯。试验材料由中国热带农业科学院热带作物品种资源研究所提供。
1.2 方法
1.2.1 DNA提取 每份材料随机选取10~15个单株幼嫩叶片等量混合,采用改良的SDS法[13]混合提取基因组总DNA,经紫外分光光度计测定浓度后,稀释至适合工作浓度,备用。
1.2.2 RAPD标记[12]检测 PCR扩增反应在Eppendorf PCR扩增仪上完成。PCR反应总体积为20 μL,包括1.5 μL基因组DNA 40 ng,1.5 μL引物(20 mmol/L),2.0 μL 10×PCR缓冲液(含Mg2+),2.0 μL底物dNTPs(2.5 mmol/L),1.0 μL Taq酶(2 U/μL)和12 μL ddH2O。
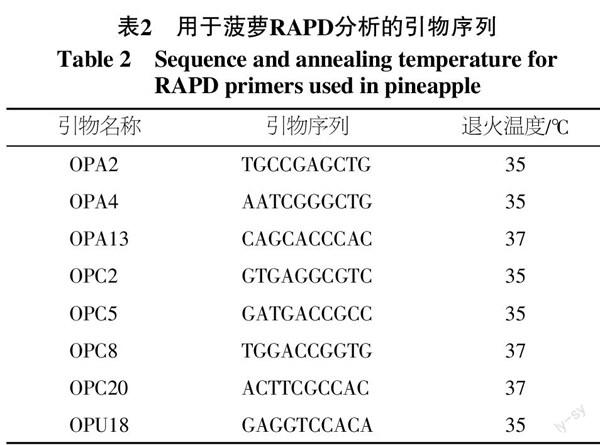
RAPD-PCR扩增程序为:3个循环(94 ℃ 1 min,37 ℃ 1 min,72 ℃ 2 min),37个循环(94 ℃ 30 s,37 ℃ 40 s,72 ℃ 2 min),最后72 ℃ 5 min。扩增产物用浓度为1.8%的琼脂糖凝胶进行电泳检测,并在紫外凝胶成像系统上保存分析,同时为了保证实验的准确性,每个RAPD反应都需要重复3次以上。用于菠萝RAPD分析的引物序列见表2。
1.3 数据统计及分析
以0、1、9统计RAPD扩增带型,在相同迁移率位置上,有带记为“1”,无带记为“0”,缺失记为“9”,并建立分子数据矩阵。利用NTSYS-pc2.10[14]软件通过非加权平均法(UPMGA)计算菠萝种质间的遗传相似系数,并在此基础上作聚类分析及主成分分析。采用POPGEN32软件估算RAPD标记的主要遗传多样性参数,包括引物扩增总条带数(TNB)、多态性条带数(NPB)、多态性条带百分比(PPB)、有效等位基因数(Ne)、Neis基因多样性指数(H)、Shannons信息指数(I)和多态性信息含量(PIC)。
2 结果与分析
2.1 菠萝种质RAPD多态性分析
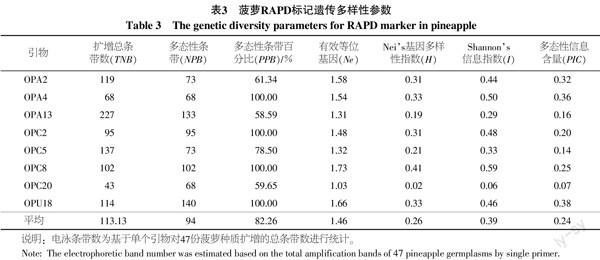
从表3可以看出,不同RAPD引物在菠萝基因组扩增中存在较大差异。单个引物扩增总条带分布在43~227之间,平均为113.13,扩增多态性条带分布范围为68~140,平均为94,多态性条带百分比分布在58.59%~100.00%之间,平均为82.26%,可见,RAPD引物在菠萝基因组扩增中多态性表现较好。在其他参数方面,不同引物间的差异也比较明显。有效等位基因数(Ne)分布范围为1.03~1.66、Neis基因多样性指数(H)变异范围为0.02~0.41,Shannons信息指数(I)变化主要在0.06~0.59之间,其平均值分别为1.46、0.26和0.39。多态性信息含量(PIC)是评价引物的一个重要参数,从表3可以看出,RAPD引物的多态性信息含量差异较大,其变异范围为0.07~0.38,平均为0.24。从引物所有参数的综合分析来看,OPA4和OPU18表现相对最好,其在菠萝遗传多样性检测分析中效率最高。
2.2 不同菠萝种质亲缘关系分析
基于RAPD分子检测数据获得了菠萝种质间的Neis遗传相似系数,菠萝种质间遗传相似系数的差异较大,其变化范围为0.156~0.969,平均为0.716。在所有菠萝种质中,来自哥斯达黎加的MD2-2分别与来自中国台湾的Creampine、来自日本的Bogoul间的遗传相似系数最小,只有0.156,这说明MD2-2与Creampine、Bogoul的亲缘关系最远。另一方面,台农16-1与巴厘-1、巴厘-2与台农18间的遗传相似系数最大,达到了0.969,这表明其亲缘关系最近。从菠萝种质间的遗传相似系数平均表现来看,我国菠萝种质的遗传差异水平相对较高。
2.3 不同菠萝种质聚类分析
利用Neis遗传相似系数对47份菠萝种质进行了聚类分析,结果如图1所示。由图1可知,在遗传系数0.66处,47份菠萝种质可被划分为4个类群,即类群Ⅰ、类群Ⅱ、类群Ⅲ和类群Ⅳ,其中第Ⅰ类群最大,共包括42份菠萝种质,占研究菠萝种质总数的89.36%。由于第Ⅰ类群包含的菠萝种质数量庞大,因此其又可被划分为3个亚群,分别为Ⅰ-1亚群、Ⅰ-2亚群和Ⅰ-3亚群,其中第Ⅰ-1亚群包括的菠萝种质最多,达到了38个,而第Ⅰ-2亚群和Ⅰ-3亚群分别有1个和3个种质。第Ⅱ类群共包括了2个菠萝种质,即来自日本的OK-2和来自巴西的Perola-2,第Ⅲ类群也由两个菠萝种质组成,其分别是来自印度尼西亚的红西班牙和来自中国台湾的珍珠-2,与其他类群不同,第Ⅳ类群是由1个菠萝种质构成的,即来自哥斯达黎加的MD2-2,这表明该种质与其余菠萝种质的亲缘关系相对最远,可以看出,该聚类结果与上述亲缘关系分析结果基本一致。
2.4 菠萝种质主成分分析
基于RAPD标记数据对47份菠萝种质作了主成分分析(图2)。在主成分分析中,前3个主成分能解释的总遗传变异为41.77%。从图2可看出,主成分分析获得了与聚类分析基本一致的结果,聚类分析中被聚为同一类群的菠萝种质在主成分分析中也具有较近的物理距离,而物理位置的大小也直接反映了其亲缘关系的远近,可见,主成分分析在直接反映菠萝种质间亲缘关系的同时,也在一定程度上印证了聚类分析结果的准确性。从图2还可见,编号为30的MD2-2与其余菠萝种质间都具有较远的物理位置,这表明MD2-2与其他菠萝种质间的亲缘关系最远,该结果与前述分析结果也基本一致。
3 讨论与结论
目前,菠萝品种在园艺学上的分类仍主要依据菠萝在果实、叶片、植株性状等方面的差异来进行,根据差异菠萝品种主要被分为5大类,即无刺卡因类、皇后类、西班牙类、伯南布哥类、佩罗莱拉类。从本研究所获得的菠萝种质资源亲缘关系聚类图上可以看出,该结果与现行的经典分类结论既有一致的部分,也存在一定的差异,其主要原因可能是地区及国际间种质频繁交流而导致的同名异物、同物异名现象存在,造成了菠萝品种名称的混乱,而本研究对菠萝品种的分类主要是依据其在分子水平的差异来进行。另外,本研究在研究材料中也加入了部分国内近年来选育的菠萝新品系,初步确定了部分国内新品系与国外引进菠萝品种间的亲缘关系,在菠萝新种质中,“红皮菠萝”是近年来发现的一个新的菠萝种质,田间性状初步评价认为,其颜色鲜艳、果肉细腻,可溶性固形物含量高(TSS=14.3),接近国际流行品种金菠萝(TSS=14.5),聚类结果表明,“红皮菠萝”与国外引进品种“珍珠”间具有较近亲缘关系(GS=0.937 5),这表明该种质选育可能来自“珍珠”的基因突变株系或与“珍珠”具有遗传关系相近的亲本;新种质“新品系-1”和“新品系-2”均与台农系列品种亲缘关系较近,这说明它们的选育很可能来自台农系列品种。分子标记技术在菠萝种质鉴定和生物多样性分析研究中具有很大的优势,相对传统的形态学和生理生化指标分类鉴定,它具有不受取材部位、发育阶段和环境因素影响的独特优势,结果可靠,尤其是 RAPD技术,具有简单、快速、不涉及同位素和多态性高等优点,应用更广泛,其弥补了菠萝传统分类方法的不足,为菠萝资源的收集、保存和科学利用提供了依据。
遗传多样性研究是菠萝育种的重要基础,通过对菠萝种质的遗传多样性分析,不仅可以较为准确的掌握不同菠萝种质的亲缘关系,为菠萝杂交育种中亲本的选配提供重要科学依据,同时,也可以从已有菠萝种质中有效发现存在的优良变异,为菠萝育种提供丰富的优异种质材料。本研究利用RAPD分子标记技术对47份菠萝种质的遗传多样性进行了分析,结果表明,我国菠萝种质的遗传多样性水平较高,种质间遗传相似系数平均值达到了0.715 5,该结果与前人利用AFLP[6,15]、RFLP[11]、ISSR[10]和RAPD[12]等对菠萝种质的研究存在一定差异,这可能与本研究菠萝种质的来源较广有关,这些菠萝种质来自世界上9个不同国家或地区,而地理位置的远近对菠萝遗传多样性具有较大影响。通过聚类分析和主成分分析,47份菠萝种质大致都可被划分为4个类群,该结果也比较准确直观的反映了不同菠萝种质间亲缘关系的基本状况。在47份菠萝种质中,MD2-2表现出了较大的遗传变异,其与其他菠萝种质间亲缘关系最远,这表明MD2-2是菠萝育种的良好材料,如果选用其作亲本配制杂交组合将获得较好的育种效果。台农16-1与巴厘-1虽然在植物学性状上存在一定的差异,前者为无刺,后者为有刺,但在本研究中却被聚为一类,且具有很高的遗传相似系数(0.812 5),这可能与这两个品种均来自同一父母本有关,这与窦美安等[7]的研究结果基本一致。“印尼有刺”和“印尼无刺”在植物学性状上的差异主要是叶刺的有无,因此推测其可能来自同一菠萝种质在控制叶刺基因位点上的变异,本研究的分析结果较好的验证了这一点,这两个种质的遗传相似系数较高,达到0.875 0。由此可见,分子标记更能从本质上揭示不同菠萝种质间的差异及亲缘关系。菠萝遗传多样性研究不仅在菠萝育种中发挥着重要作用,其在菠萝种质的有效保存、分类和科学利用中也具有十分重要的功能。因此,本研究结果将为未来我国菠萝种质的深入研究和菠萝高效育种提供一定的研究基础。
参考文献
[1] 窦美安, 张惠云, 孙伟生, 等. 菠萝无刺卡因和巴厘杂交F1的苗期表型分析[J]. 热带作物学报, 2011, 32(8): 1 431-1 433.
[2] 陆新华, 孙德权, 吴青松, 等. 12个泰国菠萝品种的果实品质评价[J]. 热带作物学报, 2011, 32(12): 2 205-2 208.
[3] 陈 菁, 孙光明, 臧小平, 等. 巴厘菠萝干物质和NPK养分累积规律研究[J]. 果树学报, 2010, 27(4): 547-550.
[4] 刘传和, 刘 岩, 谢盛良, 等. 不同成熟度菠萝果实香气成分分析[J]. 热带作物学报, 2009, 30(2): 234-237.
[5] Souza E H, Souza F V D, Carvalho Costa M A P, et al. Genetic variation of the Ananas genus with ornamental potential[J]. Genet Resour Crop Evol, 2012, 59: 1 357-1 376.
[6] 刘卫国, 易干军, 刘 岩, 等. 菠萝种质鉴定及亲缘关系的AFLP分析[J]. 果树学报, 2008, 25(4): 516-520.
[7] 窦美安, 邱文武, 吴青松, 等. 菠萝遗传多样性的SRAP分析[J]. 果树学报, 2010, 27(6): 930-937.
[8] 童和林, 冯素萍, 贺军虎, 等. 菠萝微卫星指纹图谱的构建[J]. 果树学报, 2011, 28(2): 240-245.
[9] 陈香玲, 苏伟强, 刘业强, 等. 36份菠萝种质的遗传多样性SCoT分析[J]. 西南农业学报, 2012, 25(2): 625-629.
[10] 张如莲, 傅小霞, 漆智平, 等. 菠萝17份种质的ISSR分析[J]. 中国农学通报, 2006, 22(6): 428-431.
[11] Duval M F, Noyer J L, Perrier X, et al. Molecular diversity in pineapple assessed by RFLP markers[J]. Theor Appl Genet, 2001, 102: 83-90.
[12] Ruas C F, Ruas P M, Cabral J R S. Assessment of genetic relatedness of the genera Ananas and Pseudananas confirmed by RAPD markers[J]. Euphytica, 2001, 119: 245-252.
[13] Dellaporta S L, Wood J, Hicks J B. A plant DNA mini-preparation: version II[J]. Plant Mol Biol Rep, 1983, 1: 19-21.
[14] Rohlf F J. NTSYS-pc: Numerical Taxonomy and Multivariate Analysis System, Version 2.1[M]. User Guide. Exeter Software, New York: Exeter Publication Ltd Setauket, 2000.
[15] Kato C Y, Nagai C, Moore P H, et al. Intra-specific DNA polymorphism in pineapple[Ananas comosus(L.)Merr.]assessed by AFLP markers[J]. Genetic Resources and Crop Evolution, 2004, 51: 815-825.

