血蓝蛋白不同免疫途径对小鼠T细胞依赖性抗体反应的影响
高艳新,朱玉洁,刘莹,符健,杨照新*
(1.承德市中医院检验科,河北承德 067000;2.海南医学院海南省药物安评中心,海口 571199)
研究报告
血蓝蛋白不同免疫途径对小鼠T细胞依赖性抗体反应的影响
高艳新1,朱玉洁2,刘莹2,符健2,杨照新2*
(1.承德市中医院检验科,河北承德 067000;2.海南医学院海南省药物安评中心,海口 571199)
目的探讨以血蓝蛋白(KLH)为特异性T细胞依赖性抗原,不同免疫途径下对小鼠T细胞依赖性抗体反应(TDAR)的影响。方法选用SPF级 KM小鼠,分为静脉注射组、皮下注射组、腹腔注射组及空白对照组。通过上述三种途径免疫小鼠,免疫剂量为每只200μg,第10天等剂量加强免疫一次,空白对照组不给予任何药物。于末次免疫后第7天,采血检测血清KLH抗体IgG含量,计算脾脏器系数,HE染色观察脾组织学变化。结果KLH三种不同免疫途径均可引起脾出现不同程度次级淋巴滤泡及生发中心的形成,B淋巴细胞凋亡,边缘区细胞增多等病理改变,以腹腔和静脉免疫途径脾形态变化更为明显;三种不同免疫途径均可引起机体产生抗体,与正常对照组相比差异具有显著性(P<0.05),其中静脉途径引起抗体产生浓度最高,明显高于其他两种免疫途径(P<0.05);各组脾脏器系数存在部分差异,其中静脉注射组和腹腔注射组脾脏器系数显著高于空白对照组(P<0.05),静脉注射组脾脏器系数显著高于皮下注射组和腹腔注射组(P<0.05)。结论KLH三种不同免疫途径引起机体产生抗体浓度、脾脏器系数及形态改变是不完全相同的,可通过这些差异多方面分析TDAR实验结果。
血蓝蛋白;T细胞依赖性抗体反应;脾脏系数;抗体;免疫;IgG;小鼠
T细胞依赖性抗体反应(T-cell dependent antibody response,TDAR)是B细胞针对T细胞依赖性抗原产生特异性抗体的一种综合免疫功能反应,是检测药物免疫毒性首选的一线试验[1]。近年以血蓝蛋白(keyhole limpet hemocyanin,KLH)做为特异性T细胞依赖性抗原的TDAR,已广泛用于药物临床前免疫毒性研究[2,3]。但有关KLH不同免疫途径对TDAR实验结果的影响,目前报道不多。本文以KLH为特异性T细胞依赖性抗原,探讨不同免疫途径对小鼠TDAR实验的影响。
1 材料与方法
1.1 实验动物
SPF级KM小鼠48只购自湖南斯莱克景达实验动物有限公司[SCXK(湘)2011-0003],雌雄各半,3~4周龄,体重18~22 g左右;实验动物饲养及操作均在海南省药物安全性评价研究中心[SYXK(琼)2012-0013]进行。
1.2 主要试剂来源
小鼠KLH单克隆抗体(12B4.G3.A8)购自Abcam公司(货号ab34607);辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG购自北京博奥森生物技术有限公司;KLH购自Sigma公司(货号H7017)。
1.3 研究方法
48只KM小鼠随机分为四组,分为静脉注射组、皮下注射组、腹腔注射组及空白对照组,每组12只,雌雄各半。通过上述三种途径免疫小鼠,参考文献[4]起始免疫剂量为每只200μg,第10天等剂量加强免疫一次,空白对照组不给予任何药物。于末次免疫后第7天,经眼球采血,参考文献方法[5]检测血清KLH抗体IgG含量,分离脾并称重,计算脾脏器系数,4%中性甲醛溶液固定脾,HE染色观察组织形态变化。
1.4 血清KLH抗体IgG含量检测方法
将抗原KLH以浓度为5μg/mL包被酶标板,待检血清以1∶20浓度稀释,酶标二抗以1∶20 000浓度稀释,将样品中待测抗体与KLH结合成固相抗原-受检抗体复合物,再用酶标二抗与固相免疫复合物中的抗体结合,形成固相抗原-受检抗体-酶标二抗复合物,加底物显色,确定待测抗体含量。标准品为小鼠KLH单克隆抗体,最高浓度为200 ng/L,倍比稀释制作标准曲线。
1.5 统计学方法
采用SPSS 15.0对结果进行单因素方差分析,数据以均数±标准差(±s)表示。
2 结果
2.1 脾病理组织学检查结果
KLH不同免疫途径均可引起脾形态发生变化,以腹腔注射组和静脉注射组形态变化更为明显,皮下注射组次之。可出现次级淋巴滤泡及生发中心的形成,B淋巴细胞凋亡,边缘区细胞增多等病理改变(见图1)。
2.2 各组实验动物血清KLH抗体IgG和脾脏器系检测结果
表1结果显示:三种不同KLH免疫途径均可引起机体产生抗体,与正常对照组相比差异有显著性(P<0.05),其中静脉途径引起抗体产生浓度最高,明显高于其他两种免疫途径(P<0.05)。各组脾脏脏器系数存在部分差异,其中静脉注射组和腹腔注射组脾脏器系数显著高于空白对照组(P<0.05);静脉注射组脾脏器系数显著高于皮下注射组和腹腔注射组(P<0.05)。
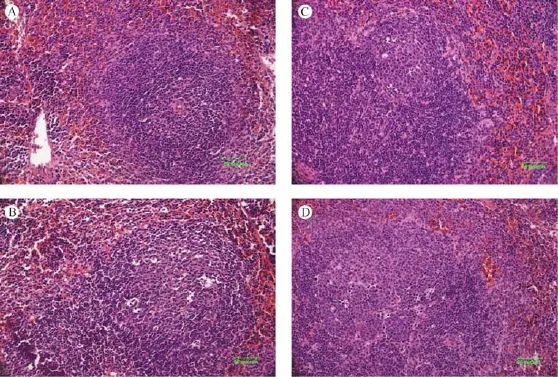
图1 各组脾病理组织学检查结果(×400)Fig.1 Histological changes of the spleen in various groups.×400
表1 各组血清KLH抗体IgG含量和脾脏器系数检测结果(±s,n=12)Tab.1 The spleen coefficient and serum KLH IgG in various groups
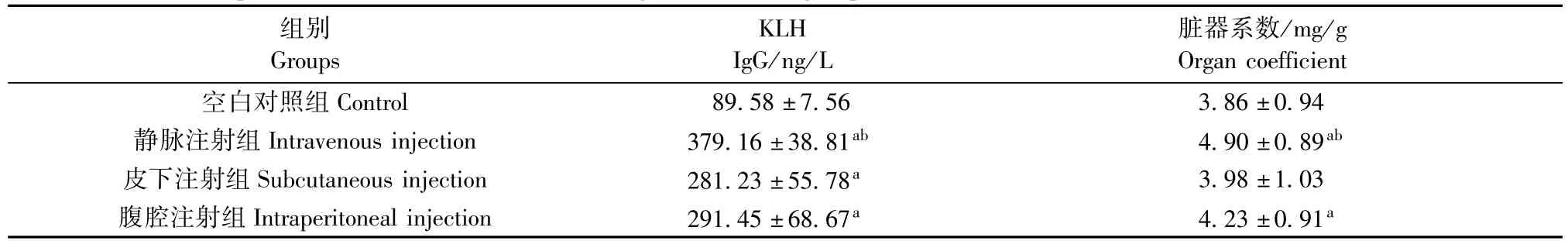
表1 各组血清KLH抗体IgG含量和脾脏器系数检测结果(±s,n=12)Tab.1 The spleen coefficient and serum KLH IgG in various groups
注:与空白对照组相比aP<0.05;与皮下注射组和腹腔注射组相比bP<0.05.Note.Compared with the control group,aP<0.05;Compared with the subcutaneous injection and intraperitoneal injection groups,bP<0.05.
组别Groups脏器系数/mg/g Organ coefficient空白对照组Control 89.58±7.56 3.86±0.94静脉注射组Intravenous injection 379.16±38.81ab4.90±0.89ab皮下注射组Subcutaneous injection 281.23±55.78a3.98±1.03腹腔注射组Intraperitoneal injection 291.45±68.67a4.23±0.91aKLH IgG/ng/L
3 讨论
以KLH为特异性T细胞依赖性抗原的TDAR实验是免疫毒理学研究中考察药物免疫毒性较好的功能性实验,它可以反映药物对免疫系统整体的影响,并且比传统的TDAR实验(绵羊红细胞)在抗原特异性、操作性及标准化等问题上,具有明显的优势[1]。KLH是一种可溶性的、具有高度免疫原性的蛋白[6],是从海洋软体动物中提取出来的一种多聚体蛋白,具有可溶性和高度免疫原性,分子量在(350~400)×103,比SRBC具有结构稳定、易标准化、保质期长和不易变质的优点,更适合作为T细胞依赖性抗原。TDAR实验的特点决定了它可以很好地反应免疫抑制或刺激类药物对免疫系统的整体影响,尤其是一些化疗药物或抗癌药物,但是固定的免疫途径对于不同的免疫抑制或刺激药物未必都能体现免疫毒性。此外一些已知免疫抑制剂如抗癌药物,本身就存在免疫抑制,需要考察的是其免疫抑制程度,可能需要与之相适应的免疫方法,特别是在评价一些肿瘤化疗药的免疫抑制程度显得尤为重要[7]。
本文通过研究以KLH为免疫原,KM种小鼠在不同的免疫途径的不同免疫效果时发现,腹腔、静脉及皮下等三种不同免疫途径均可引起脾出现不同程度次级淋巴滤泡及生发中心的形成,B淋巴细胞凋亡,边缘区细胞增多等病理改变,以腹腔和静脉免疫途径脾形态变化更为明显;同时三种不同免疫途径均可引起机体产生抗体,与正常对照组相比具有显著差异(P<0.05),其中静脉途径引起抗体产生浓度最高,明显高于其他两种免疫途径(P<0.05);各组脾脏器系数存在部分差异,其中静脉注射组和腹腔注射组脾脏器系数显著高于空白对照组(P<0.05),静脉注射组脾脏器系数显著高于皮下注射组和腹腔注射组(P<0.05)。这些结果表明KLH的三种不同免疫途径均可引起机体产生特异性抗体,脾脏器系数及形态也发生不同程度的改变。但不同的免疫途径免疫效果又不完全相同,我们完全可通过这些差异多方面分析TDAR实验结果。并且如能根据这些差异,包括不同的免疫浓度、免疫途径、免疫剂量、免疫器官的形态变化以及免疫后一些细胞因子的改变等等,建立以KLH为特异性抗原的TDAR实验等级分析方法,定能有效地推动TDAR检测方法的发展和标准化。
[1] 霍艳,艾文超,苗玉发,等.T细胞依赖性抗体反应检测方法研究进展[J].中国新药杂志,2011,20(17):1620-1623.
[2] Peachee VL,Smith MJ,Beck MJ,et al.Characterization of the T-dependentantibody response(TDAR)to keyhole limpethemocyanin(KLH)in the Gottingen minipig[J].J Immunotoxicol,2014,(11)4:376-382.
[3] Vandebriel RJ,Tonk ECM,De La Fonteyne-Blankestijn LJ,et al. Immunotoxicity of silver nanoparticles in an intravenous 28-day repeated-dose toxicity study in rats[J].Particle Fibre Toxicol,2014,11(1):21.
[4] Aulim,Domenech A,Andres A,etal.Multiparametric immunotoxicity screening inmice during early drug development[J].Toxicol Lett,2012,214(2):200-208.
[5] 侯俊,刘泽,谢国明,等.新型呼肠病毒S基因DNA疫苗在小鼠体内的免疫原性[J].中国实验动物学报,2014,22(4):24 -27.
[6] Lebrec H,Hock MB,Sundsmo JS,et al.T-cell-dependent antibody responses in the rat:forms and sources of keyhole limpet hemocyanin matter[J].J Immunotoxicol,2014,11(3):213-221.
[7] AiWC,Huo Y,Liu XM,et al.Relative sensitivities of TDAR,cytokine production,and immunophenotyping assays in immunotoxicity assessment[J].Toxicol Res,2014,3(6):465-473.
Effect of different routes of kejhole lim pet hemocjanin immunization on the T cell dependent antibodj response in m ice
GAO Yan-xin1,ZHU Yu-jie2,LIU Ying2,FU Jian2,YANG Zhao-xin2*
(1.Clinical Laboratory,Chengde City Hospital of Traditional Chinese Medicine,Chengde 067000,China. 2.Research Center for Drug Safety Evaluation,Hainan Medical College,Haikou 571199)
ObjectiveTo study the influence of different routes of keyhole limpet hemocyanin(KLH)immunization on the T-cell-dependent antibody response in mice.MethodsSPF Kunmingmice were divided into four groups:the intravenous injection group,subcutaneous injection group,intraperitoneal injection group and control group.Each mouse was injected 200μg KLH intravenously,subcutaneously or intraperitoneally daily for consecutive 10 days,respectively. Mice in the control group were given solvent injection only.Serum concentration of IgG stimulated by KLH antigen was measured 7 days after the last dosing.Spleen was isolated to calculate the organ coefficient and examined by pathology using hematoxylin and eosin staining.ResultsIntravenously,subcutaneously and intraperitoneally administered KLH stimulated the generation of secondary lymphoid follicles and germinal center to varying degrees,B cell apoptosis,increased amount of cells in themarginal zone and other pathological changeswere observed in the spleen.Intravenous and intraperito-neal administration of KLH led tomore pronounced pathological changes compared with that in the subcutaneous injection group.All of the three administration routes of KLH induced generation of IgG antibody,significantly higher than that in the control group(P<0.05).Intravenous injection of KLH generated the highest concentration of IgG and organ coefficient among the three administration routes(P<0.05).ConclusionsDifferent immunization routes do affect the production of IgG antibody,organ coefficientand pathological changes in the spleen,and these differences should be taken into consideration when analyzing the T cell dependent antibody response in mice.
Keyhole limpet hemocyanin,KLH;Immunization;T-cell-dependent antibody response,TDAR;Spleen index;Antibody;Mouse
Q95-33
A
1005-4847(2015)06-0639-04
10.3969/j.issn.1005-4847.2015.06.018
2015-07-07
海南省重大科技专项项目(ZDZX2013003)。
高艳新,女,主管检验师,主要从事临床检验数据分析与动物建模。E-mail:568659214@qq.com。
杨照新,男,副研究员,从事药物安全性评价研究工作。Email:168494512@qq.com.

