转化生长因子β1与人类Runt相关转录因子3在结肠癌中的表达及其两者表达的相关性研究
何绍亚,向阳生※,王 岭,蒋 婕,何 莉
(1.安岳县人民医院消化内科,四川安岳 642350;2.安岳县石羊中心卫生院内科,四川安岳 642357;3.重庆市第六人民医院妇产科,重庆 642350)
结肠癌是常见的消化道恶性肿瘤之一,病死率高。直肠与乙状结肠交界处是好发部位,35岁以上人群是好发人群,全球结直肠癌病例每年以1200万的速度递增,递增水平约为2.0%,我国结肠癌以每年4.2%的速度增加,超过了全球年递增水平[1]。结肠癌中有80%~90%是由腺瘤发生演变而来,Runt相关转录因子3(Runt-related transcription factor 3,Runx3)与转化生长因子 β1(transforming growth factor β1,TGF-β1)可能参与了结肠病变由息肉向结肠癌发展这一演变进程[1]。本组收集结肠癌、结肠腺瘤性息肉患者以及健康体检者结肠黏膜标本各34例,探讨Runx3和TGF-β1与结肠癌的关系以及两者表达的相关性。
1 资料与方法
1.1 一般资料 收集2011年1月至2013年12月安岳县人民医院收治的结肠癌患者34例、结肠腺瘤性息肉患者34例标本以及正常体检的34例结肠黏膜标本。结肠癌组中,男18例、女16例;年龄38~78岁,平均(57±6)岁;Dukes分期A期5例、B期10例、C期12例、D期7例;低分化腺癌14例,高分化腺癌20例。结肠息肉组中,男20例、女14例,年龄28~83岁,平均(56±7)岁。结肠黏膜组中,男17例、女17例,年龄38~78岁,平均(57±5)岁。三组患者的性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 实验方法 将所有标本采用甲醛固定,常规石蜡包埋、切片、脱蜡,采用SP法进行免疫组织化学检查。以磷酸缓冲液作为阴性对照,以阳性结肠癌切片为阳性对照,采用3-氨基-9-乙基咔唑显色。
1.3 结果判定 均以胞质着黄色为阳性,分级和记分方法以细胞百分率和染色的深浅程度为准[2]。①阳性细胞百分率:无细胞显色为0分;<25%细胞显色为1分;25%~50%细胞显色为2分;>50%细胞显色为3分。②染色的深浅程度:无色或显色不清记数为0分;浅黄色为1分;棕黄色为2分;深褐色为3分。两项乘积0~1分阴性(-);2~3分弱阳性(±);4~5分阳性(+);>5分强阳性(++)。阳性结果判定以4分为临界值,记分≥4分判定为阳性,<4分为阴性。
1.4 统计学方法 应用SPSS 17.0统计软件进行数据处理,计量资料用均数±标准差(±s)表示,三组间比较采用单因素方差分析,计数资料比较采用χ2检验或Fisher确切概率法,相关性采用Spearman相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 Runx3、TGF-β1在不同结肠组织中的表达情况 结肠癌组织Runx3表达阳性率低于结肠黏膜和结肠息肉组织,差异有统计学意义(χ2=23.61,13.82,P<0.01)。TGF-β1在三种组织中的表达阳性率趋势和Runx3恰好相反,结肠癌组织中的表达率显著高于结肠息肉和结肠黏膜组织,差异有统计学意义(χ2=16.49,24.29,P<0.01)。见表 1。
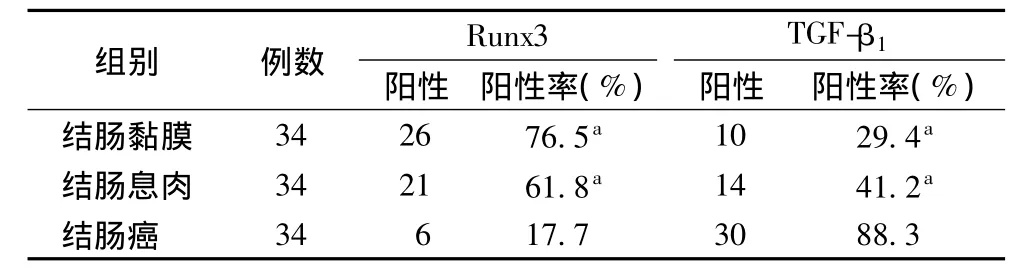
表1 不同结肠组织中Runx3和TGF-β1的表达情况
2.2 结肠癌组织中Runx3及TGF-β1表达的相关性 相关性分析结果显示,结肠癌组织中Runx3与TGF-β1表达呈负相关(rs= -0.48,P<0.05),见表2。

表2 结肠癌Runx3与TGF-β1表达相关性 (例)
3 讨论
Runx3基因是近年来发现的一个新的抑癌症基因,定位于人类染色体1号短臂lp36.1上,有6个外显子和2个启动子,属于Runx结构域转录因子家族成员,与肿瘤发生、发展有密切关系[2]。关于Runx3在肿瘤中的表达情况及其与肿瘤发生、发展的关系有诸多报道,Watanabe等[3]对结肠癌组织标本中Runx3mRNA表达水平及DNA拷贝数的变化进行检测,发现Runx3表达水平与DNA拷贝数相关。Kodach等[4]发现结肠癌组织标本中,Runx3-mRNA转录下调和Runx3-DNA甲基化关系密切。Li等[5]联合应用 DNA甲基化转移酶抑制剂5-氮-2-脱氧胞苷和曲古抑菌素恢复了Runx3在胃癌细胞中的表达活性,证实了Runx3启动子异常甲基化是导致Runx3基因表达失活的主要原因。Deng和Zhang[6]使用5-氮-2-脱氧胞苷处理结肠癌细胞后发现癌细胞生长明显被抑制而凋亡增多,提出甲基化抑制剂可以逆转Runx3基因启动子的甲基化而重新激活其表达的活性。何绍亚等[7]发现,Runx3基因 CpG岛甲基化在结肠癌、结肠腺瘤和正常的结肠黏膜组织间差异有统计学意义。上述报道均提示,Runx3与结肠癌的发展有关,而且其表达的下调与Runx3基因的表观遗传修饰作用有关。本研究结果显示,结肠癌组织中Runx3阳性表达率明显低于结肠息肉及结肠黏膜组织(P<0.01),这与上述文献结果基本一致,提示Runx3表达情况可能与结肠病变的严重程度有关。
TGF-β1是一种由二硫键连接的多肽二聚体生长因子,耐酸碱、耐高温、耐变性剂,在 TGF-β家族中水平最高、作用最强、功能强大[8]。TGF-β1基因定位于染色体19q3上,有6个内含子和7个外显子,在胚胎发育、细胞增殖、细胞分化凋亡、免疫调节以及促进肿瘤细胞对血管上皮细胞生长因子的分泌方面均有重要作用[9]。有学者提出[10-12],TGF-β1信号通路在结肠癌发展的不同阶段可能发挥截然不同的作用,在肿瘤形成的早期,TGF-β1能抑制c-myc基因,防止结肠内皮从生理性增生向病理性增生转化,有维持结肠内皮正常分裂和抑制癌症生长的作用。但是到了癌症的中晚期,TGF-β1能促进结肠癌细胞的生长和浸润,可通过增加基质金属蛋白酶9以及环加氧酶2的分泌,使极性的上皮细胞摆脱细胞-细胞间连接转换成可在细胞基质间自由移动的细胞,使宿主免疫系统不能有效监控肿瘤细胞,辅助癌症的转移,此时,TGF-β1又变成了一个促进肿瘤生长和扩散的致癌基因。TGF-β1在肿瘤患者血清及癌组织中的表达情况已有文献报道,李晓勇和刘少平[11]发现,TGF-β1在结直肠癌以及肿瘤复发患者血清中的水平明显高于正常人,而TGF-β1在结直肠癌患者血清中的水平与肿瘤的分化程度、病理分期均呈正相关。王梦洁等[13]发现,发生远处转移的结直肠癌患者血清TGF-β1水平显著高于无远处转移者,提示TGF-β1可能在结直肠癌的转移机制中发挥重要作用。辛玉等[14]对结肠癌组织中TGF-β1的表达进行研究,发现TGF-β1呈高表达状态,而且与肿瘤的Dukes分期、浸润深度以及淋巴结转移密切相关。本研究结果与上述报道相似,TGF-β1在结肠癌组织中阳性表达率高,明显高于结肠息肉及结肠组织(P<0.01),但 TGF-β1在结直肠癌与结肠腺瘤中具体所发挥的作用到底是抑制肿瘤生长还是辅助扩散,尚有待进一步研究证实。
本研究结果显示,从正常结肠黏膜到结肠息肉再到结肠癌,Runx3的表达率呈明显的递减趋势,而TGF-β1的表达呈明显的递增趋势,提示结肠息肉癌变可能与Runx3基因失活以及TGF-β1在结肠癌组织中的高表达有一定的关系,Runx3和TGF-β1可能都参与了正常结肠黏膜向结肠腺瘤的转变、再向癌症晚期发展的过程。有研究发现[15],Runx3表达下调可导致TGF-β1信号转导通路功能的缺失,引起胃肠黏膜上皮细胞异常增殖和细胞凋亡减少,提示Runx3基因与TGF-β1信号转导过程关系密切。但是关于Runx3表达与TGF-β1信号转导通路在结肠癌中关系的研究报道较少。本研究对Runx3与TGF-β1在结肠癌组织中的表达的相关性进行研究,结果提示Runx3和TGF-β1在结肠癌中的确存在某种关联,可能共同参与结肠癌的发生、发展,但两者间是否存在与胃黏膜上类似的情况,尚有待进一步研究证实。
综上所述,Runx3及TGF-β1在不同结肠组织中的表达差异明显,在结肠癌组织中表达有相关性,检测 Runx3和TGF-β1可能为结肠癌早期诊断提供一定依据。
[1]Miyazono K,Maeda S,Imamura T.Coordinate regulation of cell growth and differentiation by TGF-β super family and Runx Proteins[J].Oncongene,2004,23(24):4232-4237.
[2]陈贵宗,张刚.RUNX3基因与肿瘤相关机制的研究进展[J].医学综述,2012,18(2):216-218.
[3]Watanabe T,Kobunai T,Ikeuchi H,et al.RUNX3 copy number predicts the development of UC.associated colorectal cancer[J].Int J Oncol,2011,38(1):201-207.
[4]Kodach LL,Jacobs RJ,Heijmans J,et al.The role of EZH2 and DNA methylation in the silencing of the tumour suppressor RUNX3 in colorectal cancer[J].Carcinogenesis,2010,31(9):1567-1575.
[5]Li QL,Ito K,Sakakura C,et al.Causal relationship between the loss of RUNX3 expression and gastric cancer[J]].Cell,2002,109(1):113-124.
[6]Deng T,Zhang Y.5-Aza-2'-deoxycytidine reactivates expression of RUNX3 by deletion of DNA methyltransferases leading to caspase independent apoptosis in eolorectal cancer Lovo cells[J].Biomed Pharmacother,2009,63(7):492-500.
[7]何绍亚,韩盛玺,蒋仁发,等.Runx3基因甲基化及Runx3蛋白表达在结肠癌发生中的意义[J].世界华人消化杂志,2011,19(17):1860-1863.
[8]Daniel P,Wagrowska-Danilewcz M,Danilewicz M,et al.TGF-β1and MMP-9 over expression in colorectal cancer(CC)and adenoma[J].Int J Colorectal Dis,2007,22(10):1165-1172.
[9]刘玺,郑勇,陈卫刚.TGF-β/SMADS通路及其Smad4基因在胃癌中的研究现状[J].医学综述,2013,19(21):3841-3843.
[10]Vogelmann R,Nguyen-Tat MD,Giehl K,et al.TGF beta-induced down regulation of E-cadherin-based cell-cell adhesion depends on PI3-kinase and PTEN[J].Cell Sci,2005,118(Pt 20):4901-4912.
[11]李晓勇,刘少平.结直肠癌患者血清TGF-β1的检测及临床意义[J].广西医科大学学报,2011,28(1):82-84.
[12]Tong D,Qu H,Meng X,et al.S-allylmercaptocysteine promotes MAPK inhibitor-induced apoptosis by activating the TGF-β signaling pathway in cancer cells[J].Oncol Rep,2014,32(3):1124-1132.
[13]王梦洁,孙苏平,钱科卿,等.结直肠癌患者血清IL-17和TGF-β浓度及其相关性的初步研究[J].中国肿瘤临床,2013,40(13):767-769.
[14]辛玉,袁俊华,林黎明.TGF-β1和VEGF在结肠癌组织中的表达和临床意义[J].中国现代普通外科进展,2012,15(11):845-849.
[15]刘宇辉,许岸高.RUNX3基因与胃癌的研究进展[J].医学综述,2014,20(4):640-642.

