Fe3+存在下制浆中段废水好氧活性污泥的驯化
蓝惠霞 耿士文 李慧洁 王传路 王晓红 兰善红
(1.青岛科技大学环境与安全工程学院,山东 青岛,266042;2.南京林业大学江苏省制浆造纸科学与技术重点实验室,江苏 南京,210037;3.青岛科技大学化工学院,山东 青岛,266042;4.东莞理工学院化学与环境工程学院,广东 东莞,523808)
制浆中段废水含大量不易生物降解的木素及其衍生物以及各种添加剂,属于难处理废水之一。对制浆中段废水的处理方法主要包括物化法、生化法、高级氧化法。物化法一般作为生化前的预处理方法,而高级氧化法由于运行费用较高,往往用于废水的深度处理[1-2]。
作为废水的中心处理单元,生化法运行的好坏直接关系废水的达标排放和后续的深度处理费用。好氧活性污泥工艺是目前常用的处理制浆中段废水的生化方法。但如果该系统运行条件控制不好,就会发生污泥膨胀现象,导致处理效果变差,难以满足日益严格的排放标准。因此对好氧活性污泥强化技术的研究成为热点[3-6],其中利用Fe3+对微生物的强化过程由于操作简单、费用低引起了人们的关注。生物铁法可处理的废水类型很广,如焦化废水、高浓度难降解的印染废水、不同性质企业混合废水等,采用生物铁法处理都能获得较好的处理效果[7-8]。蓝惠霞等人[9]研究结果发现,高铁酸钾氧化处理废水后,其还原产物Fe3+具有一定的絮凝性和促进微生物生长作用,改善出水水质,采用其来强化活性污泥,不仅可以提高有机污染物的去除率,还可以去除SS。
本实验研究Fe3+存在下,处理制浆中段废水的好氧活性污泥驯化过程中对污染物的去除效果以及污泥中微生物活性情况,以期为实际应用提供参考。
1 实验
1.1 实验材料
实验用废水取自山东某造纸厂的制浆中段废水,该厂生产化学木浆,漂白采用过氧化氢加二氧化氯。废水CODCr约1300 mg/L,pH值7.0左右,经絮凝预处理后CODCr约800~900 mg/L。以絮凝后的出水进行生化实验。在驯化过程中添加的营养液组成为:葡萄糖 800 mg/L,硫酸铵 184 mg/L,磷酸二氢钾70 mg/L,硫酸镁33 mg/L,氯化钙66 mg/L,碳酸钠260 mg/L。接种污泥取自青岛某城市污水处理厂曝气池中的好氧活性污泥。
1.2 分析方法
采用便携式溶解氧仪 (HQd,HACH,美国)对溶解氧进行测定;采用精密pH值试纸对溶液pH值进行测定;采用美国HACH公司生产的DR2700型便携式水质分析仪进行CODCr测定。
UV-254的测定采用北京普析通用仪器有限责任公司生产的TU-1901型双光束紫外可见分光光度计。UV-254是指在波长为254 nm处的单位比色皿光程下的紫外吸光度,可反映废水中一些特殊有机物的含量[10],本实验以UV-254的减少率表示实验所用制浆中段废水中污染物的去除率。
脱氢酶活性的测定采用TTC(氯化三苯基四氮唑)还原法测定[11],脱氢酶活性单位定义为:单位体积混合液在单位时间内还原TTC所产生的TF(三苯基甲臜)的毫克数,单位mg TF/(L·h)。
1.3 实验方法
1.3.1 Fe3+用量的确定实验
制作液体培养基1500 mL,培养基组成同1.1中营养液的组成。分装到6个锥形瓶中,各200 mL。锥形瓶中 Fe3+浓度分别为 0、10、20、30、40、50 mg/L,调节pH值至7.0~7.2,纱布包裹锥形瓶口,灭菌后,接种活化后污泥上清液1 mL至各锥形瓶,置于30℃的振荡器中振荡,每1 h测定1次吸光度 (600 nm下,以OD600表示),以OD600为纵坐标,时间为横坐标绘制不同的生长曲线。
1.3.2 好氧活性污泥驯化实验
采用静态间歇式方式进行驯化。驯化开始时,将接种污泥混合液平分成两部分,分别加入到两个3000 mL的大烧杯中进行驯化。两反应器中污泥浓度均为4 g/L左右。其中一个反应器加入硫酸铁,另外一个反应器中不加硫酸铁作为空白组。pH值控制在7.2左右,溶解氧浓度控制在3~4 mg/L,处理周期为24 h。
驯化过程分别经过了6个阶段,在6个阶段过程中,制浆中段废水体积与营养液体积之比不断提高,分别为1∶9、2∶8、4∶6、6∶4、8∶2、10∶0。驯化过程各阶段比例与时间如表1所示。
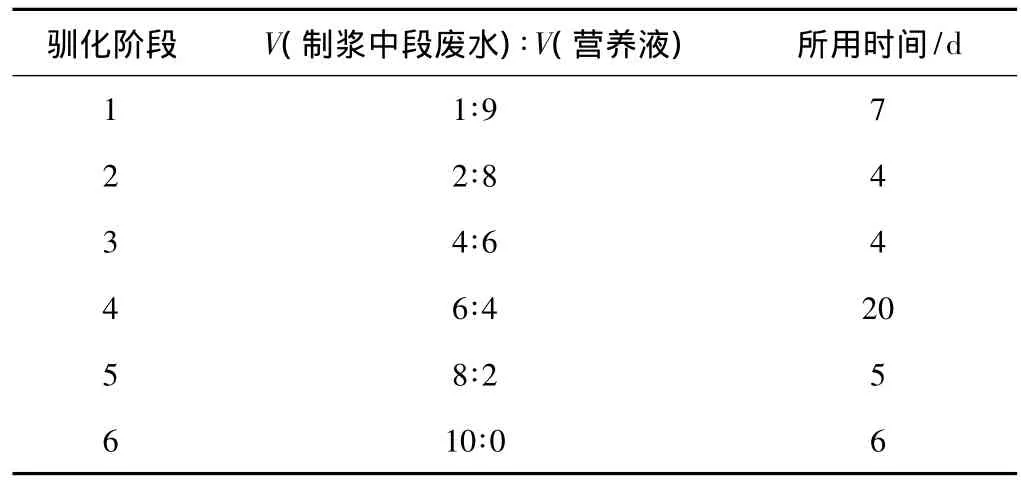
表1 驯化过程各阶段比例与时间
2 结果与讨论
2.1 Fe3+用量的确定
实验以微生物生长曲线为指标,确定实验过程中Fe3+的用量。Fe3+用量对微生物生长曲线的影响如图1所示。
从图1可以看出,不加Fe3+的情况下,微生物在5 h左右进入对数生长期。当Fe3+用量为10 mg/L和20 mg/L时,微生物也均在近5 h进入对数生长期,表明低浓度Fe3+对微生物的刺激生长作用较小。当Fe3+用量为30 mg/L、40 mg/L、50 mg/L时,微生物在4 h左右进入对数生长期,对缩短停滞期和提前进入对数生长期存在积极作用。
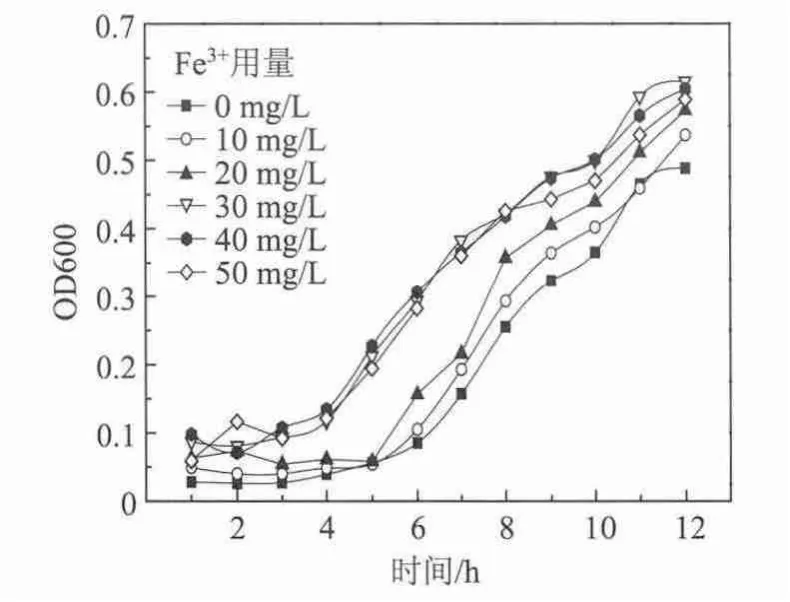
图1 Fe3+对微生物生长曲线的影响
Fe3+用量小于30 mg/L时,与不投加Fe3+的情况相比,OD600值增加不大,而Fe3+用量为30 mg/L时,OD600值具有明显增加,在12 h基本达到最大(0.615),表明Fe3+对微生物生长具有较大的刺激作用。Fe3+用量超过30 mg/L,对微生物生长的刺激作用基本上变化不大,甚至更低。Fe3+对活性污泥系统存在促进作用,超出范围促进作用减弱甚至可能会出现抑制作用。
Zavuhi Vardanyan 等人[12]研究了 Fe3+和 Fe2+对细胞生长的不同影响,结果表明两种铁离子对微生物的影响实验都需要设定精确的浓度范围,表明铁离子对微生物促进作用的直接因素是用量。并进一步研究了厌氧环境中Fe3+浓度对海氏肠球菌 (Enterococcus hirae)生长的影响,结果表明Fe3+浓度在0.05~2 mmol/L范围,对海氏肠球菌 (Enterococcus hirae)生长具有刺激作用,可明显缩短微生物延滞期,提高微生物的比生长速率。
本研究中,Fe3+对好氧微生物影响的实验结果表明,Fe3+浓度在0~50 mg/L的范围内,对好氧微生物的生长具有刺激作用,使得延滞期缩短。从效果和经济性考虑,Fe3+浓度取30 mg/L比较合适。
2.2 驯化阶段CODCr去除率的变化
驯化阶段CODCr去除率的变化如图2所示。
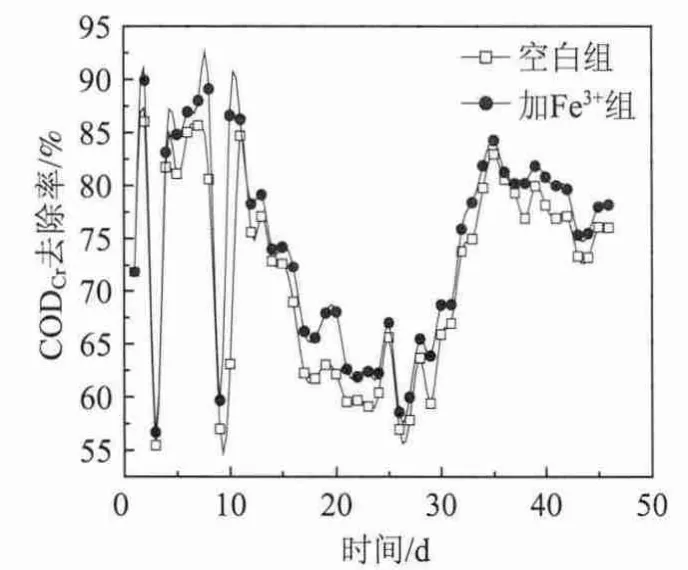
图2 驯化过程中CODCr去除率的变化
由图2可知,在前两个阶段,即制浆中段废水与营养液体积比为1∶9和2∶8阶段,不论是加Fe3+组还是空白组经历比较短的时间,CODCr去除率就达到较高的值,且两组实验差别不大。在驯化开始阶段,营养液的比例大于制浆中段废水的比例,活性污泥中以葡萄糖为主要碳源的菌种多于降解制浆中段废水中有害物质的菌种。当制浆中段废水与营养液体积比提高为4∶6,即驯化的第12天,CODCr去除率有较为明显的下降,经过4天的适应期,即驯化的第15天,加Fe3+组和空白组CODCr去除率分别为75%和74%左右。在驯化的第16天,制浆中段废水与营养液体积比提高为6∶4,CODCr的去除率产生了大幅度的下降,一直处于较低水平。出现这种情况的原因是4∶6阶段持续时间太短,CODCr去除率没有达到足够好,能够处理制浆中段废水中有害物质的优势菌种数量不足,另外由于此时的制浆中段废水所占比例已经高于营养液所占比例,所以产生较高的负荷冲击,活性污泥中的以葡萄糖为第一碳源的大部分微生物活性受到抑制甚至死亡,而优势菌由于可利用碳源不足而不能快速生长。但在这个阶段经历20天的驯化后,即在第35天加Fe3+组和空白组CODCr去除率分别达到84.3%和82.9%。在驯化第36天制浆中段废水与营养液的体积比提高为8∶2,在此驯化阶段的5天内,CODCr去除率先下降后上升,虽然制浆中段废水比例的提高对活性污泥造成了一定冲击,由于6∶4阶段结束时大量优势菌已经存在,因此这个阶段仅经历了5天,即在驯化的第40天加Fe3+组和空白组CODCr去除率分别达到80.8%和78.1%。驯化的第41天,制浆中段废水与营养液的体积比提高为10∶0,即进水全部由制浆中段废水组成,经过6天,加Fe3+组和空白组CODCr去除率分别达到78.2%和76.0%。
整个驯化过程,加Fe3+组CODCr去除率始终高于空白组,尤其是在制浆中段废水比例较高时,两组CODCr去除率相差比较明显。Fe3+的存在提高了微生物中酶的活性,同时促进了微生物的生长繁殖,从而使得在Fe3+的存在下,活性污泥对废水的处理效果有所提升[13]。Qi Zhou 等人[14]的研究中发现 Fe2+和Fe3+的存在,可以大大提高好氧菌绿脓假单胞菌(Pseudomonas aeruginosa)对硝酸盐和铵盐的利用率。表明了Fe3+在合适的浓度范围会促进好氧微生物的代谢活性,这与本研究的结果相一致。
2.3 驯化阶段污染物去除率的变化
驯化过程污染物去除率的变化如图3所示。驯化结束后加Fe3+组和空白组出水的紫外可见频谱图如图4所示。
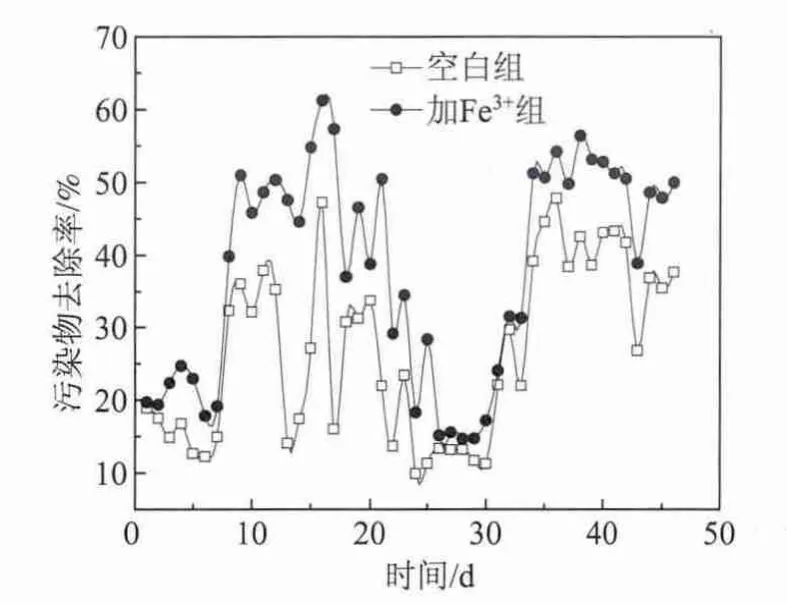
图3 驯化过程中污染物去除率的变化
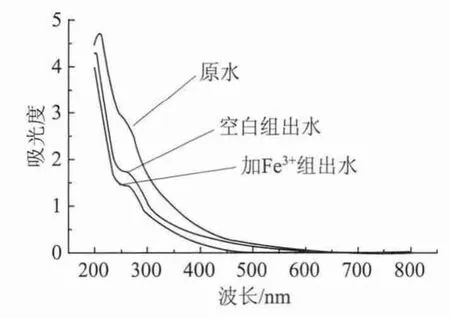
图4 驯化结束后紫外光可见频谱图
由图3可以看出,污染物去除率的变化趋势与CODCr去除率的相似。在整个驯化过程中,加Fe3+组对污染物的去除始终高于空白组,驯化结束加Fe3+组和空白组的污染物去除率分别为50.0%和37.7%。这主要是由于Fe3+能够提高微生物中酶的活性,并促进活性污泥中优势菌的生长繁殖,从而使得降解废水中苯环类物质以及大分子物质的优势菌富集量大,且酶的活性高。在有机物的好氧降解过程中,加氧酶和脱氢酶起着重要的作用。加氧酶分为单加氧酶和双加氧酶,在苯环类物质的开环反应和非极性有机物的氧化过程中,可以使苯环通过加氧发生开环或非极性烃类物质加氧形成醇和酸,有利于后续在脱氢酶作用下的矿化。Fe2+和Fe3+是许多加氧酶活性中心的组成成分[15-16],当外界环境中存在适当浓度的铁离子时,有利于加氧酶活性的提高,从而有利于苯环类物质的开环反应,相应地,出水的吸光度 (UV-254值)降低,表现为污染物去除率升高。
脱氢酶在脂肪类极性有机物的矿化作用及生物体内能量的产生过程中起着重要的作用。在有机物好氧矿化途径三羧酸循环过程中,每一步脱酸脱氢的氧化过程均有脱氢酶的参与,因此脱氢酶的活性决定着有机物的矿化率。Fe2+和Fe3+构成脱氢酶活性中心4Fe-4S成分,如琥珀酸脱氢酶、NADH脱氢酶、乙醇脱氢酶等。当铁离子浓度范围合适时,对脱氢酶具有活化作用。当脱氢酶活性高时,有利于有机物的彻底矿化,即出水CODCr降低,CODCr去除率升高。因此在Fe3+的影响下,活性污泥对于制浆中段废水中的污染物和CODCr去除 (图1)明显提高。从图4中原水、空白组出水和加Fe3+组出水的紫外光可见频谱图可以看出,加Fe3+组的250~500 nm处吸光度低于空白组,而空白组又明显低于原水。
此外三价铁化合物作为常用的絮凝剂,对于反应器中的有利细菌起凝聚作用,减少随排水洗脱的微生物,使反应器中微生物量尤其是优势菌的量增加,有利于处理效果的提高。
2.4 Fe3+对活性污泥活性的影响
好氧活性污泥除了微生物的降解作用外,还具有吸附作用 (死细胞同样具有吸附作用),而且Fe3+的加入还具有絮凝作用,对废水中的污染物质具有去除作用,因此仅依据CODCr去除率和污染物去除率不能真实反映微生物活性。可通过脱氢酶的活性变化来反映生物降解的真正效果。
Fe3+对脱氢酶活性的影响如图5所示。
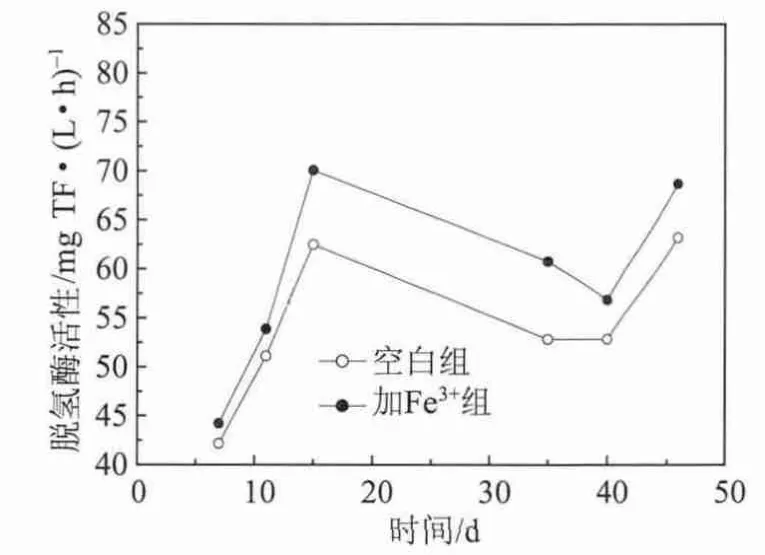
图5 驯化过程中脱氢酶活性的变化
脱氢酶的活性可以表示活性污泥的活性。由图5可以看出,在驯化的前3个阶段,无论是空白组还是加Fe3+组,脱氢酶的活性随着驯化的进行逐渐上升。虽然驯化开始阶段污染物负荷有所提升,但总体而言污染物浓度并达不到很高的程度,此3个阶段营养液比例过半,能够降解制浆中段废水的优势菌种不断繁殖的同时,依然有大量的只利用葡萄糖的非优势菌存在,且数量减少不明显。因此在前3个阶段,随着驯化的进行,脱氢酶的活性不断升高。
当制浆中段废水与营养液比例达到6∶4、8∶2的阶段,脱氢酶活性呈下降趋势,活性污泥中微生物的生存环境发生了很大变化,突然的冲击负荷使得很多只以葡萄糖为碳源的非优势菌被严重抑制甚至死亡,而此时能够降解制浆中段废水中有害物质的优势菌还没有富集到足够的数量。而当制浆中段废水占100%后,脱氢酶的活性又明显提高,由于此时,只以葡萄糖为碳源的非优势菌已经死亡殆尽,而能够降解制浆中段废水的优势菌已经大量繁殖并有了相当的数量。
整个驯化过程加Fe3+组脱氢酶活性高于空白组。Fe3+是构成脱氢酶中铁氧化还原蛋白或铁硫蛋白的主要成分,Fe3+的存在,一方面有利于细菌中脱氢酶的合成,使得脱氢酶浓度及活性增加;另一方面Fe3+刺激微生物的生长,使微生物量增加,又可进一步增加脱氢酶活性。脱氢酶直接影响生物氧化过程,脱氢酶活性及浓度的增加,会使活性污泥系统的代谢活性增加,从而提高活性污泥系统的处理效果。
3 结论
3.1 Fe3+用量对微生物生长曲线影响实验表明,Fe3+用量在0~50 mg/L范围内,对微生物生长均具有刺激生长作用,Fe3+最佳用量为30 mg/L。
3.2 制浆中段废水浓度由低到高对活性污泥进行驯化,整个驯化过程中,加Fe3+组的CODCr和污染物去除率均高于空白组的,驯化结束后,加Fe3+组和空白组的CODCr去除率分别达到78.2%和76.0%,污染物去除率分别为50.0%和37.7%。
3.3 整个驯化过程中,加Fe3+组脱氢酶活性高于空白组,表明Fe3+的存在可以提高活性污泥中微生物酶的活性,具有刺激微生物生长的作用。
[1]ZHAO Yu-nan.Characteristics and Treatment of Pulping& Papermaking Effluent[J].China Pulp & Paper,2010,29(9):41.赵宇男.制浆造纸废水特性及处理的相关问题[J].中国造纸,2010,29(9):41.
[2]Pokhrel D,Viraraghavan T.Treatment of pulp and paper mill wastewater—a review[J].Science of the Total Environment,2004,333(8):37.
[3]Yitong Zhou,Heng Zhao,Haolong Bai,et al.Papermaking effluent treatment:a new cellulose nanocrystalline/polysulfone composite membrane[J].Procedia Environmental Sciences,2012,16(6):145.
[4]Li Suqin,Zhang Xue.The study of PAFSSB on RO pre-treatment in pulp and paper wastewater[J].Procedia Environmental Sciences,2011,8(3):4.
[5]CHENG Jia-qi,CHEN Yuan-cai,CHEN Hong-lei,et al.Bioaugmentation of Aerobic Granular Sludge with the Preponderant Bacteria Flora for Degradation of Pulping Effluent[J].China Pulp & Paper,2011,30(7):33.成佳琪,陈元彩,陈洪雷,等.优势降解菌群强化好氧颗粒污泥处理制浆废水[J].中国造纸,2011,30(7):33.
[6]SUN You-you,CHEN Yuan-cai,CHEN Hong-lei.Treatment of Pulp and Paper Effluent by the Immobilization of Screened Dominant Bacterial Strains[J].China Pulp & Paper,2011,30(8):39.孙友友,陈元彩,陈洪雷.固定化优势降解菌群处理制浆造纸废水[J].中国造纸,2011,30(8):39.
[7]Khac-Uan Doa,Rajesh J Banu,Dae-Hee Son,et al.Influence of ferrous sulfate on thermochemical sludge disintegration and on performances of wastewater treatment in a new process:Anoxic-oxic membrane bioreactor coupled with sludge disintegration step[J].Biochemical Engineering Journal,2012,66(5):20.
[8]Li Haisong,Wen Yue,Cao Asheng.The influence of additives(Ca2+,Al3+,and Fe3+)on the interaction energyand loosely bound extracellularpolymeric substances(EPS)ofactivated sludgeand their flocculation mechanisms[J].Bioresource Technology,2012,114(11):188.
[9]Lan Hui-xia,Liu Xiao-feng,Wang Le-le,et al.Effect of potassium ferrate on growth of microorganisms and physicochemical characters of sludge[J].China Environmental Science,2011,31(8):1285.蓝惠霞,刘晓凤,王乐乐,等.高铁酸钾对微生物生长及污泥理化特性的影响[J].中国环境科学,2011,31(8):1285.
[10]Jiang Shao-jie,Liu Zong-yuan.The Meaning of UV254 as an Organic Matter Monitoring Parameter in Water Supply&Wastewater Treatment[J].Journal of Chongqing Jianzhu University,2002,24(2):61.蒋绍阶,刘宗源.UV254作为水处理中有机物控制指标的意义[J].重庆建筑大学学报,2002,24(2):61.
[11]Zhu Nanwen,Min Hang,Chen Meici.The study of determination on ttc—dehydrogenase activity[J].China Methane,1996,14(2):3.
[12]Zaruhi Vardanyan,Armen Tchounian.Fe(iii)and Fe(ii)ions different effects on Enterococcus hirae cell growth and membrane-associated atpase activity[J].Biochemical and Biophysical Research Communications,2012,417(6):541.
[13]Hu Z Q,Chandran K,Grasso D,et al.Effect of nickel and cadmium speciation on nitrification inhibition[J].Environ.Sci.Technol.,2002,36(7):3074.
[14]Qi Zhou,Shinji Takenaka,Shuichiro Murakami,et al.Screening and characterization of bacteria that can utilize ammonium and nitrate ions simultaneously under controlled cultural conditions[J].Journal of Bioscience and Bioengineering,2007,103(2):185.
[15]Tim Urich,Anja Kroke,Christian Bauer,et al.Identification of core active site residues of the sulfur oxygenase reductase from Acidianus ambivalens by site-directed mutagenesis[J].FEMS Microbiology Letters,2005,248(2):171.
[16]Daniela Buongiorno,Grit D Straganz.Structure and function of atypically coordinated enzymatic mononuclear non-heme-Fe(II)centers[J].Coordination Chemistry Reviews,2013,257(2):541.CPP

