不同毒性Mtb菌株对Ⅰ型干扰素基因的诱导作用及其在结核病患者外周血中的表达
詹森林 张国良 钟红剑 金晓菲 林巧 张明霞 陈心春 周伯平
·论著·
不同毒性Mtb菌株对Ⅰ型干扰素基因的诱导作用及其在结核病患者外周血中的表达
詹森林 张国良 钟红剑 金晓菲 林巧 张明霞 陈心春 周伯平
目的 研究不同Mtb菌株对Ⅰ型干扰素基因的诱导作用及其在结核病患者外周血中的表达。 方法 从2012年2月至2012年8月在深圳市第三人民医院健康体检者中利用随机数字表法抽取30名健康人外周血标本,并提取单个核细胞中分选出CD14+细胞,用重组人巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)刺激,诱导分化为人巨噬细胞,并分别感染Mtb减毒株H37Ra和Mtb标准株H37Rv,应用实时定量PCR(real-time PCR)检测2种菌株感染后Ⅰ型干扰素基因IFNB和IFNA的相对表达量2-ΔΔCt值。此外使用上述方法对同期选取的结核病组(15例)、健康对照组(15例)、Mtb潜伏感染组(15例)的Ⅰ型干扰素基因的相对表达量进行检测。采用GraphPad 4.0软件对数据进行统计处理,两组均数间比较采用t检验,三组均数间比较采用方差分析,以P<0.05为差异有统计学意义。结果 经H37Rv感染的健康人巨噬细胞的IFNB基因相对表达量2-ΔΔCt值(10.38±2.24)显著高于空白对照组(6.26±3.42),差异有统计学意义(t=2.47,P=0.026);经H37Ra感染的巨噬细胞的IFNB基因相对表达量2-ΔΔCt值(8.92±0.85)与空白对照组(6.26±3.42)比较差异无统计学意义(t=1.84,P=0.09);IFNA相对基因表达量2-ΔΔCt值在H37Rv感染组(5.11±2.31)、H37Ra感染组(5.17±3.40)及空白对照组(4.41±1.69)之间差异无统计学意义(F=0.16,P=0.85)。结核病组IFNB基因表达(4.32±1.22)显著高于健康对照组(2.73±1.23),差异有统计学意义(t=3.55,P=0.0014);IFNA基因在健康对照组(3.91±0.75)、Mtb潜伏感染组(4.25±1.03)、结核病组(4.73±1.44)之间表达差异无统计学意义(F=1.93,P=0.064)。结论 Mtb的感染可以诱导Ⅰ型干扰素基因的表达,在结核病患者中IFNB基因表达上调显著。
结核; 干扰素Ⅰ型 ; 基因表达
结核病是由Mtb感染引起的一种慢性传染病。目前全世界已有约20亿人感染了Mtb,每年大约有200~300万例结核病患者死亡[1]。而且,大多数人感染Mtb后都是终生持续的感染,目前Mtb影响宿主免疫信号通路的机制尚不完全清楚。
既往发现Ⅱ型干扰素[干扰素-γ(interferon-γ,IFN-γ)]与Mtb感染关系密切,并且已有用于临床诊断的Mtb IFN-γ酶联免疫斑点检测试剂盒。而对Ⅰ型干扰素在Mtb感染中的作用研究很少,Ⅰ型干扰素主要包括IFN-α、IFN-β、IFN-ω等,IFN-α和IFN-β,是典型的Ⅰ型干扰素。此类干扰素是一类具有抗病毒活性、抗细胞增殖和免疫调节作用的蛋白。近年越来越多的研究人员发现,Ⅰ型干扰素与细菌感染也有一定的关系。Stanley等[2]在小鼠试验中发现Ⅰ型干扰素对于感染Mtb的应答是通过早期分泌性抗原靶-6(early secreting antigenic target-6,ESAT-6)分泌系统-1(secretion system-1)介导分泌的,而ESX-1分泌系统是Mtb毒力的主要决定因素。Remoli等[3]在其体外试验研究中发现,Mtb可以诱导人树突状细胞选择性表达Ⅰ型干扰素基因。
由于目前对于结核病诊断缺乏既快速又敏感的方法,笔者基于国外文献报道Mtb可以对Ⅰ型干扰素产生影响的基础上,以标准有毒株H37Rv和弱毒株H37Ra刺激健康人巨噬细胞,观察Ⅰ型干扰素基因IFNA和IFNB表达情况。同时在不同人群中检测Ⅰ型干扰素基因表达是否有差异,寻找潜在的结核病诊断分子标识。
资料和方法
一、研究对象和材料来源
(一)研究对象
1.结核病组: 2012年2月至2012年8月在深圳市第三人民医院接受治疗的初治痰培养阳性的近1000例结核病患者标本库中用随机数字表法随机抽取15例,年龄在18周岁以上;诊断标准参照2001年版《肺结核诊断和治疗指南》[4],诊断依据包括临床表现、细菌学检查、放射学检查及对抗结核药物治疗效果。
2.健康对照组(healthy controls,HC):同时期深圳市第三人民医院健康体检人员标本库中采取上述方法选取15名,纳入和排除标准为:年龄在18周岁以上;Mtb特异性IFN-γ 固相酶联免疫斑点技术(ELISPOT)检测阴性;无结核病临床表现;未合并其他传染病、慢性疾病及自身免疫疾病。
3.Mtb潜伏感染(latent Mtb infection,LTBI)组:在同时期深圳市第三人民医院健康体检时发现潜伏感染人员中采用随机数字表法随机选取15例。纳入和排除标准为:采用深圳市达科为生物公司外周血IFN-γ检测试剂盒用ELISPOT法所得斑点数量阳性(即反应孔中斑点数减去背景孔中斑点数后斑点数>30),同时TB-PPD试验硬结直径≥10 mm,X线胸片检查正常并且没有临床症状的患者,未合并其他传染病、慢性疾病及自身免疫疾病。
结核病组男8例,女7例,平均年龄(25.36±5.15)岁。潜伏感染组男7例,女8例,平均年龄(26.89±5.19)岁。健康对照组男8例,女7例,年龄18~50岁,平均(25.67±4.23)岁。三组在性别、年龄上差异无统计学意义(性别统计用卡方检验,χ2=0.18,P=0.91;年龄统计用方差分析,F=0.13,P=0.89)。
4.其他:此外采取上述方法在同时期深圳市第三人民医院健康体检人员中选取30名健康体检者标本,用于诱导分化人巨噬细胞,其中男18例,女12例,年龄在18周岁以上,平均年龄(28.42±6.20)岁。本研究经深圳市第三人民医院伦理委员会批准,所有入组研究对象均签署知情同意书。
(二)主要仪器和试剂来源
RNA抽提试剂盒RNeasy购自德国Qiagen公司;反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Erase和SYBR Green Ⅰ实时定量 PCR试剂盒均购自日本TaKaRa公司;Nanodrop紫外分光光度计为美国Agilent公司产品;7500实时荧光定量PCR仪为美国ABI公司产品;CD14抗体和MACS(magnetic activated cell sorting)磁珠分选仪为德国美天旎生物技术有限公司产品;Mtb减毒株H37Ra (美国模式菌种收藏中心,25177)、Mtb标准株H37Rv(美国模式菌种收藏中心,25618)标准菌株均由本实验室(深圳市第三人民医院肝病研究所)保存并提供;温箱为美国Thermo公司产品;离心机为美国Beckman公司产品,型号Allegra@X-12R。
二、试验方法
1.外周血单个核细胞(PBMCs)的分离:使用肝素锂抗凝管采集结核病组、Mtb潜伏感染组和健康对照组空腹的外周血5 ml,和30名健康人空腹的外周血20 ml,磷酸盐缓冲液(PBS,pH值7.4)进行等倍稀释混匀,缓慢铺在淋巴细胞分离液,室温800×g离心20 min后让离心机自然缓慢停止转动,用毛细吸管轻轻插到混浊带,沿管壁轻轻吸出此层细胞,使用PBS洗涤后离心,即获得PBMCs。
2.诱导分化人巨噬细胞,并用H37Ra或H37Rv菌株感染:健康人30名外周血PBMCs细胞使用CD14免疫磁珠分选单核细胞,加入重组人巨噬细胞集落刺激因子(M-CSF)10 ng/ml刺激,用RPMI(roswell park memorial institute)-1640完全培养基37 ℃温箱中培养,第0、2、4天换液。第7天,加H37Rv、H37Ra[感染复数(MOI): 5][5]感染6 h后收细胞,立即提取RNA,进行下一步操作。并以不加Mtb感染的分化巨噬细胞作为空白对照(Blank)。
3.总RNA提取及引物设计:采用 RNeasy试剂盒提取PBMCs/巨噬细胞总RNA,用Nanodrop紫外分光光度计测定RNA纯度和浓度。根据NCBI数据库人类IFNA和IFNB基因的c-DNA序列,使用Primer Express 2.0软件设计扩增引物,IFNA上游引物:5′-GTGAGGAAATACTTCCAAAGAATCAC-3′,下游引物:5′-TCTCATGATTTCTGCTCTGACAA-3′ (92 bp);IFNB上游引物:5′-GTCTCCTCCAAATTGCTCTC-3′,下游引物:5′-ACAGGAGCTTCTGACACTGA-3′ (113 bp)。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参基因,上游引物:5′-ACAGTCCATGCCATCACTGCC-3′,下游引物:5′-GCCTGCTTCACCACCTTCTTG-3′ (245 bp)。
4. 逆转录和SYBR Green实时定量PCR检测IFNA和IFNB水平: 取7 μl总RNA,用TaKaRa的PrimeScriptTMRT reagent Kit with gDNA Erase 试剂盒反转录为cDNA。利用SYBR Green Ⅰ实时定量 PCR试剂盒,使用IFNA和IFNB基因特异性扩增引物进行PCR反应,体系如下:2×SYBR Premix Ex Taq 10 μl,上、下游引物各0.8 μl,ROX Reference Dye Ⅱ 0.4 μl, cDNA模板2 μl,加双蒸水至20 μl。反应条件:95 ℃ 30 s,随后95 ℃ 5 s,60 ℃ 34 s,共40个循环。通过SBS 1.5软件分析样本阈值循环(cycle threshold,Ct)值,由于样本间存在不一致因素,通过内参基因Ct值进行标准化,最终以2-ΔΔCt值表示IFNA和IFNB拷贝数。
5.统计学分析:数据分析前均用Bartlett检验方差齐性,P>0.05,认为方差齐,计量资料用“均数±标准差”表示。三组均数之间比较采用方差分析,两组均数间比较采用t检验。以P<0.05为差异有统计学意义。采用GraphPad 4.0软件对数据进行统计处理。
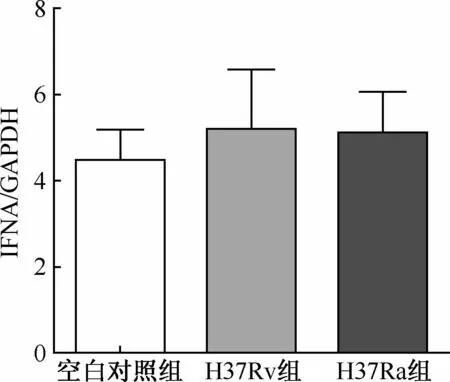
GAPDH:甘油醛-3-磷酸脱氢酶;“IFNA/GAPDH”为“IFNA基因相对表达量2-ΔΔCt值”(相对表达量是与参照对象GAPDH内参基因相对比的)图1 H37Ra或H37Rv菌株感染健康人巨噬细胞后IFNA表达水平的变化
结 果
1. H37Ra或H37Rv菌株感染健康人巨噬细胞后IFNA和IFNB基因表达水平的变化: Real-time PCR结果显示,30名健康人巨噬细胞经H37Ra或H37Rv菌株感染后,三组间IFNA基因相对表达量2-ΔΔCt值分别为空白对照组(4.41±1.69)、H37Ra组(5.17±3.40)、H37Rv组(5.11±2.31),IFNA基因相对表达量在用H37Ra或H37Rv菌株感染前后三组之间差异无统计学意义(F=0.16,P=0.85,图1)。IFNB基因相对表达量经H37Rv菌株感染后表达上调(10.38±2.24),显著高于空白对照组(6.26±3.42),差异具有统计学意义(t=2.47,P=0.026),H37Ra感染组与空白对照组之间比较(8.92±0.85和6.26±3.42)差异无统计学意义(t=1.84,P=0.09,图2)。

GAPDH:甘油醛-3-磷酸脱氢酶;“IFNA/GAPDH”为“IFNA基因相对表达量2-ΔΔCt值”(相对表达量是与参照对象GAPDH内参基因相对比的)图2 H37Ra或H37Rv菌株感染健康人巨噬细胞后IFNB表达水平的变化
2.三组人群中IFNA和IFNB基因的表达情况:三组人群间IFNA基因表达差异无统计学意义(F=1.94,P=0.16,图3)。结核病患者IFNB基因表达量2-ΔΔCt值为(4.32±1.22)显著高于健康对照组表达水平的(2.73±1.23),差异具有统计学意义(t=3.55,P=0.0014,图4),与Mtb潜伏感染组(3.49±1.04)比较差异无统计学意义(t=1.97,P=0.06)。
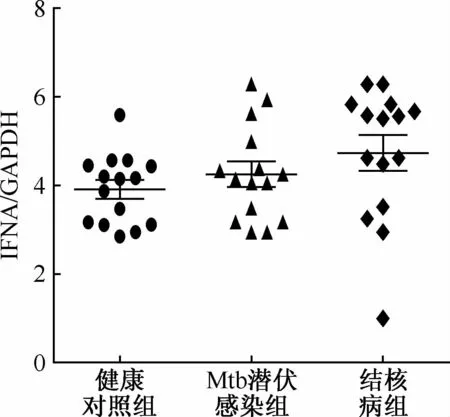
GAPDH:甘油醛-3-磷酸脱氢酶;“IFNA/GAPDH”为“IFNA基因相对表达量2-ΔΔCt值”(相对表达量是与参照对象GAPDH内参基因相对比的)图3 三组人群PBMCs中IFNA基因的相对表达量
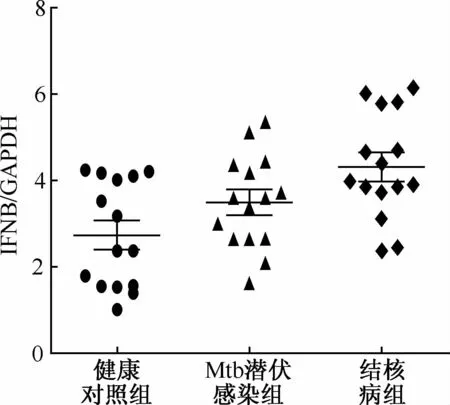
GAPDH:甘油醛-3-磷酸脱氢酶;“IFNA/GAPDH”为“IFNA基因相对表达量2-ΔΔCt值”(相对表达量是与参照对象GAPDH内参基因相对比的)图4 三组人群PBMCs中IFNB基因的相对表达量
讨 论
结核病的诊断是一个世界性的难题,许多研究者致力于寻找新的Mtb分子诊断标识,但目前被广泛应用于临床的分子标识仍然是IFN-γ,同时作为干扰素家族,Ⅰ型干扰素在结核病方面的诊断价值尚未评估。笔者发现H37Rv可以诱导IFNB基因表达上调,所以笔者进一步对结核病患者、健康人和Mtb潜伏感染者三组人群Ⅰ型干扰素基因的表达情况进行了对比分析,结果表明,结核病患者组IFNB基因表达水平显著高于健康人群,且差异有统计学意义。这与Nature杂志的报道结果一致:Berry等[6]的课题组用基因芯片鉴定出中性粒细胞来源的与IFN信号通路相关的86个基因标志物用于活动性结核病的诊断,提示结核病的发生、发展与IFN通路密切相关,这其中包括有Ⅰ型干扰素基因。
本研究结果显示,Mtb标准株H37Rv和弱毒株H37Ra均能引起IFNB基因表达显著上调,其中H37Rv感染组IFNB基因含量显著高于空白对照组,且差异具有统计学意义。H37Ra感染组和H37Rv感染组IFNB基因含量有差别,但差异无统计学意义。H37Rv和H37Ra两者之间主要在于毒力上的差别,而毒力很大程度上与毒力相关蛋白有关,蛋白的表达与否取决于基因及其调控基因。H37Rv在减毒为H37Ra的过程中,胞外蛋白有11种蛋白含量降低、3种蛋白含量增加和3种蛋白不表达[7]。这两种菌株在感染巨噬细胞后诱导宿主细胞产生不同的转归:H37Rv能够抑制细胞凋亡,在胞内存活、繁殖、扩散,导致细胞坏死,从而引发炎症反应、细菌扩散;而H37Ra能诱导宿主细胞产生大量凋亡[8]。导致Ⅰ型干扰素基因表达差异是由于菌株的哪一种蛋白引起的,目前还不清楚。
综上所述,Mtb的感染可引起 IFNB基因的表达,且与Mtb菌株的毒力有一定的关联,毒力不同的菌株IFNB基因的表达量有所不同,但是差异无统计学意义。对不同人群的比较研究发现,IFNB基因表达在结核病患者中的表达水平要高于正常人群,具有潜在的诊断价值。但目前还没有经大样本评估,具体特异度与敏感度如何尚不明确。另外,本研究未探讨不同毒力的Mtb菌株对Ⅰ型干扰素基因表达的影响机制,需进一步研究。
[1] World Health Organization. WHO Global tuberculosis control-surveillance, planning, financing. Geneva: World Health Organization, 2008.
[2] Stanley SA, Johndrow JE, Manzanillo P, et al. The typeⅠIFN response to infection with Mycobacterium tuberculosis requires ESX-1-mediated secretion and contributes to pathogenesis. J Immunol, 2007, 178(5): 3143-3152.
[3] Remoli ME, Giacomini E, Lutfalla G, et al. Selective expression of type Ⅰ IFN genes in human dendritic cells infected with Mycobacterium tuberculosis. J Immunol, 2002,169(1): 366-374.
[4] 中华医学会结核病学分会. 肺结核诊断和治疗指南.中华结核和呼吸杂志,2001,24(2):70-74.
[5] Novikov A, Cardone M, Thompson, R,et al. Mycobacterium tuberculosis triggers host type Ⅰ IFN signaling to regulate IL-1β production in human macrophages. J Immunol, 2011, 187(5): 2540-2547.
[6] Berry MP, Graham CM, McNab FW, et al. An interferon-inducible neutrophil-driven blood transcriptional signature in human tuberculosis. Nature, 2010,466(7309): 973-977.
[7] Målen H, De Souza GA, Pathak S, et al. Comparison of membrane proteins of Mycobacterium tuberculosis H37Rv and H37Ra strains. BMC Microbiol,2011,11:18.
[8] Sohn H, Lee KS, Kim SY, et al. Induction of cell death in human macrophages by a highly virulent Korean Isolate of Mycobacterium tuberculosis and the virulent strain H37Rv. Scand J Immunol,2009, 69(1):43-50.
(本文编辑:薛爱华)
The induction of type Ⅰ interferon by differentM.tuberculosisstrains and its expression in the peripheral blood of the patients with tuberculosis
ZHAN Sen-lin*, ZHANG Guo-liang, ZHONG Hong-jian, JIN Xiao-fei, LIN Qiao, ZHANG Ming-xia, CHEN Xin-chun, ZHOU Bo-ping.
*Guangdong Key Laboratory for Emerging Infectious Disease, the Affiliated Shenzhen Third Hospital,Guangdong Medical College, Shenzhen 518112,China
Corresponding author: ZHOU Bo-ping, Email:zhoubp@hotmail.com
Objective To study the induction of type I interferon (IFN) by different M. tuberculosis (Mtb) strains and its expression in the peripheral blood of the patients with tuberculosis. Methods CD14+cells were isolated from the peripheral blood mononuclear cells of 30 healthy people from Feb 2012 to Aug 2012, and were stimulated by the recombinant human macrophage colony stimulating factor (M-CFS) for 7 days, and differentiated into human macrophages. These macrophages were infected with Mtb strains H37Ra and H37Rv, respectively. The expression levels of type Ⅰ IFN genes IFNB and IFNA in the macrophages were detected with real-time PCR assay. We also observed the gene expression of type Ⅰ IFN in different population (15 healthy controls, 15 persons with latent Mtb infection and 15 patients with tuberculosis). Using GraphPad 4.0 software for statistical analysis,P<0.05 was considered statistically significant. Results After Mtb H37Rv infection, IFNB gene expression in human macrophages was significantly higher than that in the control group (10.38±2.24 vs 6.26±3.42;t=2.47,P=0.026). There were no significant differences in IFNB gene expression between Mtb H37Ra infection group and control group (8.92±0.85 vs 6.26±3.42;t=1.84,P=0.09). There were no significant differences in IFNA gene expression among Mtb H37Rv infection group, H37Ra infection group and control group (5.11±2.31 vs 5.17±3.40 vs 4.41±1.69;F=0.16,P=0.85). The IFNB gene expressions in TB patients (4.32±1.22) were significantly higher than that in healthy controls (2.73±1.23;t=3.55,P=0.0014). There were no significant differences in IFNA gene expression among healthy controls, the persons with latent Mtb infection and the patients with tuberculosis (3.91±0.75 vs 4.25±1.03 vs 4.73±1.44;F=1.93,P=0.064). Conclusion Virulent Mycobacterium tuberculosis infection can induce type Ⅰ IFN gene expression. Up-regulated expression of IFNB gene can be used as a potential molecular marker in the diagnosis of tuberculosis.
Tuberculosis; Interferon type Ⅰ; Gene expression
10.3969/j.issn.1000-6621.2015.01.008
国家自然科学基金(81172732,81341128);广东省自然科学基金(S2012040007213);深圳市科技计划项目(201202189);深圳市科技计划基础研究项目(JCYJ20140411111718166)
518112 广东医学院附属深圳市第三人民医院 广东省新发传染病诊治重点实验室(詹森林、张国良、金晓菲、张明霞、陈心春、周伯平);深圳市宝安区慢性病防治院结核科(钟红剑、林巧)
周伯平,Email:zhoubp@hotmail.com
2014-10-28)

