人工设计二硫键增强谷氨酰胺转胺酶热稳定性
刘中美, 杜 坤, 周哲敏
(江南大学 生物工程学院,江苏 无锡 214122)
谷氨酰胺转胺酶(Transglutaminase,TGase,EC 2.3.2.13)是一种能够催化酰基转移反应的酶。它可以催化谷氨酰胺残基的γ-羧酰胺基与各种酰基受体发生反应,实现蛋白质分子内、分子间交联,从而极大地改变蛋白质的性质[1]。TGase广泛应用于食品行业、生物医药、组织工程、纺织和皮革处理等多个领域[2-3]。由于TGase的卓越催化功能而倍受越来越多的研究者的青睐,它被誉为 “21世纪超级粘合剂”。
对TGase的研究可以追溯到50年前,美国生物化学家Heinrich Waelsch在人脑和肝脏提取物中首次发现具有酰胺基转移催化功能的TGase酶[3]。微生物来源的 TGases (Microbial TGase,MTG)是1989年日本味之素公司首次发现的,由土壤中分离出的茂原链霉菌(Streptomyces mobaraense)产生[4]。与其它来源的TGase相比,MTG具有非Ca2+依赖性、温度和pH稳定性高等特点[5-6]。此外,MTG生产周期短、产量高、成本低,易于工业化生产。S.mobaraense来源的MTG一级氨基酸序列于1993年被测定[7],由331个氨基酸组成,与动物来源的TGase相比,二者序列相似度低。S.mobaraense MTG的晶体结构于2002年被解析,二级结构属于α+β型,含11个α-螺旋及8个β-折叠;催化活性基团Cys64、Asp255和His274均位于分子裂缝底部[8]。
目前,微生物来源的MTG已经实现了商品化(ActivaTM),ActivaTM中每克粉末中含有100个单位的酶活,但是其中只有体积分数1%的蛋白,体积分数99%的是麦芽糖糊精。麦芽糖糊精的作用是增强MTG的稳定性和使产品易于操作[9],因为酶的热稳定性越好,在应用过程中可耐受的操作温度越高,反应速率越快,成本也就越低。德国马丁路德大学的Pietzsch研究组利用随机突变和饱和突变等技术,提高了S.mobaraense来源的MTG的热稳定性。研究结果表明,影响MTG热稳定性的突变点大都集中在MTG的N端区域[10]。
作者参考Pietzsch研究组的实验结果,采用理性设计手段,通过分子生物学技术、结构分析软件、分子模拟等手段对Streptomyces hygroscopicus来源的MTG进行分子改造。通过结构比对和序列分析,并借助二硫键预测软件Disulfide by design,在MTG的N端区域引入二硫键,使MTG的热稳定性得到提高,进一步促进其工业化应用。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 质粒pET22b-pro-MTG、E.coli BL21(DE3)和E.coli JM109为本实验室保存。
1.1.2 试剂与仪器 N-carboxybenzoyl-L-glutaminyl-glycine (N-CBZ-Gln-GLy)、L-谷氨酸-γ-单羟胺酸购自Sigma公司;中性蛋白酶Dispase:购自Worthington公司,PCR引物:生工生物工程(上海)股份有限公司合成。
紫外分光光度计(UV-1800):上海美谱达有限公司产品;HiTrap Q HP和HiTrap SP HP:GE公司产品;AKTA avant:GE 公司产品;Millipore 超滤离心管 Ultra-15 3K,默克公司产品。
1.1.3 主要培养基 LB培养基:10 g/L蛋白胨,5 g/L 酵母提取物,10 g/L NaCl,pH 7.0。 TB 培养基:12 g/L蛋白胨,24 g/L酵母提取物,体积分数0.4%甘油,17 mmol/L KH2PO4,72 mmol/L K2HPO4,pH 7.0。
1.2 方法
1.2.1 构建分泌表达载体 pET22b-pro-MTG(4-284)以载体pET22b-pro-MTG[11]为模板,D4C-up和D4C-down为引物,进行全质粒PCR,得到重组质粒pET-pro-MTG (D4C)。 以载体pET-pro-MTG(D4C)为模板,G284C-up和G284C-down为引物,进行全质粒PCR,获得重组质粒pET-pro-MTG(4-284)。引物序列见表1,质粒均经过测序验证。

表1 研究所用引物Table 1 Primers used in this study
1.2.2 重组蛋白酶的诱导表达 将转化子接于含有50 mg/L氨苄青霉素的LB培养基中,37℃过夜培养后转接至TB培养基中 (含有4 g/L葡萄糖和50 mg/L氨苄青霉素),37℃条件下培养至OD600为0.5~0.6,加入IPTG至终浓度为0.4 mmol/L,20℃条件下诱导40 h。
1.2.3 酶原活化与蛋白质纯化 参照报道[12],收集发酵液,并在发酵液中加入终质量浓度为5 mg/L的中性蛋白酶Dispase,37℃保温1 h,活化pro-MTG和 pro-MTG(4-284)。活化完成后,硫铵沉淀法(硫酸铵浓度55%~75%)收集目标蛋白,复溶于10 mmol/L磷酸钾缓冲液(pH 6.0)。
将复溶液经过层析柱HiTrap SP HP分离纯化,用含0.5 mmol/L NaCl的磷酸钾缓冲液(pH 6.0)进行线性洗脱。收集含有目标蛋白的峰,并将收集的样品于25 mmol/L Tris-HCl(pH 8.0)中透析过夜。将透析样品离心取上清,注入HiTrap Q HP离子柱,并用含有0.5 mmol/L NaCl的25 mmol/L Tris-HCl(pH 8.0)溶液进行线性洗脱,收集目标蛋白。用SDS-PAGE凝胶电泳来检测目标蛋白纯度,Brandford法检测蛋白质浓度。
1.2.4 检测蛋白的二硫键含量 参照文献[13],将蛋白MTG和MTG(4-284),分别稀释在含有和不含有还原剂(10 mmol/L DTT)的溶液 A(80 mmol/L磷酸钾缓冲液,质量分数2%SDS,pH 8.0)中,在沸水中煮10 min使蛋白变性。用超滤离心管(Millipore Ultra-15 3K)浓缩蛋白,同时用溶液A洗去DTT,然后取样测蛋白质浓度。测定各样品的吸光度值,计算各样品在有DTT和无DTT存在时,半胱氨酸含量的变化,进而算出二硫键的含量。
1.2.5 酶学性质与热稳定性测定 将重组MTG和MTG(4-284)分别在 37、45、50、55、65 ℃下处理 10 min,然后在冰上冷却30 min。以N-CBZ-Gln-GLy(30 mmol/L)为底物,用比色法测定MTG酶活[11]。一个单位谷氨酰胺转胺酶酶活的定义为:37℃时每分钟催化形成1 μmol L-谷氨酸-γ-单羟基肟酸的酶量。
1.2.6 圆二色谱 用10 mmol/L磷酸钾缓冲液稀释至蛋白质质量浓度为0.2 mg/mL,通过MOS-450/AF-CD分光偏振计分别测定重组MTG和MTG(4-284)的T50值。吸收池宽10 mm,检测波长为222 nm,温度范围为40~80℃。
1.2.7 抗胰蛋白酶降解测试 将纯化后的蛋白样品稀释至0.5 mg/mL并分别加入终浓度为0.1 U/mL的胰蛋白酶。37℃保温3 h,每隔0.5 h取样一次,用SDS-PAGE凝胶电泳检测蛋白的降解程度。
1.2.8 同 源 建 模 通 过 Swiss-Model(http://swissmodel.expasy.org/)对来源于 S.hygroscopicus的MTG进行同源建模,具体方法参见网站上的说明。模板为来源于Streptomyces mobaranesis的MTG(1IU4),两者之间的氨基酸序列同源性为79.2%。利用 PROCHECK (http://nihserver.mbi.ucla.edu/SAVES/)对模型空间结构的准确性进行评估,结果显示所有的氨基酸都是在合理的位置,表明构建的模型准确性较高。
2 结果与讨论
2.1 MTG上二硫键位置的选取及质粒构建
S.mobaraense来源的MTG的N端区域对于MTG的热稳定性起着很关键的作用[10]。S.hygroscopicus和S.mobaraense来源的MTG的序列同源性高达79.2%,因此推断S.hygroscopicus来源的MTG的N端区域对其热稳定性同样重要,在该区域设计二硫键预期可以提高其稳定性。
通过同源建模获得S.hygroscopicus来源的MTG的三维结构图(图1)。选定N端的Loop区作为改造的目标,利用Disulfide by Design软件在目标区域预测二硫键的氨基酸位点,结果显示在D4和G284之间可能形成二硫键。构建突变体质粒pET-pro-MTG(4-284),以检测二硫键对MTG热稳定性的影响。

图1 三维结构图Fig.1 3D structure comparison of MTG
2.2 MTG和MTG(4-284)的表达、活化与纯化
MTG和MTG(4-284)进行胞外表达,经过中性蛋白酶Dispase活化、硫酸铵分级沉淀 (质量分数55%~75%)、阳离子层析和阴离子层析后,获得了纯度较高的MTG和MTG(4-284),SDS-PAGE结果如图2所示。
2.3MTG和MTG(4-284)的二硫键数量测定
二硫键的数量是通过对比MTG和MTG(4-284)在还原性环境(经DTT处理)和非还原性环境(未经DTT处理)下的巯基含量来确定的[13]。结果如表2所示,MTG在经DTT处理前后,其巯基含量基本没有变化。每个MTG内只含有1个巯基,这和已知的蛋白序列只含一个半胱氨酸相一致。MTG(4-284)在经DTT处理后,检测到的巯基含量约是DTT处理前的3倍,这说明经DTT处理后,一个二硫键被打开了,进而释放出了两个巯基。实验结果表明MTG(4-284)内形成了一个二硫键。
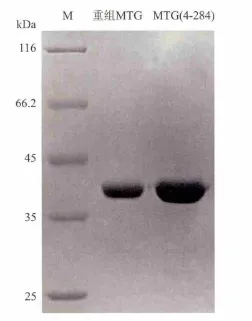
图2 纯化蛋白电泳图Fig.2 SDS-PAGE analysis of the purified proteins

表2 MTG和MTG(4-284)的二硫键数量Table 2 Disulfide numbers of MTG and MTG(4-284)
2.4 MTG和MTG(4-284)的热稳定性比较
将 MTG 和 MTG(4-284)在 37、45、50、55、60 ℃分别下处理10 min,再冰浴30 min,进行酶活检测。如图 3所示,MTG和 MTG(4-284)在 45℃处理 10 min后,酶活基本没有降低,表明在该温度下MTG的热稳定性较好。MTG在50~60℃的环境下酶活随着温度的升高而迅速降低,而MTG(4-284)在55℃下处理10 min后,仍然保留95%的酶活,表明MTG(4-284)的热稳性有了很大的提高。
圆二色谱技术测定MTG和MTG(4-284)的T50分别为 58 和 65℃(图 4),表明 MTG(4-284)的蛋白质在变性和解折叠过程中所需的温度均有所提高,反映出其热稳定性提高了。这与热处理后检测酶活的结果一致。以上结果表明在S.hygroscopicus来源的MTG的N端区域引入二硫键可以提高其热稳定性。
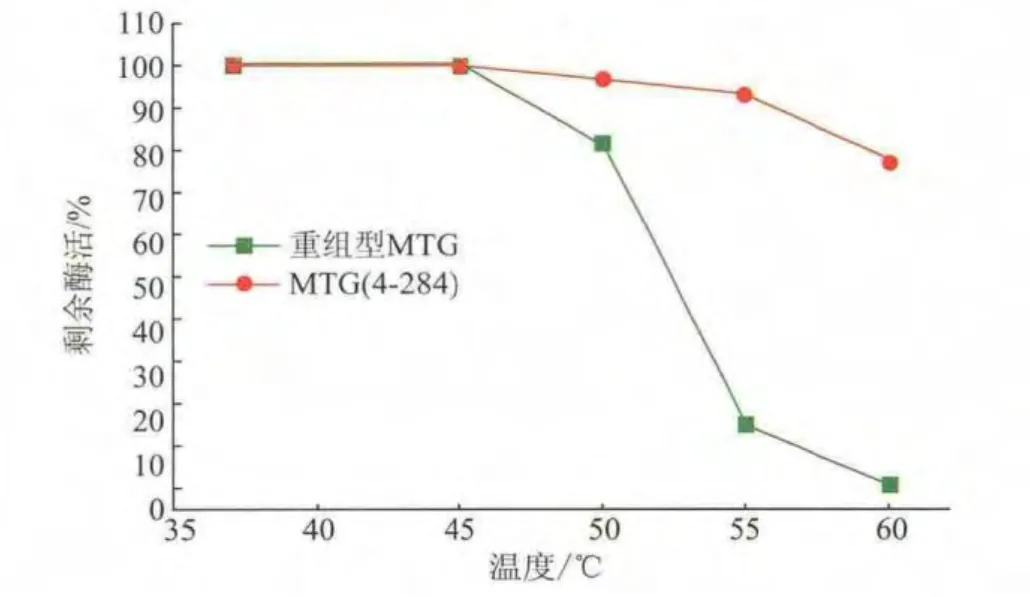
图3 MTG和MTG(4-284)的热稳定性Fig.3 Thermostability of MTG and MTG (4-284)at different temperature
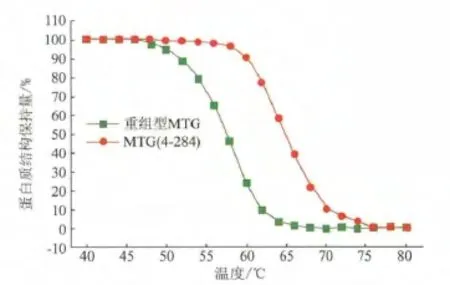
图4 MTG 和 MTG(4-284)的 T50Fig.4 The T50of MTG and MTG(4-284)
2.5 MTG和MTG(4-284)的抗胰蛋白酶降解能力比较
胰蛋白酶经常被用来检测蛋白酶的抗降解能力。从图5中可以看出,MTG在经过3 h的胰蛋白酶处理后,目标条带基本消失,在27 000左右出现一个明显条带。而MTG(4-284)在处理3 h后,依然有着比较明显的条带,下方也没有出现降解的蛋白条带。以上结果显示MTG(4-284)抗胰蛋白酶降解的能力明显增强。
MTG(4-284)热稳性和抗蛋白酶降解的能力都有所提高,进一步表明在N端引入二硫键有效的提高了MTG(4-284)的稳定性。
3.6 MTG和MTG(4-284)的酶学性质比较
MTG(4-284)的比酶活略低于MTG;Km和kcat的结果显示,引入的二硫键使得kcat变化略大,Km值变化很小,表明二硫键的引入基本没有影响酶与底物的结合,而是底物进入活性中心后,酶分子完成催化所需的时间受到了一定的影响;MTG(4-284)在热稳定性提高的同时,最适反应温度也有所提高。
3 结语
作者通过在MTG的N端区域人工设计并引入二硫键,有效提高了其稳定性。圆二色谱检测结果表明二硫键的引入使得其T50由58提高至65℃;酶活力检测结果表明二硫键的引入导致比酶活略有所下降,由13.3 U/mg下降为12.5 U/mg;酶动力学参数表明二硫键的引入没有影响酶与底物的结合过程,而是影响了底物进入活性中心后的催化过程。作者研究结果表明S.hygroscopicus来源的MTG的N端区域对于其稳定性重要影响,而该区域相对远离活性中心,也比较适合进行分子改造。
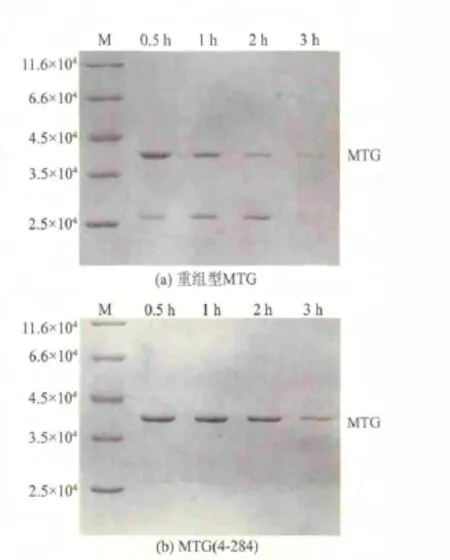
图5 MTG(a)和MTG(4-284)(b)抗胰蛋白酶降解比较Fig.5 Trypsin-resistance of MTG(a)and MTG(4-284)(b)
[1]Yokoyama K,Nio N,Kikuchi Y.Properties and applications of microbial transglutaminase[J].Appl Microbiol Biotechnol,2004,64(4):447-454.
[2]Santos M,Torne J M.Recent patents on transglutaminase production and applications:a brief review[J].Recent Pat Biotechnol,2009,3(3):166-174.
[3]Beninati S,Bergamini C M,Piacentini M.An overview of the first 50 years of transglutaminase research[J].Amino Acids,2009,36(4):591-598.
[4]Ando H,Adachi M,Umeda K,et al.Purification and characteristics of a novel transglutaminase derived from microorganisms[J].Agric Biol Chem,1989,53(10):2613-2617.
[5]Yokoyama K,Utsumi H,Nakamura T,et al.Screening for improved activity of a transglutaminase from Streptomyces mobaraensis created by a novel rational mutagenesis and random mutagenesis[J].Appl Microbiol Biotechnol,2010,87(6):2087-2096.
[6]Heck T,Faccio G,Richter M,et al.Enzyme-catalyzed protein crosslinking[J].Appl Microbiol Biotechnol,2013,97 (2):461-475.
[7]Kanaji T,Ozaki H,Takao T,et al.Primary structure of microbial transglutaminase from Streptoverticillium sp.strain s-8112[J].J Biol Chem,1993,268(16):11565-11572.
[8]Kashiwagi T,Yokoyama K,Ishikawa K,et al.Crystal structure of microbial transglutaminase from Streptoverticillium mobaraense[J].J Biol Chem,2002,277(46):44252-44260.
[9]Sommer C,Hertel T C,Schmelzer C E,et al.Investigations on the activation of recombinant microbial pro-transglutaminase:in contrast to proteinase K,dispase removes the histidine-tag[J].Amino Acids,2012,42(2-3):997-1006.
[10]Mark C K,Hertel T C,Pietzsch M.Random mutagenesis of a recombinant microbial transglutaminase for the generation of thermostable and heat-sensitive variants[J].J Biotechnol,2008,136(3-4):156-162.
[11]杜坤,周丽,堵国成,等.内含肽介导谷氨酰胺转胺酶酶原的活化[J].食品科学,2013,34(9):90-94.DU Kun,ZHOU Li,DU Guocheng,et al.Intein-mediated activation of transglutaminase from Streptomyces hygroscopicus[J].Food Science,2013,34(9):90-94.(in Chinese)
[12]LIU S,ZHANG D,WANG M,et al.The pro-region of Streptomyces hygroscopicus transglutaminase affects its secretion by Escherichia coli[J].FEMS Microbiol Lett,2011,324(2):98-105.
[13]Jeong M Y,Kim S,Yun C W,et al.Engineering a de novo internal disulfide bridge to improve the thermal stability of xylanase from Bacillus stearothermophilus No.236[J].J Biotechnol,2007,127(2):300-309.

