CyclinD1基因过表达慢病毒载体的构建和对神经干细胞增殖的影响
马俊芳,崔博,沈东超,崔丽英,2
CyclinD1基因过表达慢病毒载体的构建和对神经干细胞增殖的影响
马俊芳1,3,崔博1,沈东超1,崔丽英1,2
目的:针对小鼠cyclinD1基因构建质粒并进行慢病毒包装,转染小鼠神经干细胞,检测其表达水平。方法:根据cyclinD1基因信息,采用DNA重组技术将Nestin promoter-Ccnd1基因插入plenti6慢病毒表达载体,重组获得慢病毒载体plenti-D1;经测序鉴定后,转染293T细胞生产病毒液,并检测病毒滴度。设立空白对照组、阴性病毒对照组及过表达慢病毒感染组。将病毒转染小鼠胚胎神经干细胞,经实时荧光定量PCR和western blot法分析转染前后3组cyclinD1表达情况,MTT法检测不同MOI值对神经干细胞增殖的影响。结果:测序结果证实cyclinD1基因正确插入载体中,成功构建小鼠cyclinD1基因过表达载体。实时荧光定量PCR结果显示过表达慢病毒感染组cyclinD1 mRNA较其他2组明显升高;Western Blot鉴定cyclinD1蛋白表达成功。plenti-D1的MOI值为10、20、50时均明显促进神经干细胞增殖。结论:cyclinD1基因慢病毒表达载体能感染小鼠胚胎神经干细胞,外源基因稳定表达。cyclinD1基因过表达能促进神经干细胞的增殖。
cyclinD1;过表达;神经干细胞;细胞周期
Cyclin D1是细胞周期调控蛋白,通过与CDK4或CDK6形成复合物,调节细胞向S期的转变。cyclinD1有独立于CDK的调节转录功能[1],cyclinD1在许多神经分化模型中都表达增高[2],但具体作用不清。笔者前期研究显示,cyclinD基因敲除对神经干细胞向神经元分化没有明显影响,但显著抑制了其向星形胶质细胞分化[3]。本研究拟构建由神经干细胞的特异性启动子--Nestin驱动的cyclin D1重组慢病毒,探讨cyclin D1基因转染对神经干细胞增殖的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物出生24 h的C57BL/6小鼠购自维通利华。
1.1.2 试剂胎牛血清、Neurobasal培养液、B27无血清添加剂、DMEM培养液、Opti-MEM培养液,均购自Gibco公司;表皮生长因子(epiderinal growth factor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)均购自Peprotech公司;四甲基噻唑兰(methyl thiazolyl tetrazolium,MTT)购自sigma公司;慢病毒质粒pLenti6、包装质粒pLP1、pLP2、pLP/VSVG(Life)均购自Invitrogen公司;DNA纯化试剂盒购自Axygen公司。引物由上海生工公司合成。鼠抗cyclinD1抗体购自sigma公司,辣根过氧化物酶标记的羊抗鼠多克隆抗体购自中杉公司。
1.2 方法
1.2.1 神经干细胞的原代培养、传代原代培养:出生24 h内的C57BL/6小鼠,无菌法取脑,剔除脑膜和血管,取海马和室管膜下区脑组织,加入无血清培养液,吹打至混浊,1 000 rpm离心5 min后去上清,加入无血清培养液制成细胞悬液。按106个/mL密度接种于培养瓶,37℃,饱和湿度,5%CO2,95%空气(所有细胞培养条件与此相同)饱和培养箱中培养。第2天见小神经球形成,球体积逐渐增大,以后每3天半量换液,神经球变大后每7天传代1次。传代培养:将含有较大神经球的细胞悬液吸取置于无菌离心管中;1 000 rpm离心5 min,弃掉大部分旧培养基,轻轻吹打至细胞悬液变混浊,加入无血清培养液,分置2个培养瓶中,调整密度为105~106个/mL,继续培养。
1.2.2 针对小鼠cyclinD1的过表达慢病毒载体的构建根据Nestin promoter-Ccnd1的基因信息,通过化学合成的oligo以PCR的方法拼接成所需的序列。将目的序列(Nestin promoter-Ccnd1)与IRES2-EGFP融合后与pDONR221载体进行BP重组得到入门载体,然后将入门载体与和慢病毒表达的目的载体pLenti6/BLOCK_iT-DEST进行LR重组反应,以获得目的片断的高表达慢病毒表达载体。根据Nestin promoter-Ccnd1和IRES2-EGFP序列设计合成PCR引物,Nestin上游引物5’端加ATTB1重组臂序列,EGFP下游引物5’端加ATTB2重组臂序列,引物序列如下:Ccnd1上游引物:5-GGGGACAAGTTTGTACAAAAAAGCAGGCTTCATCCTCCGCTTCCG-3,Ccnd1下游引物:5-ACCGGCCTTATTCCAAGCGGCTTCGGCCAGTAACGTTAGG-3,A T T B 2-E G F P:5-G GGG ACCA CTTTGT ACAAGA AAGCTGG GTCTTACTTGTACAGCTCGTCCATGCCGAGAGTG-3,IRES2-1F:5-GCCCCTCTCCCTCCCCCCCCCCTAAC-3,Nestin promoter-R:5-CCCTTGCTCACCATGGTGGCGGGTCAGGTAGGCCTCCAGGCGTCG-3,EGFP-F:5-ACGCCTGGAGGCCTACCTGACCCGCCACCATGGTGAGCAAGGGCGAGGAG-3。
1.2.3 慢病毒的包装培养293T细胞株作为包装细胞,在脂质体介导下将2 μg plenti6重组质粒与10 μg慢病毒包装质粒混合物转染293T细胞。转染36 h和48 h后收集上清液,将含有慢病毒颗粒的上清离心,并用孔径为0.45 μm的PVDF滤膜过滤,超速离心,将待测的各病毒储藏液按梯度稀释分组后转染293T细胞,结合PCR测定病毒滴度。
1.2.4 慢病毒载体的有效性验证培养神经干细胞至汇合度70%~75%时,行慢病毒感染。分为空白对照组、阴性病毒对照组和过表达慢病毒感染组;慢病毒感染细胞后24 h离心,去病毒液,加入正常培养基培养72 h收集细胞RNA和总蛋白,PCR和Western Blot分别检测mRNA和蛋白质表达量。
1.2.5 RNA提取和PCR按RNA-Trizol试剂盒操作指南提取RNA。荧光定量PCR检测所用引物序列:CCND1上游引物为:ACCATTCCCTTGACTGCCGA,下游引物为:GGAGGGTGGGTTGGAAATGA;β-actin上游引物为:GTGACGTTGACATCCGTAAAGA,下游引物为:GTAACAGTCCGCCTAGAAGCAC。PCR反应条件:95℃,10 min;40个PCR循环:95℃,15 s;60℃,15 s;60℃,60 s;末段延伸:60℃,5 min。为了建立PCR产物的熔解曲线,扩增反应结束后继续从75℃缓慢加热到95℃,每20 s升高l℃后绘制标准曲线。反应终产物通过凝胶电泳检测PCR扩增产物的条带大小和丰度。
1.2.6 Western Blot将神经干细胞吸去培养基后,用PBS洗1遍,常规提取总蛋白,用SDS-PAGE凝胶进行蛋白电泳再经转膜、封闭、抗体孵育,ECL底物在暗室中曝光胶片,保存数据。扫描照片用软件Image·Quant 5.0进行分析,以光密度值表示各组的蛋白相对表达量,其中空白细胞组的光密度值作为对照。
1.2.7 MTT比色法将神经干细胞机械吹打后按2×104个/cm2的密度接种于96孔培养板中,每孔200 μL,在37℃,5% CO2环境下,3组在镜下观察细胞加入MOI值分别为0、5、10、20、50、100的病毒24 h后,离心去除病毒,加入培养基继续培养72 h后做MTT检测。MTT比色法标准曲线的制作:在96孔培养板中按等比递增的顺序,定量加入正常(37℃,5% CO2)条件下的神经干细胞,按MTT比色法处理后,测定AOD值。以细胞数为横坐标,AOD值为纵坐标,绘制标准曲线。MTT比色法测定细胞活性:在各组终止培养后的96孔培养板中,每孔吸出上清液10 μL,再加入5 mg/mL MTT 10 μL。孵育4 h,小心吸去上清液100 μL,然后加入20%SDS/50%DMF100 μL。孵育6 h后,在Elx800酶标仪上测AOD值。测定波长570 nm,参考波长630 nm。
1.3 统计学处理
2 结果
2.1 慢病毒质粒载体的鉴定结果
Plenti-D1慢病毒质粒载体测序结果表明,重组慢病毒质粒载体的插入序列与设计序列一致,没有碱基缺失或替换等,证明慢病毒质粒构建成功,见图1。
2.2 转染cyclinD1细胞镜下结果
Plenti6载体中带有GFP标记基因,重组慢病毒plenti-D1转染神经干细胞后绿色荧光强度高,细胞生长良好,转染后过表达慢病毒感染组的大部分细胞均有GFP表达,转染效率较高,见图2。
2.3 过表达慢病毒感染组神经干细胞的ccnd1 mRNA表达增强
空白对照组和阴性病毒对照组低表达cyclinD1基因,过表达慢病毒感染组cyclinD1表达水平明显增高,表明cyclinD1慢病毒载体感染可使神经干细胞显著表达ccnd1的mRNA,见图3。
2.4 过表达慢病毒感染组神经干细胞的cyclinD1蛋白表达增加
Western blot检测结果显示,过表达慢病毒感染组较其它2组有更强的cyclinD1的蛋白表达,见图4。
2.5 不同MOI值的病毒对神经干细胞增殖的影响
MTT检测结果显示,MOI值分别为10、20及50时,过表达慢病毒感染组的OD值比其他2组显著增高(P<0.01),说明神经干细胞明显增殖;在MOI值为100时,过表达慢病毒感染组OD值显著低于空白对照组(P<0.01),说明加入神经干细胞增殖受到抑制,考虑为病毒毒性作用。过表达慢病毒感染组内,MOI值为20时OD值较MOI值为10时的OD值增高(P<0.05),MOI值为50时的OD值与MOI值20时的OD值差异无统计学差异(P>0.05),见图5。
3 讨论
由于神经系统及神经干细胞转染的特殊性和难度,本研究选用了慢病毒的经典方法,为了能在神经干细胞中特异性的表达,选择Nestin作为启动子,构建了小鼠cyclinD1基因的过表达慢病毒载体,并包装成为慢病毒颗粒,通过RNA水平和蛋白质水平的双重检测,确认了基因研究工具的有效性。慢病毒载体的主要优点是它能将外源基因整合入非分裂细胞的基因组内,对停止分裂的神经元转基因治疗提供了一个可行的基因传递系统[4,5]。在此基础上,利用慢病毒载体plenti6系统制备了小鼠cyclinD1基因的过表达慢病毒颗粒,并在体外神经干细胞中检测了它们上调基因表达水平的有效性。结果可见,在神经干细胞中,慢病毒颗粒可有效表达完整全长且大小正确的小鼠cyclinD1蛋白,证明了工具的有效性。

图1 载体图谱

图2 GFP标记的重组慢病毒plenti-D1转染神经干细胞
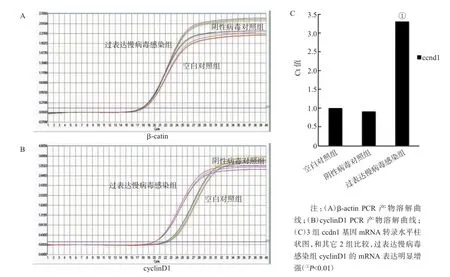
图3 各组神经干细胞ccnd1 mRNA的表达

图4 各组神经干细胞cyclinD1蛋白的表达

图5 不同MOI值的病毒对各组神经干细胞增殖的影响
Cyclin D1是由CCNDI基因编码,全长120 kbp,主要分布在细胞核和胞质中,是重要的细胞周期调控蛋白[6]。在G1后期,cyclinD1已经发现在许多神经分化模型中都表达增高。通过cyclin D1基因敲除鼠,Ma等[3]发现cyclinD1基因敲除对神经干细胞向神经元分化没有明显影响,但显著抑制了其向星形胶质细胞分化。Lange等[7]也发现CDK4/cyclinD1的过度表达能够抑制神经干细胞向神经元分化。
神经干细胞具有持续自我更新和多向分化潜能,能分化为神经元、星形胶质细胞、少突胶质细胞等多种神经组织细胞,而且具有迁移功能和良好的组织融合性和低免疫源性,使其在神经系统损伤修复和神经系统退行性病变的细胞替代治疗及基因治疗中有着巨大的应用价值。但要应用于临床,还有许多问题待解决。神经干细胞的增殖和定向分化就是关键性的问题,其受内外源性因素共同影响,如碱性螺旋-环-螺旋基因、Notch信号、细胞因子、微环境及化学诱导剂等均起作用[8,9]。本研究发现,cyclinD1基因过表达可促进神经干细胞的增殖。
本研究以慢病毒载体为基础,构建带有小鼠cyclinD1基因的重组慢病毒质粒plenti-D1,经过包装、扩增得到高滴度的病毒颗粒。体外转染第二代神经干细胞,在基因和蛋白质水平均检测到cyclinD1表达明显增加,说明cyclinD1特异性的转染成功并且在神经干细胞中高表达。在本研究中,MTT法检测发现cyclinD1基因过表达可促进神经干细胞的增殖。本实验为后期cyclinD1基因在神经干细胞的分化条件研究中奠定基础。
[1]Lukaszewicz AI,Anderson DJ.Cyclin D1 promotes neurogenesis in the developing spinal cord in a cell cycle-independent manner[J].Proc Natl Acad Sci U S A,2009,108:11632-11637.
[2]Hirabayashi Y,Suzki N,Tsuboi M,et al. Polycomb limits the neurogenic competence of neural precursor cells to promote astrogenic fate transition[J].Neuron,2009,63:600-613.
[3]Ma J,Yu Z,Qu W,et al.Proliferation and differentiation of neural stem cells are selectively regulated by knockout of cyclin D1[J].J Mol Neurosci,2010,42:35-43.
[4]Bukrinsky MI,Haggerty S,Dempsey MP,et al.A nuclear localization signal within HIV-1 matrix protein that governs infection of non-dividing cells[J].Nature,1993,365:666-669.
[5]Goldstone DC,Yap MW,Robertson LE,et al.Structural and functional analysis of prehistoric lentiviruses uncovers an ancient molecular interface[J].Cell Host Microbe,2010,8: 248-259.
[6]Hardwick LJ,Ali FR,Azzarelli R,et al.Cell cycle regulation of proliferation versus differentiation in the central nervous system[J].Cell Tissue Res,2015,359:187-200.
[7]Lange C,Huttner WB,Calegari F.Cdk4/cyclinD1 overexpression in neural stem cells shortens G1,delays neurogenesis,and promotes the generation and expansion of basal progenitors[J]. Cell Stem Cell,2009,5:320-331.
[8]Okuda T,Kokame K,Miyata T.Differential expression patterns of NDRG family proteins in the central nervous system[J].J Histochem Cytochem,2008,56:175-182.
[9]Mizutani K,Yoon K,Dang L,et al.Differential Notch signalling distinguishes neural stem cells from intermediate progenitors[J].Nature, 2007,449:351-355.
(本文编辑:唐颖馨)
Construction of CyclinD1 Gene Overexpression Lentivirus Vector and Its Effect on theProliferation of Neural Stem Cells
MA Jun-fang,
CUI Bo,SHEN Dong-chao,CUI Li-ying.Department of Neurology,Peking Union Medical College Hospital,Chinese Academy of Medical Science&Peking Union Medical College,Beijing 100730,China
Objective:In order to study the effect of cyclinD1 on neural stem cell proliferation,the cyclinD1 gene overexpression lentiviral vector was constructed and the expression of cyclinD1 in neural stem cells in mice after transfection was tested.Methods:Nestin promoter-Ccnd1 gene was inserted into plenti6 lentiviral expression vectors by DNA recombination technique.Lentiviral vector plenti-D1 was established after recombination.Recombinant lentiviral vector was detected by DNA sequencing.The plenti-D1 was transfected into 293T cell line.The viruses yielded by 293T cell were transfected into mouse embryonic neural stem cells.The expression of cyclinD1 was detected by real-time PCR and Western Blot analysis after transfection.We studied the effects of different MOI values of plenti-D1 on neural stem cell proliferation by MTT assay.Results:It was confirmed by DNA sequencing that the cyclinD1 gene sequencing was correctly inserted into the vector,and that the cyclinD1 gene overexpression lentiviral vector was successfully constructed.After extracting the infected cells,the real-time PCR showed cyclinD1 mRNA overexpression was significantly higher than the control groups;Western Blot analysis was used to detect expression of cyclinD1 protein in neural stem cells.The cyclinD1 gene overexpression lentiviral vector was significantly up-regulated in mRNA level or in protein level in neural stem cells.When the MOI was 10,20,and 50,the viruses significantly promoted the proliferation of neural stem cells.Conclusion:The cyclinD1 gene overexpression lentiviral vector was successfully constructed and it efficiently up-regulated the expression of cyclinD1 in mouse embryonic neural stem cells.CyclinD1 overexpression can promote the proliferation of neural stem cells.
cyclinD1;over expression;neural stem cell;cell cycle
R741;R741.02
ADOI10.3870/sjsscj.2015.02.002
1.中国医学科学院北京协和医院神经内科
北京100730
2.中国医学科学院神经科学中心
北京100730
3.安徽医科大学附属省立医院神经内科
合肥230001
国家自然科学基金青年基金
(No.81100876);中国博管会基金面上项目
(No.2014M56091 0);
中国医学科学院院校博士后基金
2015-02-26
崔丽英
pumchcuily@sina. com

