维吾尔族儿童口腔白色念珠菌的检测及与龋病的关系初探
代海涛,仵 楠,徐 江
(石河子大学医学院第一附属医院口腔科,新疆 石河子 832000)
白色念珠菌(candida albicans)又称白假丝酵母菌,广泛存在于自然界,也存在于正常人口腔,上呼吸道,肠道及阴道,一般在正常机体中数量少,不引起疾病,为条件致病性真菌。当机体免疫力下降,正常的生态平衡破坏时,其可导致口腔黏膜病,牙周病的发生。龋病是儿童最常见的一种口腔疾病。近年来,白色念珠菌受到口腔微生物研究者的关注,不同地域、不同人群口腔白色念珠菌的检出及与龋病的相关研究都有文献报道,而国内鲜有关于少数民族儿童口腔白色念珠菌的报道。本研究旨对乌鲁木齐市幼儿园的维吾尔族儿童口腔白色念珠菌的检出情况进行分析,探讨白色念珠菌与高龋相关危险因素。
1 材料和方法
1.1 主要试剂
科玛嘉念珠菌显色培养基(CHROMagarCandida,CAC,科玛嘉公司,法国),Biospin Fungus Genomic DNA Extraction Kit(Bioflux)、Taq聚合酶等PCR试剂(北京博迈德生物工程公司)核酸染料,MarkDL2000(北京生工生物)。
1.2 研究对象
通过伦理委员会批准及征得幼儿园准许和家长知情同意,采用分层整群抽样方法随机调查乌鲁木齐市区4所双语幼儿园3~5岁维吾尔族儿童104名。纳入标准:检查前1个月内未服用抗生素,无全身性疾病,无先天性疾病及表现出任何症状的口腔黏膜病,口腔内未佩戴矫治器。受试儿童于采样前2 h禁食,并用磷酸盐缓冲液(PBS)漱口。
1.3 方法
1.3.1 口腔检查
对104名儿童进行龋病检查,其中高龋组51名,无龋组53名。龋齿诊断标准参考WHO“口腔健康调查基本方法”标准,dmft≥5为高龋组,dmft=0为无龋组。
1.3.2 样本采集
采用两种方法取样。①菌斑法:无龋儿童用无菌木签取上下颌第一乳磨牙颊侧颈1/3及上前牙唇面颈1/3菌斑;有龋儿童用无菌挖器取龋损牙的深部牙本质及龋损牙釉质,放人消毒灭菌的装有500 μL PBS液的2 mL无菌离心管中;②唾液法:取受试者口腔非刺激性唾液于10 mL无菌离心管中。所采集样本均冷藏于冰盒中,2 h送回实验室。
1.3.3 白色念珠菌培养
菌斑法获得的样本,用VERTEX震荡2 min,将所有样本调整到 300 μL,弃去多余液体,于6 000 r/min离心10 min,弃去上清液,用100 μL无菌PBS液重新混悬,取出20 μL接种于CAC培养基。唾液法获得的样本,直接取20 μL接种于CAC培养基。接种后的培养基在37℃培养,24~48 h观察菌落颜色对CAC培养样本进行判断。
1.3.4 白色念珠菌鉴定
1.3.4.1 45 ℃生长实验
挑取CAC平板上翠绿色或蓝绿色菌落再次接种于CAC平板,恒温45℃培养48 h,观察菌落生长情况。
1.3.4.2 革兰染色法
取CAC平板上翠绿色或蓝绿色菌落涂片、固定后,革兰染色,置显微镜下观察。
1.3.4.3 PCR 鉴定法
白色念珠菌的纯化及增菌:挑取CAC平板上翠绿色或蓝绿色单菌落划线接种于CAC平板上,重复3次。挑取在CAC上纯化的单个菌落移种于无菌沙氏液中,37℃摇动培养24 h。培养结束后按试剂盒说明提取白色念珠菌DNA:收集菌液使用lyticase酶破细胞壁,蛋白酶K消化蛋白,RNase除去RNA;然后用吸附柱法获得白假丝酵母菌的DNA,并用分光光度法测定DNA纯度和含量。于-20℃冷冻保存备用。
PCR扩增及电泳:所用引物为MITS:GGAAGTAAAAGTCGTAACAAGG;ITS2:GCTGCGTTCTTCATCGATGCPCR。
反应体系(20 μL):2×EasyTaq PCR Super-Mix10 μL,10 μmol/L上游引物和下游引物各0.5 μL,牙菌斑DNA模板2.0 μL,H2O 7.0 μL调制平衡。循环条件:95℃热启动5 min;95℃30 s,50℃退火 30 s,72℃ 30 s,40 个循环;72℃10 min。4℃保存。15 g/L琼脂糖,1×TBE缓冲液,genefinder核酸染料染色,电泳(100 V)30 min。紫外线凝胶扫描成像,并记录实验结果。
1.4 统计学处理
采用SPSS 17.0统计软件对数据进行pearson χ2检验,检验水准 α =0.05。
2 结果
2.1 白色念珠菌临床菌株的培养
白色念珠菌在37℃培养24 h后在平板上形成白色或淡绿色扁圆形菌落,48 h后菌落颜色呈翠绿色或蓝绿色,大小不一,直径1~3 mm,嵌入培养基,菌落表面及边缘光滑;紫色菌落为光滑念珠菌;蓝灰色菌落为热带念珠菌;粉红色菌落为克柔念珠菌;深绿色菌落为都柏林菌(图1)。
2.2 白色念珠菌45℃生长实验及革兰染色
培养平板经45℃培养48 h,生长良好。显微镜下观察,可见成群G+的卵圆形的孢子和菌丝(图2)。
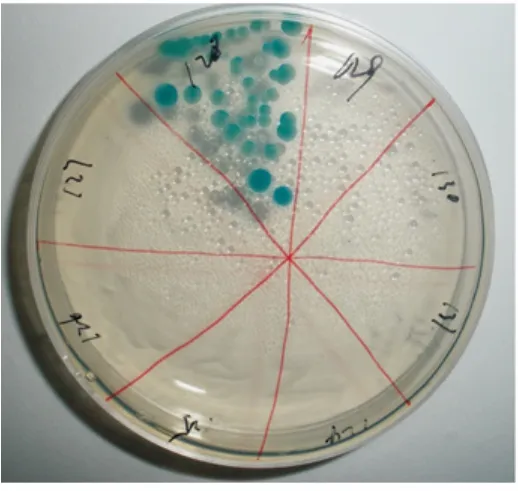
图1 CAC培养基白色念珠菌培养菌落
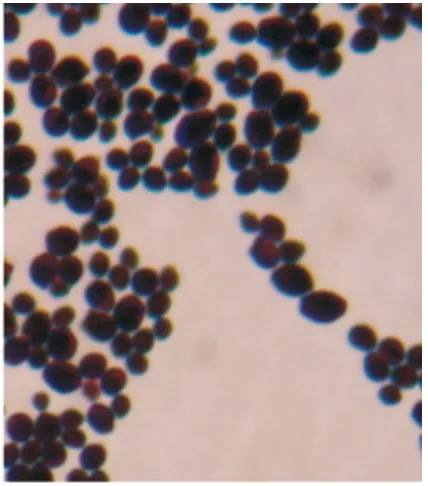
图2 白色念珠菌革兰染色
2.3 白色念珠菌PCR鉴定
CAC鉴定培养基上呈绿色的菌落,经过PCR鉴定,均为白色念珠菌,目的条带明亮清晰(图3)。
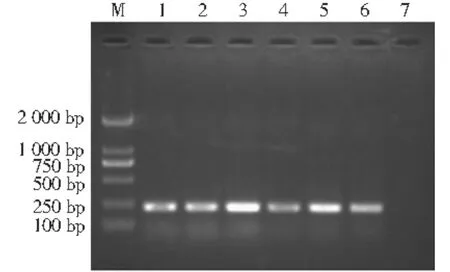
图3 白色念珠菌PCR鉴定
2.4 两种方法检测不同龋敏感性儿童口腔白色念珠菌
菌斑法与唾液法得到的白色念珠菌的检出率无龋组分别为 3.8%、1.9% (χ2=0.343,P=0.558),高龋组分别为 47.1%、27.5%(χ2=4.194,P=0.041);不同龋敏感性儿童口腔白色念珠菌的检出皆具有统计学意义(菌斑组χ2=25.971,P=0.000;唾液组χ2=13.761,P=0.000)(表 1)。
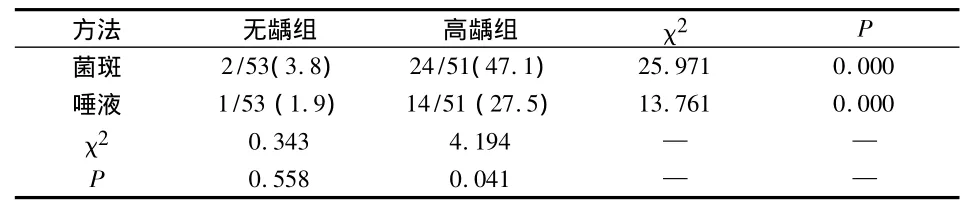
表1 两种方法检测不同龋敏感儿童口腔白色念珠菌(%)
2.5 两种方法检测不同性别儿童口腔白色念珠菌
菌斑法与唾液法得到的白色念珠菌的检出率男性组分别为 29.8%、14.0%(χ2=4.150,P=0.042),女性组分别为 17.0%、6.4%(χ2=3.294,P=0.070),男、女间无统计学意义(菌斑组χ2=2.313,P=0.078;唾液组χ2=1.595,P=0.207)。
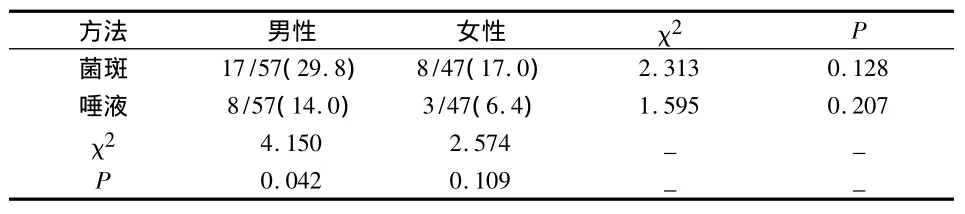
表2 两种方法检测不同性别儿童口腔白色念珠菌(%)
3 讨论
目前在龋病病因学研究中,微生物牙菌斑生物膜菌种间信息交流及信号调控机制是国内外龋病研究者的重要课题。由于口腔微生物环境的复杂、多样性以及研究方法的局限性,对口腔微生物病因学研究长期以来多集中于变异链球菌、乳酸杆菌等已知菌属上。而在近10年的研究中发现龋病的发生不一定依赖于变异链球菌的存在[1],可能还有其他微生物的致龋作用。而人类口腔中有700余种微生物[2],这些微生物之间通过共生、竞争、拮抗和抑制等生活方式在牙菌斑生物膜中发挥着各自的作用,参与龋病的发生发展的过程还有待于研究。近年来,随着对龋齿微阵列的研究,及对定植于牙面的菌斑之间相互作用的研究日益深入外,对白色念珠菌与ECC的相关性的研究也日益受到国内外研究者的重视[3]。白色念珠菌具有强大的产酸潜能,可分解利用山梨糖、木糖醇等多种变异链球菌不能利用的糖类产酸[4],产酸溶解羟基磷灰石的能力为变异链球菌的20倍[5],且无论玷污层存在与否,白色念珠菌均易粘附于牙釉质、牙本质和牙骨质表面[6]。研究者由此推测白色念珠菌可能有很强的致龋潜能[2]。在近10年的研究中发现龋损部位有时并无变异链球菌的存在,口腔白色念珠菌与龋病的关系更是日益受到研究者的关注,很多学者认为白色念珠菌很可能是致龋的危险因素[7-,9]。
目前,科玛嘉念珠菌显色培养基(CAC)已得到临床和实验室的有效评价,灵敏度与特异度都得到了认可[10]。为了明确区分在CAC上绿色光滑菌落是白色念珠菌还是都柏林菌[11],本研究除了进行45℃生长实验验证外,还运用灵敏可靠的聚合酶链式反应对白色念珠菌进行分子生物水平的鉴定,得到明亮清晰,稳定的目的条带。经过PCR鉴定,CAC鉴定培养基上呈绿色的菌落,经证明均为白色念珠菌。
检测口腔白色念珠菌的采样方法主要分为唾液法和菌斑法。唾液法采集样本针对于成年人较快速简易,检查者和受试者都比较容易操作,是较理想的样本采集方式[12],而本试验对象为3~5岁幼儿,有部分幼儿不能配合唾液法采集样本。菌斑法采集样本更有利于获得龋洞部位的念珠菌[13],操作简单,幼儿易于配合。本研究采用菌斑法与唾液法检测不同龋敏感性及不同性别儿童口腔白色念珠菌,结果显示,菌斑法检测到的白色念珠菌在高龋组儿童及男性儿童组中都较唾液法高,差异有统计学意义。提示菌斑法采集样本更有利于口腔白色念珠菌的检测,与Arendorf[13]观点一致。采用菌斑法收集样本的方法,无论从可操作性还是可靠性上都较唾液法更值得推广。两种方法在无龋组与女性组中检测白色念珠菌获得率都较低,可能是导致两种方法在这两组中无差异的原因。而无论运用哪种方法维吾尔高龋组白色念珠菌的检出率均明显高于无龋组,且差异具有统计学意义,提示白色念珠菌可能是龋病的危险因素,与Majewska等[8]Marchant等[9]和 Radford 等[14]观点都具有统一性。维吾尔族男、女性别口腔白色念珠菌的检出无差异,与 Ma'amon[15]的儿童口腔白色念珠菌的总体分布可能与性别有关的观点不一致,可能与民族差异及地域差异有关,还有待于进一步研究。
[1]Beighton D.The complex oral microflora of high-risk individuals and groups and its role in the caries process[J].Community Dent Oral Epidemiol,2005,33(4):248 - 255.
[2]Aas JA,Paster BJ,Stokes LN,et al.Defining the normal bacterial flora of the oral cavity[J].Clin Microbiol,2005,43(11):5721-5732.
[3]Signoretto C,Burlacchini G,FaccioniF,et al.Support for the role of candida spp in extensive caries lesions of children[J].New Microbiol,2009,32(1):101 -107.
[4]Klinke T,Kneist S,de Soet JJ,et al.Acid production by oral strains of candida albicans and Lactobacilli[J].Caries Res,2009,43(2):83-91.
[5]Nikawa H,Yamashiro H,Makihira S,et al.In vitro cariogenic potencial of candida albicans[J].Mycoses,2003,46(11 - 12):471-478.
[6]Sen BH,Safavi KE,Splvgberg LS.Colonization of candida albicans on cleaned human dental hard tissues[J].Arch Oral Biol,1997,42(7):513 -520.
[7]Russell C,Lay KM.Natural history of candida species andyeasts in the oral cavities of infants[J].Arch Oral Biol,1973,18(8):957-962.
[8]Majewaka A,Sozanska Z,Kaslak M,et al.Occurrence of yaest-like fungi in the oral cavity and dental caries intensity[J].Mikol Lek,2000,7(7):71 -75.
[9]Marchant S,Brasilsford SR,Twomey AC,et al,The predominant microflora of nursing caries lesions[J].Caries Res,2001,35(6):397-402.
[10]Ghelardi E,PichieI G,Castagna B,et al.Erfjcacy of chomogenie candida agar for isolation and presummiveidentification of pathogenic yeast species[J].Clin Micmbiol Infec,2008,14(2):141-147.
[11]秦振宇,吴绍熙,谭升顺,等.都柏林念珠菌的国内首次分离[J].临床皮肤科杂志,1999,28(4):213 -214.
[12]Samaranayake LP,MacFarlane TW,Lamey PJ,et al.A comparison of oral rinse and imprint techniques for the detection of yeast,coliform and Staphylococcus aureus carriage in the oral cavity[J].J Oral Pathol,1986,15(7):386 -388.
[13]Arendorf TM,Walker DM.The prevalence and intra oral distribution of candida albicans in man[J].Arch Oral Biol,1980,25(1):1-10.
[14]Radford JR,Ballatyne HM,Nugent ZJ,et al.Caries-associatedmicroorganismsin infants from different socio-economic backgrounds inScothland[J].J Dent,2000,28(5):307 -312.
[15]Ma'amon A.Rawashdeh,BDS,et al.Oral candidal colonization in ceftpatients as a function of age,gender,surgery,yype of cleft,and oral health[J].Oral Maxillofac Surg,2011,69(4):1207-1213.

