奈达铂提高鼻咽癌CNE-2 细胞放射敏感性的体外实验研究
王镇南,唐 志,喻嫦娥,李淑慧,杨东红 (广东医学院附属医院肿瘤中心,广东 湛江 524001)
鼻咽癌是严重威胁全球健康的常见的恶性肿瘤,许多国家在过去20 年内发病率持续增长,由于鼻咽的解剖部位深在,解剖结构复杂,病理主要为非角化型未分化癌以及易出现颈部淋巴结及远处转移,在初诊的患者中,Ⅲ、Ⅳ期鼻咽癌约占总病例的60%左右[1-2]。目前,放射治疗是无远处转移鼻咽癌首选和主要的治疗方法,但晚期鼻咽癌(Ⅲ、Ⅳ期) 因易局部复发和远处转移,5 年生存率约40%~70%[3]。因此,寻求高效、低毒的放疗增敏剂成为研究的热点。
铂类药物在细胞内形成DNA 蛋白质交联,在DNA 中形成链间和链内交联,细胞通过修复这些交联使DNA 链断裂[4]。奈达铂是第二代铂类抗肿瘤药物,胃肠道反应和肾毒性均明显低于顺铂,本实验将奈达铂应用于鼻咽癌细胞上,通过观测鼻咽癌细胞增殖、凋亡和周期的改变,探索奈达铂对鼻咽癌细胞是否有放疗增敏作用及其增敏的相关机制,为探索鼻咽癌治疗的新策略提供理论依据。
1 资料与方法
1.1 一般资料
1.1.1 材料:人鼻咽癌CNE-2 细胞株由广东医学院病理教研室赠送,用含10%胎牛血清(Gibco 公司)的RMPI-1640 培养液(Gibco 公司),在37℃、5%CO2饱和湿度条件下培养,取对数生长期细胞进行实验。
1.1.2 试剂:NDP 购自南京先声东元制药有限公司,批号:11-120301,新生胎牛血清,RPMI-1640 细胞培养基及胰蛋白酶购自Gibco 公司,细胞凋亡检测试剂盒、细胞周期检测试剂盒购自凯基生物科技有限公司,CCK-8 试剂盒购自日本同仁化学研究所。
1.1.3 主要仪器:CO2细胞培养箱(Thermo),倒置显微镜(Olympus),低速离心机(中佳光电),酶标仪,流式细胞仪(美国Coulter 公司)。
1.2 方法
1.2.1 CCK-8 法检测细胞增殖影响:取对数生长期的CNE-2 细胞以每孔1.0×105个细胞接种至96 孔板,于37℃、5%CO2细胞培养箱中培养至60%~70%细胞融合后,加入含不同浓度的NDP(4 mg/L、8 mg/L、16 mg/L、32 mg/L、64mg/L)新鲜培养液培养,每个浓度设3 个复孔,同时设立对照组(没有NDP处理)和空白组(没有细胞);共同培养48h,弃去培养基,每孔加入含CCK-8 10 μl 的100 μl 培养液,37℃继续孵育至培养液呈黄色;在酶标仪上测定每孔450 nm 吸光值(A),计算不同浓度药物的生长抑制率;计算公式:肿瘤细胞抑制率=(未处理组吸光值-药物组吸光值)/未处理组吸光值。实验重复3 次,取平均值分析各组细胞的生长抑制率。并计算IC50。
1.2.2 克隆形成试验分析放射增敏作用:将细胞分组进行不同处理:对照组,NDP 组,单纯放疗组,NDP +放射组;其中对照组和NDP 组接种细胞数100 个,单纯放疗组和NDP+放射组则根据照射剂量的不同将不同数量(100,200,500,3 000,5 000,10 000)的细胞接种于不同的6 孔培养板中,细胞贴壁后依次进行不同剂量的照射(0、2、4、6、8、10 Gy)。照射源为(6 Mv X 线)直线加速器,距靶源100 cm,照射野大小为20×20 cm2,照射角度为180 度,把培养皿置于照射野中心照射,培养皿内液体高度3 mm,培养皿底部加1 cm 厚补偿膜;照射后在培养箱内培养12 天,以无水乙醇固定,结晶紫染色,计数≥50 个细胞的克隆。根据各照射剂量点的存活分数作图,利用单击多靶模型方程拟合细胞存活曲线,求出D0,并计算放疗增敏比(SER)。SER=D0 值(单纯照射组)/D0值(照射加药组)。
1.2.3 AnnexinV-FITC/PI 双染法检测细胞凋亡情况:将CNE-2 细胞种于6 cm 培养皿中,待培养至60%~70%细胞融合后,将细胞分成四个处理组:对照组,NDP 组,单纯放疗组,,NDP+放射组(单纯放疗组为单次射线照射4 Gy,NDP 组为其作用48 h,NDP 联合放疗组为单次射线照射4 Gy 后,NDP 继续培养至48 h)。处理48 h 后,收集细胞,加入AnnexinV-FITC、PI 后,流式细胞仪检测细胞的凋亡率。实验重复3 次,取平均值分析各组细胞的凋亡率。
1.2.4 PI 法检测细胞周期变化:将CNE-2 细胞种于6 cm 培养皿中,待培养至60%~70%细胞融合后,将细胞分成四个处理组:对照组,NDP 组,单纯放疗组,,NDP+放射组(单纯放疗组单次射线照射4 Gy,hTRR 组为其作用48 h,hTRR 联合放疗组为hTRR 培养48 h,4 Gy 射线照射)。处理48 h,收集细胞,70%冷乙醇500 微升固定,4 摄氏度保存过夜;重新收集细胞,加100 微升RNA 酶,37 摄氏度水浴反应30 分钟;加入400 微升PI,避光反应30 分钟;流式细胞仪检测,实验重复3 次,取平均值分析细胞周期。
2 结果
2.1 NDP 对CNE-2 细胞增殖的影响及IC50值:不同浓度NDP 作用CNE-2 细胞48 h 后,酶标检测仪测定各孔的光吸度并计算其抑制率。药物对细胞生长抑制作用如图1、图2 所示:NDP 呈剂量依赖性抑制鼻咽癌CNE-2 细胞的生长。且NDP 作用48 h 的50%抑制浓度IC50为32.576 mg/L。为减小NDP 本身对细胞生长的影响,以下试验中选取1/5 的IC50(6.515 mg/L)浓度,观察NDP 对CNE-2 细胞放射增敏作用、凋亡和周期分布改变的影响。

图1 NDP 对鼻咽癌CNE-2 细胞的增殖抑制作用

图2 NDP 抑制鼻咽癌CNE-2 细胞的增殖
2.2 NDP 联合放疗增强CNE-2 细胞的放射敏感性:按分组要求处理细胞,培养12 d 后,计算各处理组细胞的存活分数,见表1。采用Sigmaplot 10.0 软件按单击多靶模型SF=1-(1-e-D/D0)N拟合各组剂量存活曲线,见图3,可得出各组N、Do、SF2 值,见表2,计算放射增敏比(SER)为:SER=Do(单纯放射组)/Do(加药后照射组)=1.542。
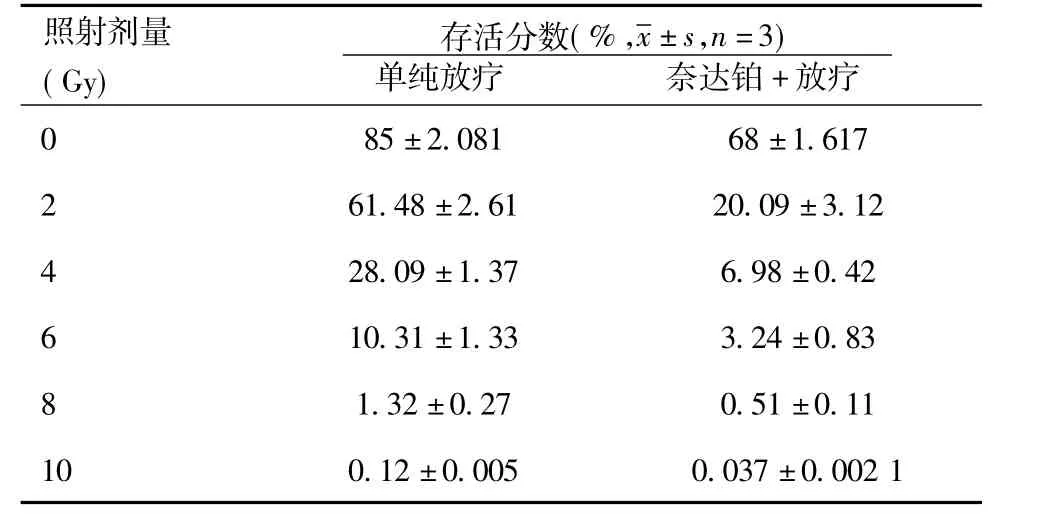
表1 NDP 联合不岂剂量对CNE-2 细胞克隆形成的影响

表2 单纯放射组和NDP 加放射组D0、N、SF2 值
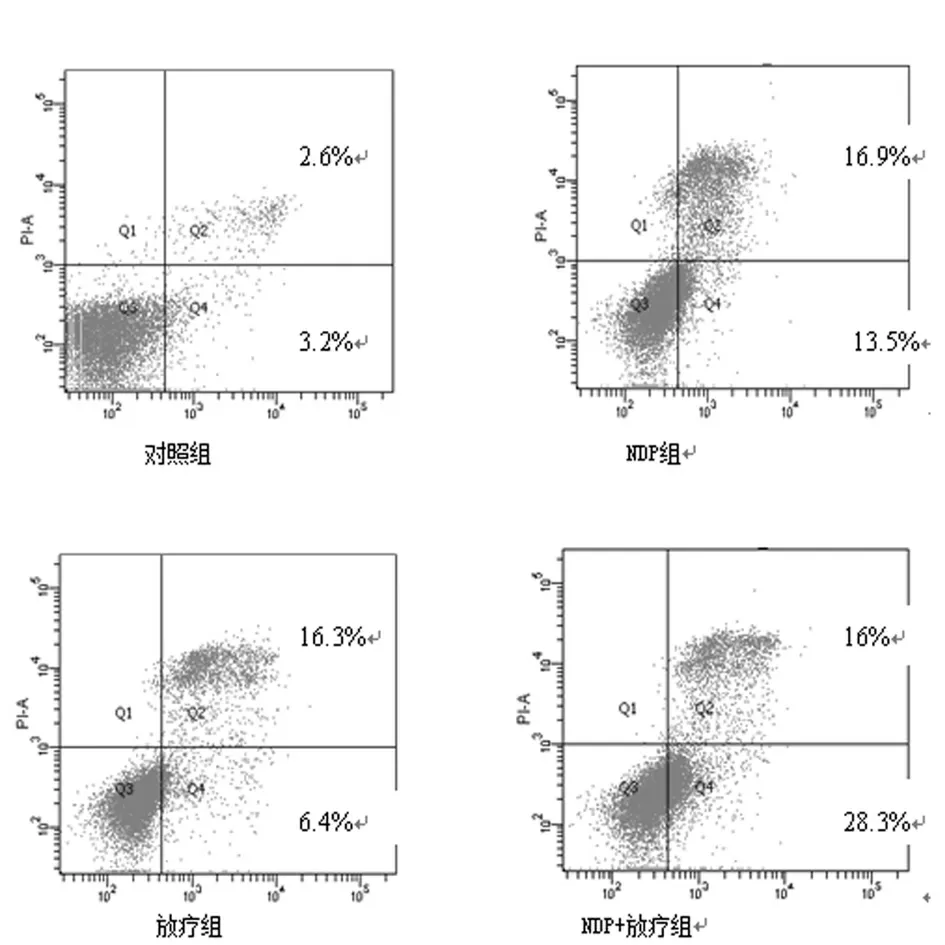
图4 单纯放射组和NDP 加放射组D0、N、SF2 值
如图3 所示,这种经拟合得出的Do、N 和SF2 值,可从不同方面反应细胞的放射敏感性:Do 为平均致死剂量,为照射杀灭63%细胞所需的剂量,Do 越大,表示细胞放射抗拒性越强;N 值为外推值,反映细胞对放射引起损伤的修复能力,N 值越大表示细胞修复能力越强,杀死细胞所需射线剂量越大,放射抗拒性增强;2Gy 时存活分数SF2 是代表细胞放射敏感性的重要指标,其中SF2 越大,表示放射抗拒性越强。从存活曲线可以看出,NDP 能明显增加CNE-2 细胞对放射的敏感性,放射增敏比(SER)为1.542。
2.3 NDP 联合放疗诱导CNE-2 细胞的凋亡:经AnnexinVFITC 和PI 双染后,正常的活细胞不被AnnexinV-FITC 和PI染色(左下象限),凋亡早期的细胞仅被AnnexinV-FITC 染色,PI 染色呈阴性(右下象限),坏死细胞和凋亡晚期的细胞可同时被AnnexinV-FITC 和PI 染色(右上象限),左上象限出现的是许可范围内的误差。处理48 h 后,计算早期和晚期凋亡率,结果如图4、5 所示:与对照组相比,NDP 组、单放组及NDP 联合放疗组的细胞凋亡率皆增多,差异有统计学意义(F=277.76,P <0.01),其中NDP+放疗组诱导凋亡作用最明显,凋亡率达(44.3±1.85)%,显著高于NDP 组或单放组(P <0.01),表明NDP 可显著诱导CNE-2 细胞的凋亡,且NDP 联合放疗可增强诱导CNE-2 细胞凋亡。

图5 CNE-2 细胞凋亡率
2.4 NDP 联合放疗对CNE-2 细胞周期的作用:细胞在两次有丝分裂之间的时间被称为细胞周期,处在增殖分裂过程的细胞首先经历G1期(DNA 合成前期),RNA 迅速合成,并指导大量多种新蛋白质和其他分子的合成。随后进入S 期(DNA 合成期),进行DNA 的复制。再之后是G2期(DNA 合成后期),这是有丝分裂的准备期。然后是M 期(有丝分裂期)。细胞分裂周期不同时相是影响细胞放射敏感性的重要因素,处于分裂周期不同时相的细胞放射敏感性有很大的差异。有研究证实,鼻咽癌CNE2 细胞S 期细胞对放射抗拒,M 期和G2期的细胞放射敏感性高,细胞G1/G0期较长,G1早期放射抗拒,G1晚期放射敏感。
实验结果如表3 和图6 所示,对照组细胞大部分处在G1/G0期,其次是S 期,G2/M 期细胞只占少量。单纯照射组产生明显的G2期阻滞,G2/M、S 期细胞比例增加,G1/G0期比例降低。单纯放射组S 比例增大可能是细胞受放射损伤后,对放射线不敏感的S 期细胞存活,S 期细胞比例相对增加。单纯NDP组G2/M、S 期细胞比例与对照组无明显差异,NDP 联合放疗与单纯放疗相比,G2/M、S 期细胞也无明显差异。因此,本试验结果显示,NDP 对CNE-2 细胞周期分布的改变无明显影响。

表3 NDP、放疗对CNE-2 细胞周期分布的影响(%)

图6 PI 单染检测细胞周期
3 讨论
奈达铂化学名为顺-甘醇酸二氨合铂,由日本盐野义制药公司研发,1995 年6 月在日本上市,是顺铂的类似物,但胃肠道和肾毒性均明显低于顺铂,且部分对顺铂耐药的患者,改用奈达铂后仍可取得一定的疗效[5]。临床上主要用于食管癌、肺癌、头颈部肿瘤、膀胱癌、宫颈癌等实体肿瘤的治疗[6-10]。
肿瘤细胞的增殖周期是指一个细胞株倍增时间,肿瘤细胞的生长速度与细胞增殖周期时间长短有关。来源相同的肿瘤细胞和正常细胞相比较,周期经历的时间大致上是一样的,但肿瘤细胞以不受机体控制的方式增殖,细胞数量也不断地无限制地增加[11]。因此,抗肿药物瘤抑制肿瘤细胞的增殖对肿瘤治疗起着非常重要的作用。本实验发现,NDP 呈剂量依赖性抑制鼻咽癌CNE-2 细胞的生长,在NDP 浓度64 mg/L 时,抑制率达(91±1.68)%,且NDP 作用48h 的50%抑制浓度IC50 为32.576 mg/L。为了减小NDP 本身对细胞生长的影响,选取1/5的IC50(6.515 mg/L)浓度进行凋亡、周期和克隆形成的实验研究。
辐射能(mdiant eneFgy)是射线本身具有的能量,是放疗发挥抗癌作用的关键,即当细胞吸收任何形式的辐射能量后,射线与细胞内的结构发生作用而间接或者直接地损伤细胞DNA,引起细胞死亡[12]。直接损伤表现在射线直接作用于DNA,引起DNA 分子出现交联、断裂[13]。间接损伤表现在射线对人体组织间液发生电离,产生自由基,产生的自由基再和生物大分子发生作用,形成不可逆损伤,引起细胞死亡[14]。因而,影响放射效应的因素都是和这2 种效应有关系的因素。主要有放射损伤修复能力、氧效应(oxygen effect)以及存在辐射耐受细胞等因素[15]。放疗后引起的细胞损伤修复能力的大小可以经N 值来判断,N 增大表示细胞修复能力增强,杀死细胞所需剂量增大,放射抗拒性增强[16];本试验经细胞存活曲线证实了NDP 对CNE-2 细胞的放射增敏作用,从细胞存活曲线的参数来看,NDP+放射组的N 值明显小于单纯放疗组,D0 和SF2 值也小于单纯放疗组,放射增敏比为1.542。说明NDP+放疗能降低细胞的损伤修复,从而使细胞存活分数降低。是奈达铂放疗增敏的一种机制。
随着肿瘤形成机制以及放射和药物作用机制的阐明,放疗增敏的概念已包括细胞微环境,血管形成,放射所致细胞信号转导过程,DNA 损伤和细胞周期紊乱、凋亡、分化等多个非常复杂的领域[17]。目前,放射增敏主要集中在基因水平和放射增敏剂两个方面[18]。放射增敏剂有铂类药物、抗代谢药物、紫杉烷类和微管稳定药物、靶向药物等[19]。奈达铂是新一代铂类抗肿瘤药物,其进入细胞后,甘醇酸酯配基上的醇性氧与铂之间的键断裂,铂与水结合形成多种离子型物质,以与顺铂相同的方式和DNA 结合,抑制DNA 的复制或通过自由基形成而产生毒性中间产物发挥抗肿瘤作用[20]。本研究得出,与对照组相比,奈达铂组、单放组及奈达铂联合放疗组的细胞凋亡率皆增多,其中NDP 组、单纯放疗组凋亡率为(30.4+2.17)%、(22.7+2.24)%(P <0.05),NDP 加放疗组凋亡率最高,显著高于NDP组或单放组,为(44.3+1.85)%(P <0.01)。表明NDP 可显著诱导CNE-2 细胞的凋亡,且NDP 联合放疗可增强诱导CNE-2 细胞凋亡。凋亡被认为是一种重要的放射敏感性指标,有文献报道,放疗是通过诱导凋亡发生来达到治疗目的的[21-22]。如上所述,NDP 可显著诱导CNE-2 细胞的凋亡,说明通过诱导凋亡增加而增加细胞对放射线的敏感性是奈达铂对鼻咽癌放射增敏的一种机制。
根据奈达铂抗肿瘤作用机制是引起双链DNA 破裂,对放射线最不敏感的S 期细胞应该明显减少,但本实验结果显示,单纯NDP 组G2/M、S 期细胞比例与对照组无明显差异,NDP 联合放疗与单纯放疗相比,G2/M、S 期细胞也无明显差异。因此,本研究表明NDP 对CNE-2 细胞周期分布的改变无明显影响。奈达铂是否会通过改变周期分布起放射增敏有待进一步的研究。
[1] Ong YK,Solares CA.Endoscopic nasopharyngectomy and its role in managing locally recurrent nasopharyngeal carcinoma[J].Otolaryngol Clin North Am,2011,44(5):1141.
[2] Chaudhuri T,Mondal D.Comment on: “Increased treatment-related mortality with additional cisplatin-based chemotherapy in patients with nasopharyngeal carcinoma treated with standard radiotherapy”[J].Radiother Oncol,2013,106(3):411.
[3] Guigay J.Advances in nasopharyngeal carcinoma[J].Curr Opin Oncol,2008,20(3):264.
[4] 赵维勇,孙新臣.放射治疗增敏的研究现状[J].临床肿瘤学杂志,2012,17(7):655.
[5] Su XY,Yin HT,Li SY,et al.Intervention effects of nedaplatin and cisplatin on proliferation and apoptosis of human tumour cells in vitro[J].Asian Pac J Cancer Prev,2012,13(9):4531.
[6] Osawa S,Furuta T,Suqimoto K,et al.Prospective study of daily low-dose nedaplatin and continuous 5-fluorouracil infusion combined with radiation for the treatment of esophageal squamous cell carcinoma[J].BMC Cancer,2009,9:408.
[7] Hasegawa Y,Takanashi S,Okudera K,et al.Weekly paclitaxel and nedaplatin with concurrent radiotherapy for locally advanced non-small-cell lung cancer:a phase I/II study[J].Jpn J Clin Oncol,2004,34(11):647.
[8] Maruoka Y,Ando T,Oqiuchi Y,et al.Nedaplatin(NDP) -combination therapy(NDP/5-FU,NDP/S-1) for oral cancer[J].Gan To Kaqaku Ryoho,2007,34(5):713.
[9] Shigehara K,Kitagawa Y,Nakashima T,et al.Squamous cell carcinoma of the bladder:a patient treated successfully with a new combined chemotherapy regimen,intraarterial nedaplatin and pirarubicin plus intravenous methotrexate and vincristine[J].Int J Clin Oncol,2006,11(4):329.
[10] Arimoto T,Oda K,Nakaqawa S,et al.Retreatment with nedaplatin in patients with recurrent gynecological cancer after the development of hypersensitivity reaction to carboplatin[J].“J Obstet Gynaecol Res,2013,39(1):336.
[11] Wu N,Xiao L,Zhao X,et al.miR-125b regulates the proliferation of glioblastoma stem cells by targeting E2F2[J].FEBS Lett,2012,586(21):3831.
[12] Chen JY,Ma XJ,Zhou WB,et al.Radiotherapy for and prognosis of breast cancer patients with local-regional recurrence after mastectomy[J].Ai Zheng,2009,28(10):1077.
[13] Narayanapillai S,Agarwal C,Deep G,et al.Silibinin inhibits ultraviolet B radiation-induced DNA-damage and apoptosis by enhancing interleukin-12 expression in JB6 cells and SKH-1 hairless mouse skin[J].Mol Carcinog,2013,10(28):1002.
[14] Zeng J,See AP,Aziz K,et al.Nelfinavir induces radiation sensitization in pituitary adenoma cells[J].Cancer Biol Ther,2011,12(7):657.
[15] Jakob B,Durante M.Radiation dose detection by imaging response in biological targets[J].Radiat Res,2012,177(4):524.
[16] Anai S,Tanaka M,Shiverick KT,et al.Increased expression of cyclooxygenase-2 correlates with resistance to radiation in human prostate adenocarcinoma cells.J Urol,2007,177(5):1913.
[17] Rieber M,Rieber MS.Sensitization to radiation-induced DNA damage accelerates loss of bcl-2 and increases apoptosis and autophagy[J].Cancer Biol Ther,2008,7(10):1561.
[18] Kesari S,Advani SJ,Lawson JD,et al.DNA damage response and repair:insights into strategies for radiation sensitization of gliomas[J].Future Oncol,2011,7(11):1335.
[19] Rosenberg A,Knox S.Radiation sensitization with redox modulators:a promising approach[J].Int J Radiat Oncol Biol Phys,2006,64(2):343.
[20] Sato S,Fujiwara H,Oishi T,et al.Evaluation of a formula for individual dusage of nedaplatin based on renal function[J].Cancer Chemother Pharmacol,2012,69(3):599.
[21] Shao L,Wu L,Zhou D.Sensitization of tumor cells to cancer therapy by molecularly targeted inhibition of the inhibitor of nuclear factor kappaB kinase[J].Transl Cancer Res,2012,1(2):100.
[22] Yanq ES,Choi MJ,Kim JH,et al.Combination of withaferin A and X-ray irradiation enhances apoptosis in U937 cells[J].Toxicol In Vitro,2011,25(8):1803.
——再论奈达对翻译本质属性的认知

