依达拉奉预处理有效保护大鼠脊髓神经元氧化应激损伤
王正乐,刘培钊,2 (.中国人民解放军第7872 部队卫生队,河南 信阳 46400;2.第二军医大学研究生管理大队,上海200433)
脊髓损伤(Spinal cord injury,SCI)及其导致的截瘫是降主动脉和胸、腹主动脉手术后的严重并发症,发生率高达3.8%~16.7%。极大影响了手术效果,并给患者造成巨大的心理和经济负担[1]。目前,仍缺乏积极有效的预防措施。
脊髓损伤包括原发性损伤和继发性损伤两个过程。原发性损伤是由各种因素导致的脊髓组织的直接损伤,具有即刻性和不可逆性特点。继发性损伤则是由原发损伤导致的一系列生物化学反应,包括水肿、缺血再灌注损伤、炎性反应、兴奋性毒性以及氧化应激损伤等[2-3]。研究表明,自由基大量生成导致的氧化应激损伤是脊髓继发性损伤的重要机制[2]。针对这一机制,利用抗氧化剂防治脊髓损伤的研究和应用正在不断深入开展。抗氧化剂,如番茄红素、17-β 雌二醇、氢气等均已被证明能有效防治脊髓损伤[4-6]。依达拉奉(Edaravone,Ed)是安替吡啉的代谢产物,是一种非常强的自由基清除剂,目前已广泛应用于临床上中风患者的治疗。研究表明依达拉奉预处理可通过有效清除氧自由基,抑制脂质过氧化,延迟神经细胞凋亡,减轻脑缺血以及脑缺血引起的脑水肿和组织损伤[7]。随着研究的不断深入,Ed 预处理对肾脏、肝脏、肠、视网膜以及心脏等器官缺血再灌注损伤的保护效应也得到了广泛的证明[8]。但是Ed 预处理能否对脊髓损伤起到保护作用,仍不清楚,也未见报道。本研究以离体培养大鼠脊髓神经元为研究对象,观察Ed 预处理对大鼠脊髓神经元氧化应激损伤的保护效应,为脊髓损伤的防治提供新的方法。
1 资料与方法
1.1 动物及试剂:雌性Sprague-Dawley(SD)大鼠,孕14 d,购于第二军医大学实验动物中心。Neurobasal 培养基和B27 购于Gibco 公司。β-tubulin Ⅲ抗体购于Sigma 公司。蛋白提取试剂盒、BCA 法蛋白定量试剂盒、总超氧化合物歧化酶(SOD)检测试剂盒、丙二醛(MDA)检测试剂盒以及谷胱甘肽氧化酶(GSH-Px)检测试剂盒均购于江苏碧云天生物技术研究所,CCK-8 检测试剂盒购于日本同仁公司,乳酸脱氢酶(LDH)检测试剂盒购于南京建成公司。Ed 购于福建天泉药业股份有限公司。番茄红素(Lycopene,LP)购于新疆瑞德莱福生物科技有限公司。
1.2 脊髓神经元培养:10%水合氯醛麻醉SD 孕鼠,无菌条件下取出胎鼠,解剖镜下分离出脊髓,仔细分离软脊膜和血管。用D1-SGH 解剖液(D1 为无钙、镁离子的Pucks 液,SGH 为蔗糖、葡萄糖和HEPES 的缓冲液)清洗分离的脊髓3 次,虹膜剪将脊髓剪成约1 mm3的组织块。然后用0.05%胰蛋白酶于37℃培养箱中消化20 min。用含20%胎牛血清的DMEM 终止消化1 min。巴斯德滴管吹打15 次制成单细胞悬液,静置10 min后收集中层细胞悬液,以1×106/ml 的密度均匀接种于细胞培养板中培养,4 h 后全量换含2%B27 的Neurobasal 培养基,24 h 后加入阿糖胞苷(5 μmol/L)抑制胶质细胞生长(作用24 h),以后每3 天进行半量换液。
1.3 脊髓神经元鉴定:取培养7 d 的脊髓神经元进行免疫组织化学染色。弃培养液,PBS 漂洗2 次后加入4%多聚甲醛,室温固定30 min,PBS 漂洗5 min×4,加β-tubulin Ⅲ抗体每盖片50 μl,37℃湿盒孵育1 h 后4℃冰箱过夜,PBS 漂洗5 min×3次,HRP 标记山羊抗兔IgG 37℃孵育1.5 h,PBS 漂洗5 min×3次,4',6-二脒基-2-苯基吲哚染细胞核5 min,漂洗封片后荧光显微镜观察、照相。
1.4 实验分组:实验一共分为7 组(n=3)正常对照组(Con)、H2O2损伤组、GOX 损伤组、Ed+H2O2损伤组、Ed+GOX 损伤组、LP+H2O2损伤组、LP+GOX 损伤组。Ed 和LP 均在损伤前30 min 加入,Ed 终浓度为25、50、100 μM,LP 终浓度为5 μM[9]。
1.5 氧化损伤模型:实验中采用了H2O2损伤模型和GOX 损伤 模 型:H2O2 损 伤 模 型(200 μl,4 h),GOX 损 伤 模 型(20 mU/ml,2 h)
1.6 细胞损伤检测
1.6.1 细胞活性检测:脊髓神经元培养在96 孔板中,损伤结束后,PBS 漂洗2 遍,全量换含有CCK-8 检测试剂的Neurobasal 培养基(CCK-8 检测试剂和培养基的比例为1∶10),在细胞培养箱中培养3 h 后检测450 nm 处吸光值。
1.6.2 LDH 含量检测:脊髓神经元培养在6 孔板中,损伤结束后收集培养液,然后按照LDH 检测试剂盒说明书,测定培养基中LDH 含量。
1.6.3 MDA 含量检测:脊髓神经元培养在6 孔板中,损伤结束后弃培养基,用PBS 漂洗两遍,然后用细胞裂解液在冰上裂解10 min,收集细胞裂解液后按照MDA 检测试剂盒说明书,测定细胞裂解液中MDA 含量。
1.7 SOD 和GSH-Px 活性检测:脊髓神经元培养在6 孔板中,将各组细胞裂解后按说明书测定总SOD 和GSH-Px 活性。
2 结果
2.1 脊髓神经元培养和鉴定:A 为脊髓神经元培养7 d 时光镜下的照片(×200),B 为免疫组化鉴定结果。细胞免疫化学染色显示神经细胞表达特异性抗原(β-tubulin Ⅲ),神经细胞及其突起染色呈棕褐色,细胞核被4',6-二脒基-2-苯基吲哚染染色呈蓝色。在光镜下随机视野中计数阳性染色细胞显示培养体系中神经元细胞比例在90%以上。见图1。
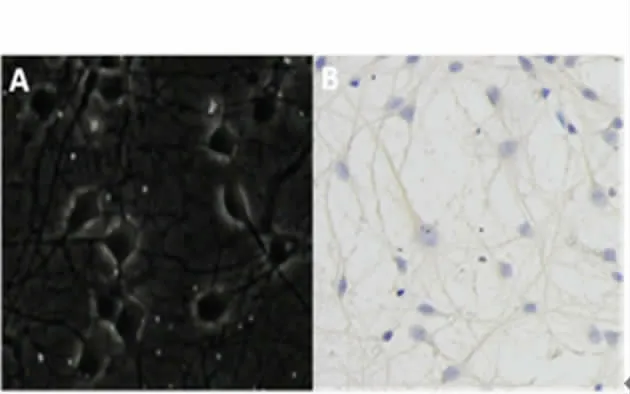
图1 大鼠脊髓神经元培养和鉴定
2.2 不同浓度Ed 对脊髓神经元活性的影响:25、50、100 μM的Ed 对大鼠脊髓神经元活性并无明显影响。见图2。
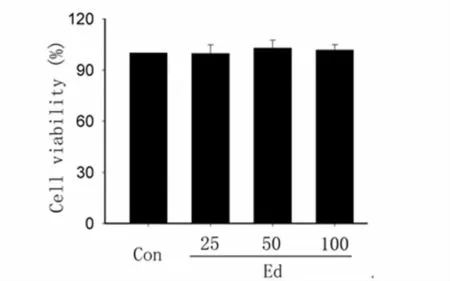
图2 不同浓度依达拉奉对大鼠脊髓神经元活性的影响
2.3 Ed 预处理减轻大鼠脊髓神经元氧化应激损伤:H2O2(200 μM,4 h)和GOX(20 mU/ml,2 h)均能明显诱导脊髓神经元氧化应激损伤,包括降低脊髓神经元活性、升高神经元MDA 含量以及升高培养液中LDH 含量。提前30 min 给予不同浓度Ed(25、50、100 μM)和LP 预处理能明显逆转H2O2和GOX 诱导的脊髓神经元氧化应激损伤。P <0.01 vs.Con 组,#p <0.05 vs.H2O2/GOX 组,##和&P < 0.01 vs.H2O2/GOX 组,$P <0.05 vs.LP+H2O2/GOX 组。提前30 min Ed 预处理可以明显减轻H2O2和GOX 对脊髓神经元的损伤。见图3。

图3 依达拉奉预处理对大鼠脊髓神经元氧化应激损伤的保护效应
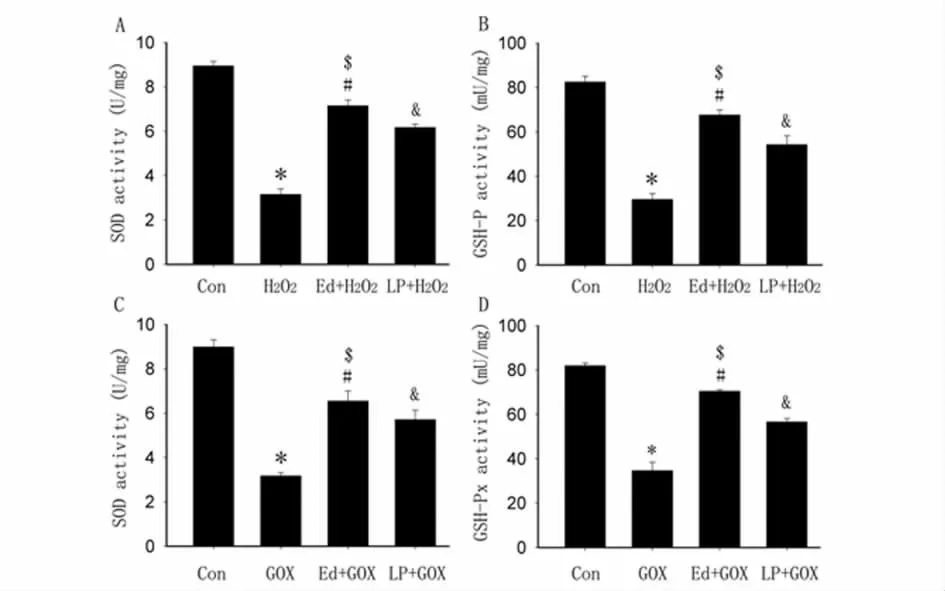
图4 依达拉奉预处理对大鼠脊髓神经元总SOD 和GSH-Px 活性的影响
2.4 Ed 预处理上调大鼠脊髓神经元SOD 和GSH-Px 活性:H2O2和GOX 均能明显降低脊髓神经元总SOD 和GSH-Px 活性。提前30 min 给予Ed 和LP 预处理均能显著升高脊髓神经元总SOD 和GSH-Px 活性。*P <0.01 vs.Con 组,#和&P <0.01 vs.H2O2/GOX 组,$P <0.05 vs.LP+H2O2/GOX 组。见图4。
3 讨论
氧化应激是脊髓损伤的重要机制之一,本研究发现Ed 预处理可以明显减轻H2O2和GOX 诱导的脊髓神经元氧化应激损伤,显著上调脊髓神经元内总SOD 和GSH-Px 的活性。
脊髓是中枢神经系统的重要组成部分。脂质含量比较高,氧化应激损伤在脊髓损伤中起着非常重要的作用。此外,由于神经细胞的修复能力差,脊髓损伤后,救治困难,常遗留严重的后遗症[1]。
H2O2是机体内一种重要的活性氧,外源性H2O2极易通过细胞膜,进入细胞后的H2O2可以与细胞内的过度金属发生Fenton 反应,形成高活性的自由基如单态氧、羟自由基等,进一步造成细胞损伤[10]。在本实验中,采用直接给予外源性H2O2和给予GOX 间接增加细胞内H2O2含量方法来建立神经元氧化应激损伤模型。在机体内GOX 与过氧化氢酶组成一个氧化还原酶系统,能够氧化β-D-葡萄糖生成H2O2和D-葡萄糖酸内酯,在这个过程中葡萄糖氧化酶的特点是能够消耗氧气,催化葡萄糖氧化,生成浓度较稳定的H2O2[11]。实验结果表明直接给予外源性H2O2 和给予GOX 均能明显降低神经元活性、显著增加神经元MDA 含量和培养液中LDH 含量,提示在本实验中这两种方法均能成功建立神经元氧化应激损伤模型。
SOD 和GSH-Px 是细胞内抗氧化物酶系统的重要组成部分。SOD 能催化超氧化物阴离子生成H2O2。GSH-Px 可以分解H2O2和过氧化物,清除细胞内脂质和有机过氧化反应的产物,阻断脂质过氧化连锁反应,达到保护细胞膜机构和功能完整的作用[12]。MDA 和LDH 是较为常用的细胞损伤评价指标。MDA 是机体内脂质过氧化产物,可以反映机体内脂质过氧化的严重程度。LDH 在细胞损伤后释放到周围环境中,能进一步证实细胞损伤。SOD、GSH-Px、MDA 和LDH 测定的联合应用既反映了机体清除氧自由基的能力,又间接反映了机体细胞受自由基攻击后损伤的严重程度。
Ed 是一种极强的自由基清除剂,能有效清除细胞内自由基,保护细胞氧化应激损伤。在本研究中选取了25、50、100 μM三个不同的浓度,研究证实随着Ed 剂量的增加,Ed 预处理对脊髓神经元氧化应激损伤的保护效应逐渐增强即存在剂量效应。但是由于本实验的主要目的是探讨Ed 预处理是否对脊髓损伤具有保护效应,所以继续增加Ed 剂量能否更有效的保护脊髓神经元氧化应激损伤并为进一步探索。LP 是一种开链式的不饱和类胡萝卜素,具有较强的抗氧化和清除自由基的能力,并且已被证明能有效保护神经细胞氧化应激损伤[13]。在本实验中使用LP 的目的是作为阳性对照,进一步说明LP 对脊髓神经元氧化应激损伤的保护作用[14]。实验结果表明LP 50 μM对脊髓神经元氧化应激损伤的保护作用与LP 的保护作用没有明显差异,但是依达拉奉100 μM 对脊髓神经元氧化应激损伤的保护作用则明显强于LP。
本研究以离体培养脊髓神经元为研究对象发现Ed 预处理可通过上调细胞内抗氧化物酶活性保护脊髓神经元氧化应激损伤[15]。Ed 预处理作为一种简易方便、安全有效的方法在临床上防治脊髓损伤可能将有较高的应用价值,但对其作用机制还有待进一步深入研究。
[1] Huang Guo-yang,Xu Jia-jun,Xu Li,et al.Hyperbaric oxygen preconditioning induces tolerance against oxidative injury and oxygen-glucose deprivation by up-regulating heat shock protein 32 in rat spinal neurons[J].PLoS One,2014,9(1):e85967.
[2] Juurlink BH,Paterson PG.Review of oxidative stress in brain and spinal cord injury:suggestions for pharmacological and nutritional management strategies[J].J Spinal Cord Med,1998,21(4):309.
[3] Norenberg MD,Smith J,Marcillo A.The pathology of human spinal cord injury:defining the problems[J].J Neurotrauma 2004,21(4):429.
[4] 李 晓,罗晨禹,杨 拯,等.番茄红素抗氧化应激效应对大鼠脊髓损伤后运动功能恢复的影响[J].中国康复理论与实践,2013,19(2):132.
[5] 边立功,刘承杏,李兴国,等.17-β 雌二醇提高巯醇抗氧化物(酶)治疗脊髓损伤的作用[J].解剖学报,2010,41(2):185.
[6] 洪 远,陈 盛,张建民.氢气对神经系统疾病治疗作用的研究进展[J].浙江大学学报(医学版),2011,39(6):638.
[7] Huang Guo-yang,Xu Wei-gang.Edaravone may be an efficacious adjunctive therapeutic agent for decompression sickness:an editorial perspective[J].Undersea Hyperb Med,2013,40(3):215.
[8] 杨 菲,李玉龙,黄秋菊,等.依达拉奉通过JNK 对大鼠离体心肌缺血再灌注损伤的保护作用[J].现代生物医学进展,2010,10(14):2619.
[9] Qu M,Li L,Chen C,et al.Protective effects of lycopene against amyloid beta-induced neurotoxicity in cultured rat cortical neurons[J].Neurosci Lett 2011,505(3):286.
[10] Li WG,Miller FJ,Zhang HJ,et al.H(2)O(2)-induced O(2) production by a non-phagocytic NAD(P)H oxidase causes oxidant injury[J].Journal of Biological Chemistry,2001,276(31):29251.
[11] 赵曙光,李 强,王旭霞,等.葡萄糖氧化酶诱导肝细胞氧化应激模型的建立[J].现代生物医学进展,2011,11(2):243.
[12] 王传鹏,杨 超,赵 骏,等.芹菜素对雄性小鼠肝脏SOD,GSH-Px,CAT 活力影响[J].中国实用医药,2013,8(6):21.
[13] Qu M,Zhou Z,Chen C,et al.Lycopene protects against trimethyltin-induced neurotoxicity in primary cultured rat hippocampal neurons by inhibiting the mitochondrial apoptotic pathway[J].Neurochem Int,2011,59(8):1095.
[14] 李朝旭.脑外伤急性期凝血功能变化及其与预后的关系[J].吉林医学,2009,30(23):3054.
[15] 李 园.营养支持在慢性阻塞性肺疾病中的治疗疗效观察[J].吉林医学,2011,32(12):2332.

