果糖基转移酶在酿酒酵母中异源表达及酶学性质分析*
王一恬,张玲,沈微,杨海麟
1(江南大学工业生物技术教育部重点实验室,江苏无锡,214122)2(江南大学 生物工程学院,江苏 无锡,214122)
低聚果糖(Fructooligosaccharide,FOS)是一类重要的低聚糖,进入人体消化道后,不会被胆汁、胃酸、消化酶等分解吸收,可直达大肠中。肠道益生菌如双歧杆菌、嗜酸性乳酸杆菌等可选择性利用低聚果糖,获得快速、大量繁殖,因此它是肠道益生菌的增殖因子[1-2]。果 糖 基 转 移 酶 (fructosyltransferase,EC 2.4.1.9,缩写FTase)可催化蔗糖分子果糖基上的β-(2,1)糖苷键,结合1~3个果糖基,生成低聚果糖。低聚果糖主要包括蔗果三糖(GF2)、蔗果四糖(GF3)和蔗果五糖(GF4)及其混合物等。果糖基转移酶的主要来源包括两方面:1)植物,如黑麦草、洋葱等[3-4];2)微生物,如真菌、细菌等[5-7]。植物来源的果糖基转移酶存在低含量等缺点,在低聚果糖工业生产中未被大规模采用。近年来,多种微生物(如丝状真菌、酵母、节杆菌等)来源的果糖基转移酶被逐步发现并得到研究,但主要集中在对产酶微生物的筛选、酶纯化、酶学性质等初步研究[8-10]。本文采用反转录PCR(RT-PCR),获得黑曲霉(Aspergillus niger)YZ59的果糖基转移酶基因成熟酶区域(不含内含子)。采用食品级表达宿主酿酒酵母(Saccharomyces cerevisiae)W3031A,成功异源表达了A.niger YZ59果糖基转移酶。纯化后,对其酶学性质进行分析与讨论。该研究对果糖基转移酶的异源表达及高纯度低聚果糖的工业化生产具有重要指导意义。
1 材料与方法
1.1 菌株与质粒
A.niger YZ59(CICIM F0901)保藏于中国高校工业微生物资源和信息中心;S.cerevisiae W3031A、大肠杆菌(Escherichia coli)宿主菌株JM109、质粒pYX212为本研究室保藏,其他质粒均为实验中构建。
1.2 培养基
LB培养基(g/L):蛋白胨10、酵母提取物5、NaCl 10;
SC-Ura培养基(g/L):酵母氮基6.7、葡萄糖20、亮氨酸 0.12、色氨酸 0.12、组氨酸 0.12、腺嘌呤0.12、琼脂 15;
YPD培养基(g/L):酵母提取物10、蛋白胨20、葡萄糖20。
1.3 果糖基转移酶基因克隆及重组质粒构建
采用反转录酶III试剂盒(Invitrogen 18080-051)进行RT-PCR,获得A.niger果糖基转移酶cDNA。将已获得的cDNA作为进一步PCR的模板。PCR引物序列为:上游5’-CCGGAATTCATGAAGCTTCAAACGGCTTC-3’;下游5’-CGCGGATCCTTAGTGATGATGATGATGAGACTGACGATCCGGCCA-3’。引物两端的限制性酶切位点(下划线)分别为:EcoR I与BamH I。
PCR产物和质粒pYX212均采用限制性内切酶EcoR I与BamH I进行酶切。采用连接酶,将酶切后的PCR产物和质粒pYX212进行连接,获得重组质粒pYX212-fwt,测序验证。采用电转化方法将重组质粒pYX212-fwt转化宿主S.cerevisiae W3031A,利用尿嘧啶缺陷型平板(SC-Ura培养基)筛选,获得产果糖基转移酶重组菌S.cerevisiae W3031A-pYX212-fwt。
1.4 酶液制备
在摇瓶(250 mL)中对重组菌 S.cerevisiae W3031A-pYX212-fwt进行培养,30℃发酵48 h后,4℃下,8 000×g离心10 min,获得菌体细胞。用相同体积的磷酸-柠檬酸缓冲液(pH 5.5)洗涤菌体细胞3次,再加入等体积的缓冲液混匀后,采用超声破碎仪破碎细胞。4℃下,10 000×g离心10 min,获得含有果糖基转移酶的上清液。
1.5 果糖基转移酶酶活测定
果糖基转移酶的测定是通过HPLC方法测定反应体系中蔗果三糖(GF2)的含量[11-12]。1个单位的果糖基转移酶酶活定义为:每分钟生成1 μmol GF2需要的酶量。
1.6 果糖基转移酶纯化
将“酶液制备”获得的含有果糖基转移酶的上清液,采用0.2 μm的膜过滤去除杂质。由于果糖基转移酶的C端含有His标签,实验中采用Ni2+柱纯化过滤后的酶液,蛋白纯化仪为AKTA(GE,USA)。缓冲液A为含有20 mmol/L咪唑的磷酸缓冲液(50 mmol/L,pH 7.4)。缓冲液B为含有250 mmol/L咪唑的磷酸缓冲液(50 mmol/L,pH 7.4)。流速为1.0 mL/min。基于线性洗脱(0~100% 缓冲液B),收集目的样品。
1.7 温度和pH对果糖基转移酶稳定性的影响
酶最适温度测定时的条件为:温度范围为30~70℃、底物为蔗糖、100 mmol/L磷酸-柠檬酸缓冲液(pH 5.5)。在不同温度下测定的最高酶活力设为100%。研究过程中,分析了酶在40、50、60℃条件下的温度稳定性。在各温度条件下,处理前的初始酶活力设为100%。
酶的最适pH是在不同pH条件下进行分析的,如pH3.0~8.0(磷酸-柠檬酸缓冲液,100 mmol/L)。在不同pH条件下测定的最高酶活力设为100%。酶pH稳定性测定的前处理条件为:不同pH缓冲液、25℃保温24 h。采用的缓冲液为:磷酸-柠檬酸缓冲液(100 mmol/L,pH 3.0~8.0)、磷酸缓冲液(100 mmol/L,pH 8.0~9.0)、甘氨酸-NaOH 缓冲液(100 mmol/L,pH 9.0~11.0)。在不同pH缓冲液处理条件下,测得的最高残留酶活力设为100%。
1.8 酶动力学参数测定
酶动力学参数测定条件为:磷酸-柠檬酸缓冲液(100 mmol/L,pH 5.5)、底物为蔗糖。底物浓度范围为20~250 g/L。动力学参数Km和Vmax均采用Lineweaver-Burk作图法进行计算。
1.9 金属离子对酶的影响
为分析金属离子对果糖基转移酶的影响,5 mmol/L 不同金属离子(K+、Li+、Ba2+、Na+、Ca2+、Fe3+、Zn2+、NH4+、Mn2+、Cu2+、Mg2+、Ni2+)分别添加到果糖基转移酶酶反应体系中。以不添加金属离子条件下测定的果糖基转移酶酶活力为100%。
2 结果与讨论
2.1 果糖基转移酶基因的克隆及重组载体构建
通过RT-PCR方式,获得来源于A.niger YZ59(CICIM F0901)的果糖基转移酶cDNA。以该cDNA为模板,进一步通过PCR方式获得不含内含子的果糖基转移酶成熟序列fwt。采用限制性内切酶EcoR I与BamHI进行酶切,纯化后,与质粒pYX212连接,获得重组质粒pYX212-fwt(图1)。

图1 重组质粒pYX212-fwt的构建Fig.1 Construction of recombinant plasmid pYX212-fwt
2.2 果糖基转移酶的表达
将重组质粒 pYX212-fwt转化 S.cerevisiae W3031A,基于尿嘧啶缺陷型平板筛选,获得产果糖基转移酶重组菌S.cerevisiae W3031A-pYX212-fwt。提取重组菌 S.cerevisiae W3031A-pYX212-fwt的基因组,以其为模板进行PCR验证,获得已重组果糖基转移酶基因的阳性S.cerevisiae重组子。
将阳性S.cerevisiae重组子接种YPD培养基,30℃发酵56 h(图2)。随着发酵的逐步进行,果糖基转移酶的产量逐渐增加,当发酵至48 h时,酶活达到最大,为19.8 U/mL。同时,随着发酵的不断进行,重组S.cerevisiae的菌体浓度也逐渐增加。当发酵至48 h时,菌体浓度达到最大,OD600=3.2。果糖基转移酶也有在其他非食品级表达宿主中进行异源表达的报道。例如,王玉海等将来源于米曲霉的果糖基转移酶基因在E.coli BL21(DE3)中实现了异源表达,25℃条件下,1.0 μmol/mL异丙基硫代半乳糖苷(IPTG)诱导后,果糖基转移酶酶活力达59.0 U/g[13]。

图2 重组菌S.cerevisiae W3031A-pYX212-fwt产酶曲线Fig.2 Time profiles of FWT production by recombinant S.cerevisiae W3031A-pYX212-fwt
2.3 温度对果糖基转移酶的影响
如图3A所示,果糖基转移酶FWT的最适反应温度为55℃。当反应温度低于55℃时,随着温度的逐渐升高,FWT的酶活力逐渐增加。在最适反应温度(55℃)条件下,FWT的酶活力是30℃下酶活力的2.3倍。但高于55℃时,随着反应温度的逐渐升高,FWT的酶活力迅速降低。70℃时,FWT的酶活力仅为55℃时酶活力的25.4%。对于果糖基转移酶FWT的热稳定性,分别分析了酶在40、50、60℃下的稳定性(图3B)。在40℃下,处理60 min,果糖基转移酶FWT基本不失活(酶活力残留95%),这说明其在该温度条件下稳定。在50℃下,处理60 min,果糖基转移酶FWT酶活力残留约为60%,这说明其在该温度条件下也较稳定。但果糖基转移酶FWT在60℃下,随着处理时间的延长,酶活力迅速下降,甚至完全失活。由以上结果可以看出,果糖基转移酶FWT具有良好的耐热性。据报道,来源于米曲霉(A·oryzae)ZZ-01的果糖基转移酶AoFT较果糖基转移酶FWT的最适反应温度偏低10℃,为45℃[8]。
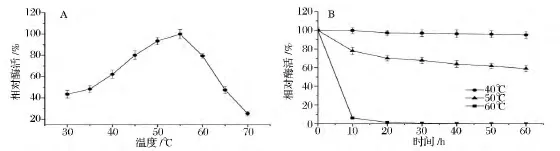
图3 温度对果糖基转移酶FWT酶活力和稳定性的影响Fig.3 Effect of temperature on the activity and stability of FWT
2.4 pH对果糖基转移酶的影响
果糖基转移酶FWT的最适pH为5.5(图4A)。当pH<5.5时(3.0~5.5),随着pH值的增加,果糖基转移酶FWT的相对酶活力逐渐增大。果糖基转移酶FWT在pH 5.5条件下的酶活力为pH 3.0条件下酶活力的4倍。但当pH5.5时,随着pH值的增加,果糖基转移酶FWT的相对酶活力迅速降低。如图4B所示,分析了果糖基转移酶FWT在pH 2.0~11.0条件下的稳定性。在pH 6.0条件下,果糖基转移酶FWT最为稳定。在pH 4.0~9.0条件下,果糖基转移酶FWT的稳定性较高(酶活残留90%)。由此可确定,果糖基转移酶FWT具有较宽的pH稳定范围。据报道,洋葱来源的果糖基转移酶FST-1在pH低于或高于5.5时,酶活力迅速降低,甚至完全失活[4]。

图4 pH对果糖基转移酶FWT酶活力和稳定性的影响Fig.4 Effect of pH on the activity and stability of FWT
2.5 果糖基转移酶的动力学参数
基于Lineweaver-Burk双倒数曲线,以蔗糖为反应底物,分别对果糖基转移酶FWT的米氏常数Km和最大反应速率Vmax进行分析。如图5所示,果糖基转移酶FWT的Km值和Vmax值分别为169.5 g/L和0.7 g/(L·min)。果糖基转移酶FWT的kcat值和kcat/Km值分别为9.8 ×103min-1和57.8 L/(g·min)。

图5 果糖基转移酶FWT的Lineweaver-Burk双倒数曲线Fig.5 Lineweaver-Burk plots for using sucrose as substrate by FWT
2.6 金属离子对果糖基转移酶的影响
为了分析金属离子对果糖基转移酶FWT酶活力的影响,测定了5 mmol/L浓度下不同金属离子(K+、Li+、Ba2+、Na+、Ca2+、Fe3+、Zn2+、NH4+、Mn2+、Cu2+、Mg2+、Ni2+)对酶活力的影响关系。如图6所示,果糖基转移酶FWT可显著被Ni2+和Mg2+激活。添加5 mmol/L Ni2+和Mg2+时,果糖基转移酶FWT的酶活力分别为对照的112.3%和106.3%。同时,5 mmol/L K+和Fe3+也对果糖基转移酶FWT有一定的激活作用。5 mmol/L Ba2+和Cu2+对果糖基转移酶FWT具有显著的抑制作用。金属离子可以影响酶结构的正确折叠,进而影响酶的酶活力。不同金属离子对果糖基转移酶酶活力具有不同的激活或抑制作用。例如,Ca2+可激活来自莴苣的果糖基转移酶,但其活性却受Zn2+和 Cu2+的抑制[14]。

图6 金属离子对果糖基转移酶FWT酶活力的影响Fig.6 Effect of metal ions on the activity of FWT
3 结论
本研究通过RT-PCR获得了A.niger来源的果糖基转移酶基因,成功在S.cerevisiae中实现了异源表达,并对纯化后酶学性质进行了测定、分析。果糖基转移酶在S.cerevisiae中无需诱导即可进行异源表达,发酵48 h后,最高酶活力可达19.8 U/mL。对该重组果糖基转移酶FWT的性质进行研究发现,酶的最适反应温度为55℃,酶在低于50℃的条件下稳定。果糖基转移酶FWT的最适pH为5.5,具有较宽的pH稳定范围。果糖基转移酶 FWT的 Km、Vmax、kcat、kcat/Km分别为 169.5 g/L、0.7 g/(L·min)、9.8×103min-1、57.8 L/(g·min)。Ni2+和 Mg2+可显著激活果糖基转移酶FWT。S.cerevisiae作为食品级表达宿主,具有食品安全等优点,后期将对S.cerevisiae高效生产重组果糖基转移酶进行进一步调控与优化研究。
[1] Ganaie M A,Rawat H K,Wani Q A,et al.Immobilization of fructosyltransferase by chitosan and alginate for efficient production of fructooligosaccharides[J].Process Biochemistry,2014,49(5):840 -844.
[2] Aguiar-Oiveira E,Maugeri F.Effects of the addition of substrate and salts in both the fructosyltransferase immobilization and its catalytic properties[J].Journal of Food Biochemistry,2013,37(5):520 -527.
[3] Rasmussen S,Parsons A J,Xue H,et al.Transcript profiling of fructan biosynthetic pathway genes reveals association of a specific fructosyltransferase isoform with the high sugar trait in Lolium perenne[J].Journal of Plant Physiology,2014,171(7):475 -485.
[4] HAN Y W,CHEN L P,MAO D B,et al.Expression and activity analysis of sucrose:sucrose 1-fructosyltransferase from onion[J].New Biotechnology,2010,27(4):324 -329.
[5] Alvarado-Huallanco M B,Maugeri F F.Kinetic studies and modelling of the production of fructooligosaccharides by fructosyltransferase from Rhodotorula sp.[J].Catalysis Science & Technology,2011,1(6):1 043 -1 050.
[6] Onderkova Z,Bryjak J,Vankova K,et al.Kinetics of thermal inactivation of free Aureobasidium pullulans fructosyltransferase[J].Enzyme and Microbial Technology,2010,47(4):134-139.
[7] Almeciga-Diaz C J,Gutierrez A M,Bahamon I, et al.Computational analysis of the fructosyltransferase en-zymes in plants,fungi and bacteria[J].Gene,2011,484(1-2):26-34.
[8] WEI T,YU X,WANG Y Y,et al.Purification and evaluation of the enzymatic properties of a novel fructosyltransferase from Aspergillus oryzae:a potential biocatalyst for the synthesis of sucrose 6-acetate[J].Biotechnology Letters,2014,36(5):1 015 -1 020.
[9] Aguiar-Oliveira E,Maugeri F.Effects of lyophilization on catalytic properties of immobilized fructosyltransferase from Rhodotorula sp.LEB-V10[J].Food and Bioproducts Processing,2013,91(C4):609 -616.
[10] Kikuchi H,Inoue M,Saito H,et al.Industrial production of difructose anhydride III(DFA III)from crude inulin extracted from chicory roots using Arthrobacter sp.H65-7 fructosyltransferase[J].Journal of Bioscience and Bioengineering,2009,107(3):262 -265.
[11] Arrizon J,Morel S,Gschaedler A,et al.Fructanase and fructosyltransferase activity of non-Saccharomyces yeasts isolated from fermenting musts of Mezcal[J].Bioresource Technology,2012,110:560 -565.
[12] Salinas M A,Perotti N I.Production of fructosyltransferase by Aureobasidium sp.ATCC 20524 in batch and two-step batch cultures[J].Journal of Industrial Microbiology& Biotechnology,2009,36(1):39-43.
[13] 张毅,王岳,王林.编码米曲霉果糖基转移酶基因在大肠杆菌中的重组表达[J].现代食品科技,2014,30(9):67-73.
[14] 李慧娟,邵先祥,孙云鹏,等.蔗糖:蔗糖-1-果糖基转移酶的表面展示及酶学性质分析(英文)[J].微生物学通报,2014,41(11):2 190 -2 197.

