三转基因银屑病小鼠模型建立与表型分析
高 祥,刘 宁,葛文萍,潘 烁,张海涛,张连峰,董 伟
(北京协和医学院,中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021)
三转基因银屑病小鼠模型建立与表型分析
高 祥,刘 宁,葛文萍,潘 烁,张海涛,张连峰,董 伟
(北京协和医学院,中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021)
目的尿激酶型纤溶酶激活剂(PLAU)、尿激酶型纤溶酶激活剂受体(PLAUR)和信号传导与转录激活因子3(STAT3)是参与银屑病病理发生的重要基因。本文目的是制备皮肤特异性表达PLAU、PLAUR和STAT3三种基因的转基因小鼠,建立可进行性再现银屑病病理进程的小鼠模型。方法将PLAU、PLAUR和STAT3基因分别插入牛角蛋白5启动子(BK5)下游,构建转基因表达载体,通过显微注射法建立在皮肤组织同时高表达PLAU、PLAUR和STAT3三种基因的转基因C57BL/6J小鼠。利用PCR法鉴定转基因小鼠的基因型,Western blot检测基因表达水平,HE染色观察皮肤病理表型。结果 PLAU、PLAUR和STAT3三种基因在选定的转基因小鼠皮肤组织均有明显表达;转基因小鼠与同龄野生型小鼠相比表皮状态差,炎症明显;4月龄的转基因小鼠真皮变簿,表皮过度角化、棘层增厚,毛囊减少、发育异常、部分毛囊内未见毛干,角化不全区域内可见Munro氏小脓肿,真皮炎细胞浸润。结论建立了稳定传代的皮肤特异性表达PLAU、PLAUR和STAT3基因的转基因小鼠品系,转基因小鼠具有进行性的银屑病表型,可以作为多病因综合银屑病小鼠模型。
银屑病;信号传导与转录激活因子3;尿激酶型纤溶酶激活剂;转基因小鼠
银屑病(牛皮癣,psoriasis)是一种以表皮过度增生和真皮慢性炎症反应为特征的常见皮肤病。白色人种发病率较高约为2%~5%,黄种人发病率较低约为0.5%,难根治,易复发。目前发病原因不明,与呼吸道感染,胃炎,饮食习惯,精神紧张、忧虑,不当使用激素药物等有关。有两方面的病理特征,一方面是真皮慢性炎症反应,包括T细胞、中性粒细胞浸润,炎症因子:比如IL-1β、TNF-α、IL-6、IL-23分泌增加等[1-2]。另一方面,是表皮过度增生,包括一些与表皮增生相关的血纤维蛋白溶酶原激活因子(tPA),双调蛋白(AREG)等高表达[3-4]。银屑病是人类特有的一类疾病,在动物中少见,银屑病动物模型的制作主要采用化学制剂诱导,基因修饰或组织移植等方式制备,可以在一定程度上模拟银屑癣的病理表型、慢性炎症等[4-7],但是各有优缺点,银屑病药物评价需要一种既有表皮过度增生因素又有慢性炎症因素参与的多病因动物模型的研发。
信号传导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)是STAT转录因子家族的一员,JAK/STAT信号通路是大部分细胞因子,包括IL2、IL7、IL12、IL10、IL21等发挥生物学作用的核心通路,STAT3调控CD4+T细胞、CD8+T细胞、Th17、Treg细胞和B细胞等多种淋巴细胞的分化与成熟,与炎症关系密切[8]。STAT3参与皮肤伤口的愈合、角质细胞迁移、毛囊生长、抵抗皮肤的放射损伤等,皮肤转基因表达活化的STAT3可引发类似银屑病的病变,而抑制STAT3表达可以改善银屑病症状[9],推测,STAT3参与表皮过度增生和真皮慢性炎症过程,也是重要的治疗靶点之一。
血纤维蛋白溶酶原,血纤维蛋白溶酶,抑制因子,激活因子细胞受体是一个多基因成员参与的体系,调节细胞外基质的水解与细胞外基质信号,参与血管生成、肿瘤发生、皮肤发育等多种过程[10]。尿激酶型纤溶酶激活剂(plasminogen activator,urokinase,PLAU)是多种血纤维蛋白溶酶原的激活因子,PLAU和 PLAU受体(plasminogen activator,urokinase receptor,PLAUR,)也叫做UPAR或CD87,都在皮肤组织表达[11-12]。PLAU/PLAUR表达升高可能是银屑病发生的重要原因[12]。
本文利用转基因技术,将 STAT3、PLAU和PLAUR同时转入小鼠基因组,建立皮肤特异表达三种基因的转基因小鼠,小鼠表现毛囊发育异常、表皮过度增生和慢性炎症,可以作为多病因综合小鼠银屑病。
1 材料和方法
1.1 人PLAU,PLAUR及鼠STAT3三种表达载体的构建及转基因
人PLAU,PLAUR及鼠STAT3三个基因的cDNA购买自Origene公司,用PCR的方法克隆三种基因的开放阅读框,并在两端引入酶切位点KpnⅠ(宝生物工程有限公司中国)和EcoRV(宝生物工程有限公司中国),插入pMD-18T Simple Vector(宝生物工程有限公司中国),测序证实序列正确。以KpnⅠ和EcoRV进行酶切回收三种基因片段,均插入牛角蛋白5(bovine keratin 5)启动子下游构建人PLAU,PLAUR及鼠STAT3三种表达载体。构建成功后,再用SalⅠ(宝生物工程有限公司中国)将其线形化。调整转基因片段浓度至4 ng/μL,用显微注射法(TE2000-U显微注射仪)将线性化的三种混合后的转基因载体注射到C57BL/6J小鼠的受精卵中,制备三转基因小鼠[13]。C57BL/6J小鼠购自北京维通利华生物技术有限公司【SCXK(京)2014-0001】。实验室使用许可【SYXK(京)2013-0004】。实验中涉及动物的操作程序已经得到中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准,批准号为ILAS-GC-2015-002。
1.2 PCR鉴定三转基因小鼠的基因型
转基因小鼠在9~14日龄时用剪趾法标记,收集剪下的组织,用碱裂解法提取基因组DNA,利用特异引物通过PCR法进行检测。PCR反应条件:鼠尾DNA模板10~100 ng,PLAU基因上游引物5’GGGCAGCACTGTGAAATAGATAAG下游引物为5’CCCAGGTAGACGATGTAGTCCTC;PLAUR基因上游引物为5’GATTGCCGTGTGGAAGAGTG下游引物为5’TCAGGAAGTGGAAGGTGTCG;STAT3基因上游引物为5’GAGAGTCAAGACTGGGCATATGC下游引物为5’CCAGCTCACTCACAATGCTTCTC。PCR反应体系20 μL(试剂购自宝生物工程有限公司,中国)。反应条件:94℃预变性3 min,94℃变性30 s,60℃退火30 s,72℃延伸30 s,30个循环。目的基因片段分别为 PLAU基因545 bp,PLAUR基因475 bp,STAT3基因550 bp。
1.3 Western blot检测鉴定三种基因的表达
提取三转基因小鼠与同龄野生型小鼠皮肤总蛋白,进行SDS-PAGE凝胶电泳,蛋白转移至NC膜上(Millipore美国),置于5%脱脂奶粉封闭液,分别用兔抗人PLAU抗体(Abcam)、兔抗人PLAUR抗体(Abcam)、鼠抗鼠STAT3抗体(Cell Signaling)检测基因的表达水平。采用辣根过氧化物酶(Hrp)-耦联的羊抗兔抗体和羊抗鼠抗体结合一抗(Pierce,USA),用Hrp-耦联的鼠抗β-actin单克隆抗体做为内参(康成生物,中国)。
1.4 转基因小鼠与同龄野生型小鼠的大体观察
选用同龄同性别的转基因阳性小鼠和野生型小鼠,SPF级动物房,同等条件正常饲养,定期观察两组小鼠表皮毛发生长情况,并拍照记录。
1.5 HE染色观察4月龄转基因小鼠与同龄野生型小鼠的皮肤组织
选用4月龄的转基因阳性和同龄野生小鼠,取小鼠背部及腹部皮肤,固定在10%中性甲醛中48 h,进行修块、脱水、包埋、切片、HE染色和镜下观察(Nikon显微镜,日本和 Leica MZ16F体视镜,德国)[14]。
2 结果
2.1 人PLAU,PLAUR及鼠STAT3三种基因表达载体的构建
用PCR克隆的人PLAU,PLAUR及鼠STAT3基因,测序结果表明同已报道的序列完全一致(PLAU Gene ID:5328,NM-002658;PLAUR Gene ID:5329,NM-002659;STAT3 Gene ID:20848,NM-011486;)。将三种基因分别插入皮肤特异的表达启动子BK5下游,构建人PLAU,PLAUR及鼠STAT3基因三种转基因载体(图1)。
2.2 三转基因小鼠基因型的鉴定
用显微注射法将线性化的转基因载体注射到C57BL/6J小鼠的受精卵中,转入到假孕受体ICR小
鼠中,小鼠出生后9~14 d提取基因组DNA,用PCR扩增目的基因片段来检测转基因小鼠,三种目的基因片段分别为PLAU基因545 bp,PLAUR基因475 bp,STAT3基因550 bp(图2),共得到3只首建鼠均可传代。
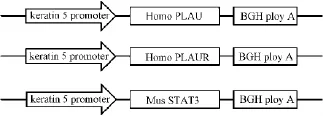
图1 人PLAU,PLAUR及鼠STAT3基因转基因表达载体Fig.1 PLAU,PLAUR,STAT3 transgenic construct

图2 PCR鉴定转基因小鼠基因型Note:P,positive control;N,negative control;W,blank control; M,DNA molecular weight marker;Lane 1,4,7 the positive transgenic mice;Lane 2,3,5,6,8 negative.Fig.2 Genotyping the transgenic mice by PCR
2.3 人PLAU,PLAUR及鼠STAT3三种基因的表达
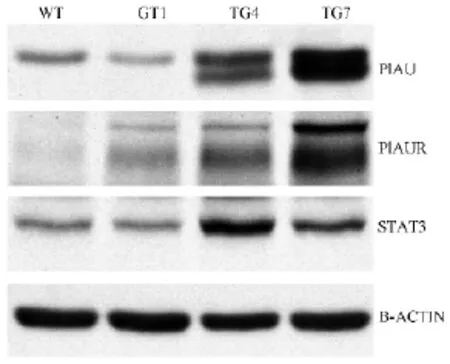
首先用Western blot分析3个系1月龄的转基因小鼠皮肤中人PLAU,PLAUR及鼠STAT3的表达情况,结果显示三种蛋白在皮肤中均有表达,表达量各有差别(图3),选取三种基因均有较高表达水平的TG7保种繁殖,并进行下一步实验。
2.4 转基因小鼠与同龄野生型小鼠表皮差异
先用Western blot结果显示TG4皮肤中主要高表达PLAU和STAT3,而TG7皮肤中PLAU,PLAUR和STAT3均高表达。和TG4小鼠比较TG7小鼠表型更明显,说明三种基因同时表达对病理发生是关键。TG7小鼠在1月龄就表现腹部毛发稀疏,无光泽,表皮粗糙,至4月龄表现典型腹部皮肤红肿和炎症(图4)。皮肤炎症主要表现在腹部,背部表型不明显。除皮炎表型外,小鼠生育和发育无异常。
注:WT:野生型小鼠;TG1、TG4、TG7:转基因小鼠;内参:β-actin。

图4 转基因小鼠表皮表型Fig.4 The phenotype of the transgenic mouse
2.5 皮肤病理表型(图见彩插1)
选用4月龄的转基因阳性和同龄野生小鼠,采取颈椎脱臼法牺牲,取背部及腹部皮肤,HE染色,镜下观察显示,转基因小鼠真皮变簿(图5A),表皮过度角化和棘层增厚(图5B),毛囊减少和发育异常,部分毛囊内未见毛干(图5C),角化不全区域内可见中性白细胞构成的小脓肿(Munro氏小脓肿)和真皮炎细胞浸润((图5D)。
3 讨论
真皮慢性炎症反应和表皮过度增生是银屑病的2个典型的病理特征,参与银屑病的病理发生因素很多,如T细胞、中性粒细胞浸润,炎症因子分泌增加[1-2],一些与表皮增生相关的因子表达增多,如tPA,AREG,STAT3,PLAU,PLAUR[3-4,11-12]。利用一些具有刺激和损伤作用的化学物质对动物皮肤进行处理,比如,可以用 10%十二烷基硫酸钠(SDS)涂抹小鼠背部皮肤造成银屑病样体征,但是这种模型一方面病理发生机制与银屑病病理发生机制差别较大,主要局限于病理表型的模仿;另一方面,在移出化学物质后,动物会自行痊愈,没有渐进性的特点,留给药物治疗的观察时间也比较短。通过转基因的方式在皮肤局部表达参与银屑病发生的一些基因,可以在病因和病理发生过程方面更好的模仿银屑病。针对参与银屑病发生的一些基因单独转基因有时候并不能引发皮肤银屑病样体征,比如,Wnt5a基因在银屑病发病过程高表达,但是在皮肤转基因表达Wnt5a只观察到毛囊发育异常,而没有银屑病样体征[15]。所以,将多种相关基因一起转基因可以整合多种病因的作用,更真实的模仿银屑病。
PLAU,PLAUR和STAT3都是参与银屑病病理发生的重要基因[9,11-12]。牛角蛋白 5启动子(BK5)是常用的皮肤组织特异表达的启动子[16]。本文利用BK5启动子驱动PLAU,PLAUR和STAT3的表达,建立了在皮肤中同时表达这三种基因的转基因小鼠(图1-3)。和野生型小鼠相比,转基因小鼠在1月龄就表现腹部毛发稀疏,无光泽,表皮粗糙,至4月龄表现典型腹部皮肤红肿和炎症(图4)。转基因小鼠真皮变簿,表皮过度角化和棘层增厚,毛囊减少和发育异常,角化不全区域内可见中性白细胞构成的Munro氏小脓肿和真皮炎细胞浸润(图5)。转基因小鼠在病因、炎症和皮肤损伤三方面都能表现银屑病特征,并且具有累进性的特点,可以作为多病因综合银屑病小鼠模型。
[1]Tokura Y1,Mori T,Hino R.Psoriasis and other Th17-mediated skin diseases[J].JUOEH.2010 Dec 1;32(4):317-28.
[2]Yamamoto M,Nakajima K,Takaishi M,et al.Psoriatic inflammation facilitates the onset of arthritis in a mouse model[J].J Invest Dermatol.2015,135(2):445-53.
[3]Airola K1,Reunala T,Salo S,et al.Urokinase plasminogen activator is expressed by basal keratinocytes before interstitial collagenase,stromelysin-1,and laminin-5 in experimentally induced dermatitis herpetiformis lesions[J].J Invest Dermatol.1997,108(1):7-11.
[4]CookPW,Piepkom M,Clegg CH,et al.Transgenic expression of the human amphiregulin gene induces a psoriasis-like phenotype[J].J Clin Invest.1997,100:2286-2294.
[5]Zhu X,Wu Y,Huang S C,et al.Overexpression of Wnt5a in mouse epidermis causes no psoriasis phenotype but an impairment of hair follicle anagen development[J].Exp Dermatol.2014,23 (12):926-8.
[6]Schön M,Behmenburg C,Denzer D,et al.Pathogenic function of IL-1 beta in psoriasiform skin lesions of flaky skin(fsn/fsn) mice[J].Clin Exp Immunol.2001,123(3):505-10.
[7]Nickoloff BJ,Kunkel SL,Burdick M,et al.Severe combined immunodeficiency mouse and human psoriatic skin chimeras.Validation of a new animal model[J].Am J Pathol.1995,146 (3):580-8.
[8]Kane A,Deenick EK,Ma CS,et al.STAT3 is a central regulator of lymphocyte differentiation and function[J].Curr Opin Immunol.2014,28(6):49-57.
[9]Sano S1,Chan KS,DiGiovanni J.Impact of Stat3 activation upon skin biology:a dichotomy of its role between homeostasis and diseases[J].J Dermatol Sci.2008 Apr;50(1):1-14. Epub 2007 Jul 2.
[10]Montuori N,Ragno P.Role of uPA/uPAR in the modulation of angiogenesis[J].Chem Immunol Allergy.2014;99:105-22.
[11]Gao Q1,Fu G,Huang G,et al.Relationship between urokinase plasminogen activator receptor(uPAR)and the invasion of human prenatal hair follicle[J].Arch Dermatol Res.2010,302 (6):409-18.
[12]Jensen PJ,Baird J,Belin D,et al.Tissue plasminogen activator in psoriasis[J].J Invest Dermatol.1990,95(5):13S-14S.
[13]路迎冬,张旭,马婧,等.Sleeping Beauty转座酶转基因小鼠模型的建立[J].中国比较医学杂志.2013,23(10):7-12.
[14]张丽,关菲菲,张旭,等.瘦素基因敲除肥胖大鼠的血糖及病理长期观察[J].中国比较医学杂志.2014,24(3):45-49.
[15]Omoto D,Yamaguchi T,Haruyama S.et al.Is Wnt5a overexpression sufficient for generating a psoriasis-like phenotype in transgenic mice?[J].Exp Dermatol.2015,24(3):183-4.
[16]Diamond I,Owolabi T,Marco M,et al.Conditional gene expression in theepidermisoftransgenicmiceusing the tetracycline-regulated transactivators tTA and rTA linked to the keratin 5 promoter[J].J Invest Dermatol.2000,115(5):788-94.
Establishment of the psoriasis transgenic mouse model and analysis of the phenotype
GAO Xiang,LIU Ning,GE Wen-ping,PAN Shuo,ZHANG Hai-tao,ZHANG Lian-feng,DONG Wei
(Key Laboratory of Human Disease Comparative Medicine,Ministry of Health;Institute of Laboratory Animal Science,Chinese Academy of Medical Sciences and Comparative Medical Center,Peking Union Medical College,Beijing 100021,China)
Objective To develop a model that could copy the pathological development of psoriasis,the tripletransgenic mice that harboring Plasminogen activator,urokinase(PLAU),PLAU receptor(PLAUR)and signal transducer and activator of transcription 3(STAT3)were generated.They are the important genes involved in the pathological development of psoriasis.Methods The transgenic plasmid was constructed by insertion of the PLAU,PLAUR and STAT3 into the downstream bovine keratin 5 promoter respectively.The transgenic mouse was produced by microinjection and the genotyping was detected by PCR.The expression level of the transgenic gene was determined by Western blotting.The pathological changes were observed by HE staining.Results One mouse line was selected with over expression of the PLAU,PLAUR and STAT3 in the tissue of skin.The transgenic mice showed decreased dermal layer,a hyperkeratinized cuticular layer and increased stratum spinosum.The number of hair follicle was reduced and developed abnormally in the transgenic mice.The Munro abscess in the dermal layer and the increased inflammatory cell infiltrates in dermal layer werealso observed in the transgenic mice.Conclusions A transgenic mouse line was produced and passage stably,which expressed the PLAU,PLAUR and STAT3 in the tissue of skin and developed the psoriasis progressively.All of our results suggested that the transgenic mice were a useful animal model for psoriasis.
Psoriasis;Signal transducer and activator of transcription 3;Plasminogen activator urokinase; Transgenic mice
R-332
A
1671-7856(2015)07-0011-05
10.3969.j.issn.1671.7856.2015.007.003
国家科技支撑计划课题“基因工程大鼠模型的研发与示范”(2014BAI02B01)。
2015-06-05

