中药藤莓汤对Ⅱ型胶原诱导性大鼠关节炎性病理损伤的影响
陆 妍,王亚南,刘 慧,马卫国,张继胜,谭 玲,李慧慧,林子超,沈志明,王 洁,孟凤仙
(1.北京中医药大学东方医院风湿科,北京 100078;2.昌平区中西医结合医院脑病科,北京 102208;3.密云县中医院风湿科,北京 101500)
中药藤莓汤对Ⅱ型胶原诱导性大鼠关节炎性病理损伤的影响
陆 妍1,王亚南1,刘 慧1,马卫国1,张继胜1,谭 玲2,李慧慧3,林子超1,沈志明1,王 洁1,孟凤仙1
(1.北京中医药大学东方医院风湿科,北京 100078;2.昌平区中西医结合医院脑病科,北京 102208;3.密云县中医院风湿科,北京 101500)
目的探讨中药藤莓汤对Ⅱ型胶原诱导性关节炎(collagen-induced arthritis,CIA)大鼠关节滑膜炎症指数、四肢肿胀程度、关节组织炎性浸润的改善情况,以及免疫炎性相关因子影响。方法 建立CIA模型,将造模成功的SD大鼠随机分为模型组、阳性药组、中药大、小剂量组,设正常对照组,每组6只,干预治疗12周。每周使用游标卡尺测量四肢踝腕部前后径、左右径,爪掌足垫厚度,以及双后肢的跖关节肿胀最高点宽度,评价其关节积分和四肢肿胀程度。结果 ①与正常组比较,模型组大鼠关节炎总AI评分及双后肢AI评分显著增加(P<0.05或P<0.01);左前肢AI评分在10-12周时升高(P<0.05);左后肢前后径、左右径、足垫厚度及左后肢跖骨最高点测量值在1-12 w不同时间段增加(P<0.05或P<0.01)。与模型组比较,中药大、小剂量组总AI评分及左后肢关节AI评分在6 w后降低(P<0.05);阳性药组10-12 w时左前肢AI评分下降(P<0.05)。②与正常组比较,模型组IL-6、TNF-α mRNA转录及蛋白表达水平显著上调(P<0.01)。与模型组比较,阳性药组、中药大、小剂量组IL-6、TNF-α mRNA转录及蛋白表达水平显著下调(P<0.01)。③光镜检测结果显示:中药小剂量组明显改善了CIA模型大鼠关节滑膜增生、炎性细胞浸润情况。结论 中药藤莓汤改善CIA模型大鼠关节病理损伤的分子机制可能与其抑制滑膜组织免疫炎性因子高表达相关。
中药藤莓汤;CIA模型;AI积分;病理改变;免疫炎性机制
类风湿关节炎(rheumatoid arthritis,RA)是以关节滑膜慢性炎症为主要表现的高致残性、炎症性自身免疫性疾病,最终导致关节畸形和功能丧失。因此,寻找靶向治疗对策,是目前国际医学领域研究的热点。本实验采用牛Ⅱ型胶原和完全弗氏佐剂联合应用建立CIA大鼠模型,通过对大鼠一般情况观察、体重分析、四肢关节AI积分评价、四肢肿胀程度的分析、关节组织病理学检测,以及相关炎性因子的检测,讨论有良好临床疗效基础的中药藤莓汤对CIA模型大鼠的关节滑膜免疫炎性病理损伤的改善及分子机制,探讨中医药治疗RA的作用环节。
1 材料和方法
1.1 实验动物和实验环境
SPF级雄性SD大鼠90只,体重(200~220)g,购自北京维通利华实验动物技术有限公司(实验动物生产许可证号:SCXK(京)2012-0001)。北京中医药大学动物实验室实验动物使用许可证号:SYXK(京)2011-0024。
1.2 仪器与试剂
试剂:牛源性Ⅱ型胶原蛋白(bovine type II collagen,CII),购自Chondre公司(Lot130087);完全弗氏佐剂(Freund’s complete adjuvant,FCA),购自Sigma公司(CAS 9007-81-2);大鼠 IL-6、TNF-α ELISA试剂盒购自eBioscience公司;Trizol提取总RNA试剂为Invitrogen公司产品,批号:66007;One Step SYBR RT-PCR Kit为Takara公司产品,批号:BK1401;GAPDH、目标基因上下游引物均为美国invitrogen(上海)英骏生物技术有限公司合成。仪器:Applied Biosystems 7500型定量PCR仪,美国应用生物系统(ABI)公司;TC-96/G/H(b)梯度PCR仪,博日科技有限公司;HC-3018R高速冷冻离心机,中科中佳公司;RT-6000型酶标仪,深圳雷杜公司产品;超净工作台(SW-CJ-IFD)。
1.3 实验药物
中药藤莓汤(忍冬藤30 g,蛇莓15 g,乌蛇10 g,白芥子10 g,乳香10 g,没药10 g,桑枝30 g,穿山龙30 g等),由北京中医药大学东方医院药剂科制剂室提供。来氟米特片(苏州长征-欣凯制药有限公司,国药准字H20000550)。
1.4 造模及分组
1.4.1 牛Ⅱ型胶原与完全弗氏佐剂混合乳剂的配制(浓度为1 mg/mL):取114 μL冰醋酸放置于50 mL离心管,加20 mL灭菌注射用水,配成0.1 mol/L冰醋酸溶液,4℃冰箱降温。将15 mL醋酸加入30 mg C II冻粉中使胶原完全溶解,4℃避光过夜。次日取已配制好的牛C II冰醋酸溶液及FCA各15 mL,用自制乳化器(输液器胶管连接2个注射器)在冰浴条件下将其完全乳化。4℃避光储存备用。
1.4.2 造模方法:初次免疫时(0 d),于造模组大鼠尾根部皮内注射200 μL C和FCA的混合乳剂(含C II 200 μg)。加强免疫时(初次免疫后第9天),于大鼠尾根部皮内注射100 μL C II和FCA的混合乳剂(含C II 100 μg),正常对照组注射等体积的生理盐水。16 d(初次免疫后1周)时对CIA大鼠模型进行评价,用游标卡尺测量肿胀部位具体数值以平价四肢肿胀程度,进行关节AI评分。
1.4.3 模型评价标准[1,2]及成模数量 :关节炎模型评价标准:0分,正常。1分,明显可见的腕/踝关节轻度肿胀或局限于单个关节肿胀或少数几个关节受累。2分,中度的腕/踝关节肿胀,仅局限于单个腕/踝关节,不累及其他指间关节。3分,严重的腕/踝关节肿胀,累及足爪(足背及掌指/跖趾关节)。4分,整个肢体肿胀累及多个关节。AI评分≥4分者视为模型成功。本实验84只造模组大鼠中70只模型成功,成模率为83.3%。
1.4.4 实验分组:随机抽取造模成功大鼠30只,分为模型组,阳性药物组,中药大剂量组,中药小剂量组,每组各6只,另设正常对照组6只。
1.5 干预方法
正常组与模型组予蒸馏水10 mL/kg﹒d灌胃。阳性药组予来氟米特灌胃,剂量为1.87 mL/kg﹒d。中药大剂量组按照生药量31.8 mL/kg﹒d灌胃给药。中药小剂量组按照生药量15.9 mL/kg﹒d灌胃给药。各药物组中药量相当于临床常人等公斤体重用量的5.6倍。干预治疗12周。
1.6 观察指标
1.6.1 CIA模型大鼠关节炎指数(Arthritis index,AI)变化:干预治疗后每周进行AI评分,观察关节炎指数变化情况。
1.6.2 CIA模型大鼠四肢肿胀程度的改善情况:使用游标卡尺测量大鼠双前肢足垫厚度,腕横纹部与掌面垂直的厚度(前后径),腕横纹部尺桡外点的厚度(左右径),双后肢的足垫厚度,踝的背部横纹到足跟处的厚度(前后径),踝部内外侧高点的厚度(左右径)。为了更好地评估关节肿胀程度,加设了跖骨肿胀最高的部分垂直足垫的厚度(跖骨高点)。
1.6.3 CIA模型大鼠滑膜组织相关炎性因子的检测:1.6.3.1 RT-PCR技术检测CIA模型大鼠滑膜组织IL-6、TNF-αmRNA转录水平:取CIA模型大鼠关节滑膜组织,使用Trizol试剂提取RNA后,进行一步法RT-PCR反应,检测TNF-α、IL-6水平。反应体积为25 μL,反应体系含样本RNA 2 μL,10 pmol引物各0.8 μL。TNF-α、IL-6基因序列:针对TNF-α基因序列的上下游引物分别是:5-GGATCTCAAAGA CAACCAAC-3和5-ACAGAGCAATGACTCCAAAG-3;针对 IL-6基因序列的上下游引物分别是:5-CCCTGACTGGCTAAAGGACA-3和5-CAGTACAGCC GCCTTCT AGG-3;针对看家基因GAPDH基因序列的引物分别是:5-CCCATCTATGAGGGTTACGC-3和5-TTTA ATGTCACGCACGATTTC-3。扩增条件为:42℃灭活5 min,95℃变性10 s,95℃ 退火5 s,60℃延伸34 s,共40个循环。反应结束后进行熔解曲线分析,以鉴定PCR产物的特异性。使用SDS软件分析 RT-PCR过程各检测样本的 Ct(threshold of cycle)值。
1.6.3.2 ELISA技术检测CIA模型大鼠关节滑膜组织IL-6、TNF-α蛋白表达水平:取出试剂盒,按按试剂盒说明操作。用酶标仪测定450 nm处各孔的吸光值,阳性反应的最大稀释度为待测样品的效价。1.6.4 CIA模型大鼠右踝关节组织病理学变化:干预治疗12周后,观察各组大鼠右踝关节的病理学变化。将固定好的右踝关节取材、脱钙后,流水冲洗数小时,经梯度乙醇脱水,二甲苯透明,石蜡包埋后,4 μm切片,进行HE染色,光镜观察关节滑膜被覆上皮有无变性、增生,间质有无炎细胞浸润及肉芽组织形成;关节周围软组织有无炎细胞浸润或纤维化。
1.7 统计学方法
2 结果
2.1 中药藤莓汤对CIA模型大鼠关节AI积分的影响
2.1.1 大鼠关节总AI积分变化:与正常组比较,模型组大鼠关节总AI积分在0~12周显著增加(P<0.05或P<0.01)。与模型组比较,阳性药组在10周时关节总AI积分明显降低,具有显著差异(P<0.01);中药大剂量组在6周~11周时AI分值明显下降(P<0.05或P<0.01);中药小剂量组在6周、8周、9周、10周时关节总AI积分降低(P<0.05或P<0.01)(表1)。
2.1.2 大鼠左前肢及左后肢AI积分变化:与正常组比较,模型组左前肢AI积分10周-12周时明显升高(P<0.05)。左后肢AI积分在1周~11周时升高,有显著性差异(P<0.05或P<0.01)。与模型组比较,阳性药组左前肢AI积分10周-12周显著降低(P<0.05);左后肢AI积分在10周时明显下降(P<0.01)。中药大剂量组左前肢AI积分在10周~12周显著降低(P<0.05);左后肢AI积分6周~11周时下降(P<0.05或P<0.01);中药小剂量组左后肢AI积分6周、8周~11周时降低(P<0.01)(表2,3)。
表1 各组大鼠关节总AI变化(±s,n=6)Tab.1 Changes of arthritis indexes in the rats of all groups(±s n=6)
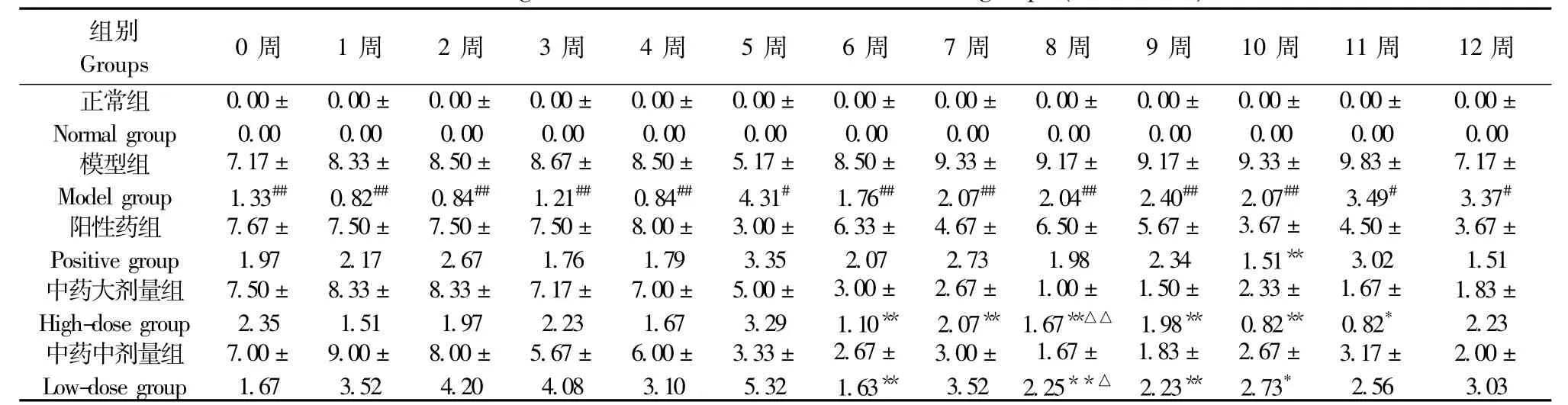
表1 各组大鼠关节总AI变化(±s,n=6)Tab.1 Changes of arthritis indexes in the rats of all groups(±s n=6)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01Note.Compared with the normal group,#P<0.05,##P<0.01;Compared with the model group,*P<0.05,**P<0.01
组别0周 1周 2周 3周 4周 5周 6周 7周 8周 9周 10周 11周 12周Groups正常组0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00± Normal group0.000.000.000.000.000.000.000.000.000.000.000.000.00模型组7.17±8.33±8.50±8.67±8.50±5.17±8.50±9.33±9.17±9.17±9.33±9.83±7.17± Model group1.33##0.82##0.84##1.21##0.84##4.31#1.76##2.07##2.04##2.40##2.07##3.49#3.37#阳性药组7.67±7.50±7.50±7.50±8.00±3.00±6.33±4.67±6.50±5.67±3.67±4.50±3.67± Positive group1.972.172.671.761.793.352.072.731.982.341.51**3.021.51中药大剂量组7.50±8.33±8.33±7.17±7.00±5.00±3.00±2.67±1.00±1.50±2.33±1.67±1.83± High-dose group2.351.511.972.231.673.291.10**2.07**1.67**△△1.98**0.82**0.82*2.23中药中剂量组7.00±9.00±8.00±5.67±6.00±3.33±2.67±3.00±1.67±1.83±2.67±3.17±2.00± Low-dose group1.673.524.204.083.105.321.63**3.522.25**△2.23**2.73*2.563.03
表2 各组大鼠左前肢AI变化(±s,n=6)Tab.1 Changes of arthritis indexes of the left forelimb of rats in all groups(±s,n=6)
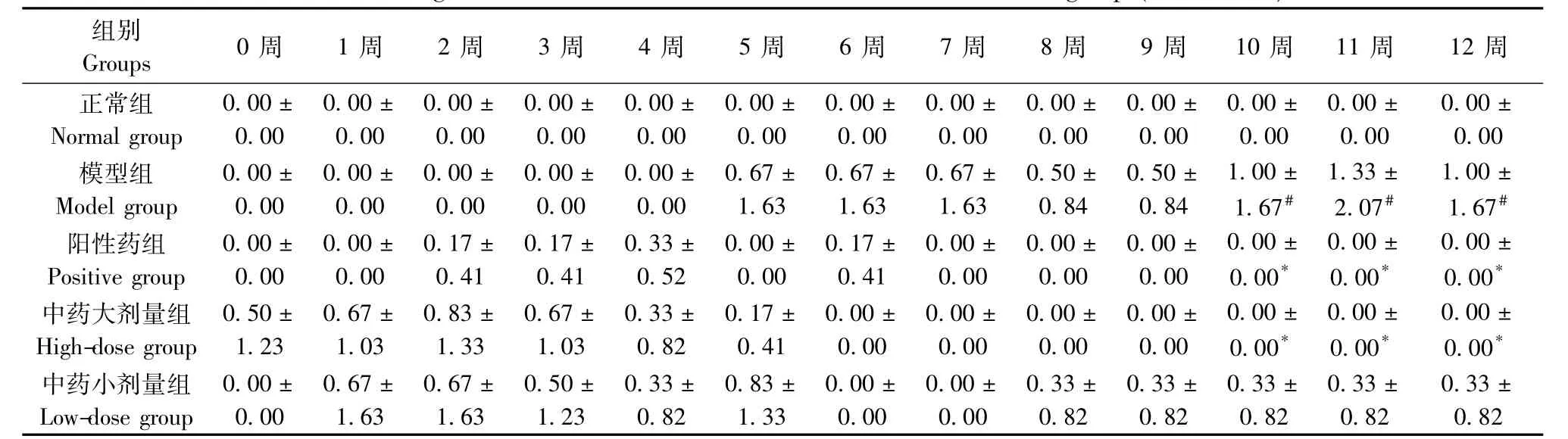
表2 各组大鼠左前肢AI变化(±s,n=6)Tab.1 Changes of arthritis indexes of the left forelimb of rats in all groups(±s,n=6)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01Note.Compared with the normal group,#P<0.05,##P<0.01;Compared with the model group,*P<0.05,**P<0.01
组别0周 1周 2周 3周 4周 5周 6周 7周 8周 9周 10周 11周 12周Groups正常组0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00± Normal group0.000.000.000.000.000.000.000.000.000.000.000.000.00模型组0.00±0.00±0.00±0.00±0.00±0.67±0.67±0.67±0.50±0.50±1.00±1.33±1.00± Model group0.000.000.000.000.001.631.631.630.840.841.67#2.07#1.67#阳性药组0.00±0.00±0.17±0.17±0.33±0.00±0.17±0.00±0.00±0.00±0.00±0.00±0.00± Positive group0.000.000.410.410.520.000.410.000.000.000.00*0.00*0.00*中药大剂量组0.50±0.67±0.83±0.67±0.33±0.17±0.00±0.00±0.00±0.00±0.00±0.00±0.00± High-dose group1.231.031.331.030.820.410.000.000.000.000.00*0.00*0.00*中药小剂量组0.00±0.67±0.67±0.50±0.33±0.83±0.00±0.00±0.33±0.33±0.33±0.33±0.33± Low-dose group0.001.631.631.230.821.330.000.000.820.820.820.820.82
表3 各组大鼠左后肢AI变化(±s,n=6)Tab.3 Changes of arthritis indexes of the left hind limb in rats of all groups(±s,n=6)
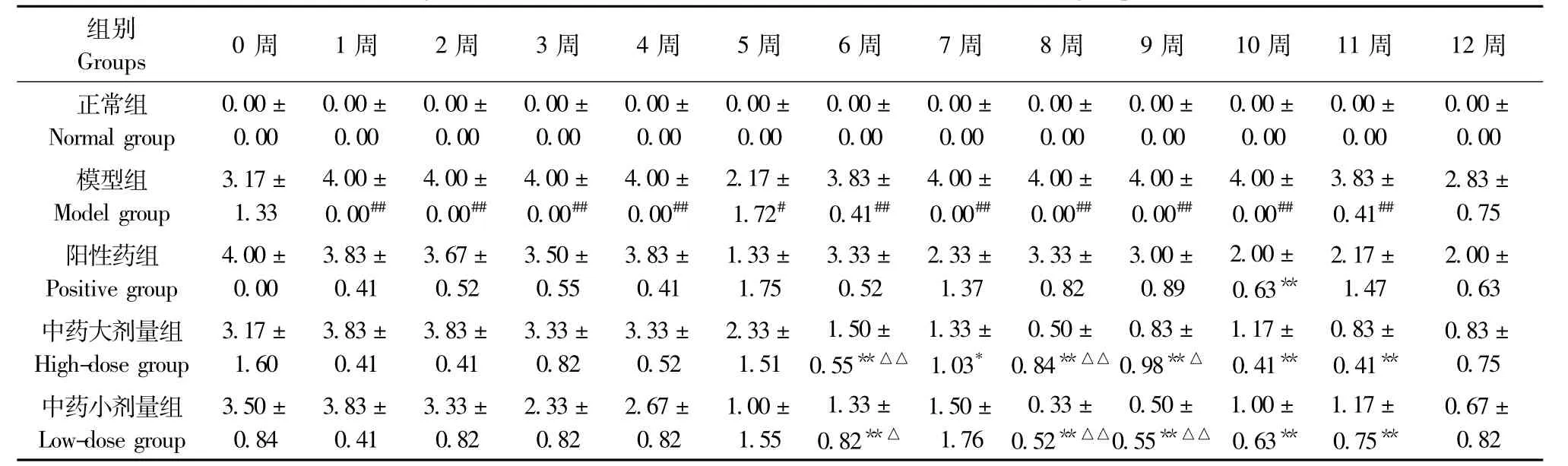
表3 各组大鼠左后肢AI变化(±s,n=6)Tab.3 Changes of arthritis indexes of the left hind limb in rats of all groups(±s,n=6)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01Note:Compared with the normal group,#P<0.05,##P<0.01;Compared with the model group,*P<0.05,**P<0.01
组别0周 1周 2周 3周 4周 5周 6周 7周 8周 9周 10周 11周 12周Groups正常组0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00±0.00± Normal group0.000.000.000.000.000.000.000.000.000.000.000.000.00模型组3.17±4.00±4.00±4.00±4.00±2.17±3.83±4.00±4.00±4.00±4.00±3.83±2.83± Model group1.330.00##0.00##0.00##0.00##1.72#0.41##0.00##0.00##0.00##0.00##0.41##0.75阳性药组4.00±3.83±3.67±3.50±3.83±1.33±3.33±2.33±3.33±3.00±2.00±2.17±2.00± Positive group0.000.410.520.550.411.750.521.370.820.890.63**1.470.63中药大剂量组3.17±3.83±3.83±3.33±3.33±2.33±1.50±1.33±0.50±0.83±1.17±0.83±0.83± High-dose group1.600.410.410.820.521.510.55**△△1.03*0.84**△△0.98**△0.41**0.41**0.75中药小剂量组3.50±3.83±3.33±2.33±2.67±1.00±1.33±1.50±0.33±0.50±1.00±1.17±0.67± Low-dose group0.840.410.820.820.821.550.82**△1.760.52**△△0.55**△△0.63**0.75**0.82
2.1.3 大鼠右前肢及右后肢AI积分变化:与正常组比较,模型组大鼠右前肢AI积分在0~12周时无明显统计学意义(P>0.05)右后肢AI积分在0~12周显著升高(P<0.05或P<0.01)。与模型组比较,阳性药组右后肢AI评分在10周时明显下降(P<0.05);中药大剂量组在6~12周时右后肢AI积分下降(P<0.05或P<0.01);中药小剂量组6周、8~12周右后肢AI积分降低,差异有统计学意义(P<0.01)(表4,5)。
2.2 中药藤莓汤对CIA模型大鼠双后肢肿胀程度的改善
2.2.1 左后肢前后径、左右径变化情况:与正常组比较,模型组大鼠左后肢前后径测量值在2周、3周、6周、8周、10~12周时明显增加(P<0.05);左后肢左右径测量值在1~4周,6~12周时显著升高(P<0.05或P<0.01)。与模型组比较,中药大剂量组12周时左后肢前后径测量值下降(P<0.05);中药小组12周时左后肢前后径、左右径测量值降低(P<0.05)。见表6,7。
表4 各组大鼠右前肢AI变化(±s,n=6)Tab.4 Changes of arthritis indexes of the right forelimb in rats of all groups(±s,n=6)
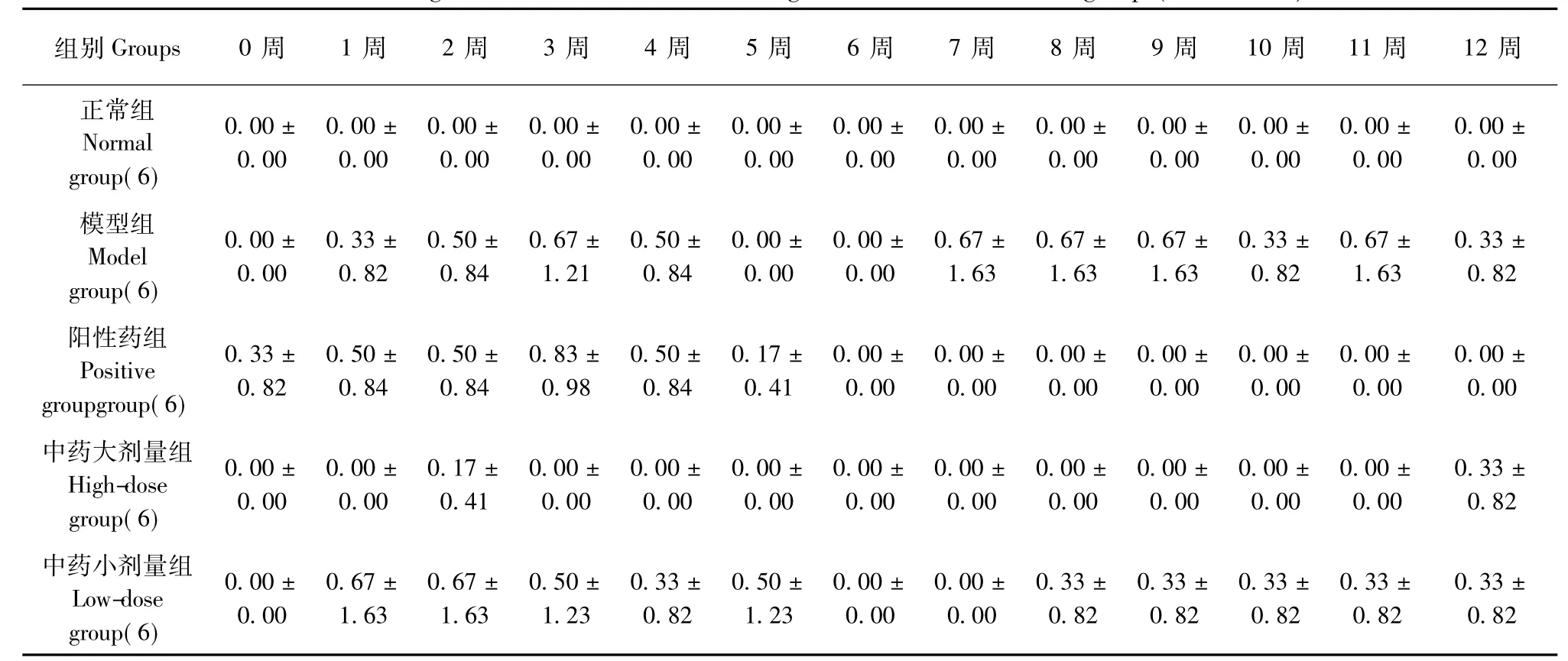
表4 各组大鼠右前肢AI变化(±s,n=6)Tab.4 Changes of arthritis indexes of the right forelimb in rats of all groups(±s,n=6)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01Note.Compared with the normal group,#P<0.05,##P<0.01;Compared with the model group,*P<0.05,**P<0.01
组别Groups 0周 1周 2周 3周 4周 5周 6周 7周 8周 9周 10周 11周 12周正常组Normal group(6)0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00模型组Model group(6)0.00± 0.00 0.33± 0.82 0.50± 0.84 0.67± 1.21 0.50± 0.84 0.00± 0.00 0.00± 0.00 0.67± 1.63 0.67± 1.63 0.67± 1.63 0.33± 0.82 0.67± 1.63 0.33± 0.82阳性药组Positive groupgroup(6)0.33± 0.82 0.50± 0.84 0.50± 0.84 0.83± 0.98 0.50± 0.84 0.17± 0.41 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00中药大剂量组High-dose group(6)0.00± 0.00 0.00± 0.00 0.17± 0.41 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.33± 0.82中药小剂量组Low-dose group(6)0.00± 0.00 0.67± 1.63 0.67± 1.63 0.50± 1.23 0.33± 0.82 0.50± 1.23 0.00± 0.00 0.00± 0.00 0.33± 0.82 0.33± 0.82 0.33± 0.82 0.33± 0.82 0.33± 0.82
表5 各组大鼠右后肢AI变化(±s,n=6)Tab.5 Changes of arthritis indexes of the right hind limb in rats of all groups(±s,n=6)
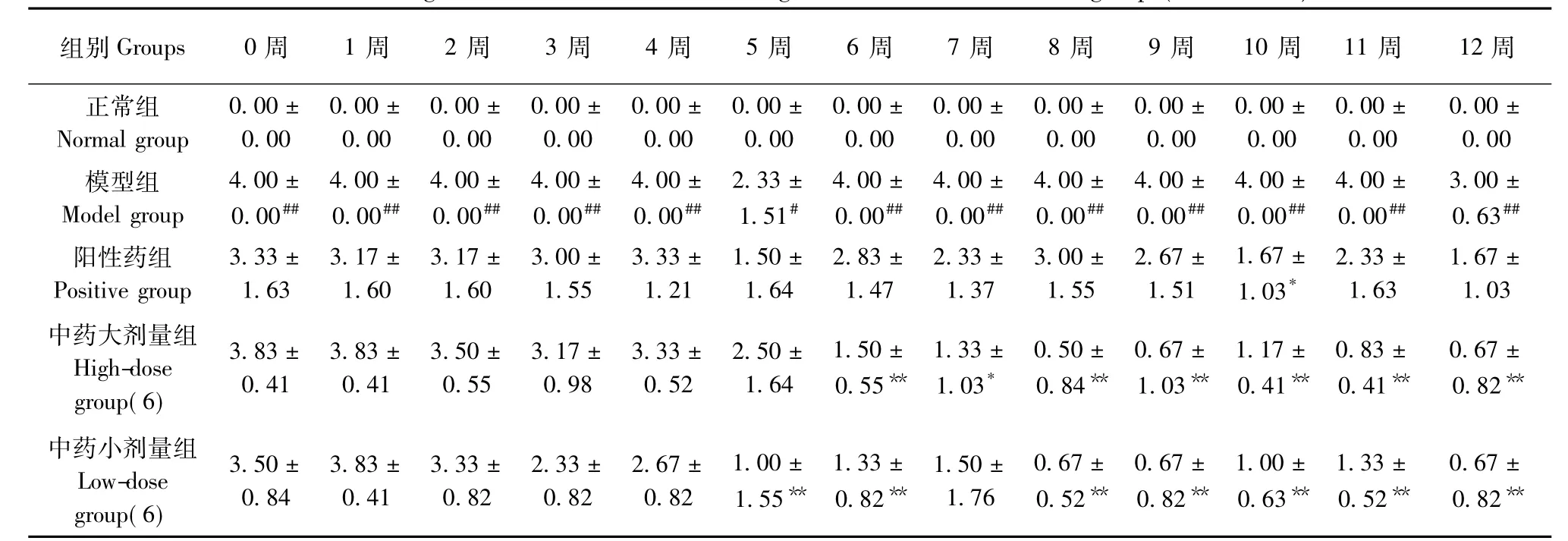
表5 各组大鼠右后肢AI变化(±s,n=6)Tab.5 Changes of arthritis indexes of the right hind limb in rats of all groups(±s,n=6)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01Note.Compared with the normal group,#P<0.05,##P<0.01;Compared with the model group,*P<0.05,**P<0.01
组别Groups 0周 1周 2周 3周 4周 5周 6周 7周 8周 9周 10周 11周 12周正常组Normal group 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00 0.00± 0.00模型组Model group 4.00± 0.00## 4.00± 0.00## 4.00± 0.00## 4.00± 0.00## 4.00± 0.00## 2.33± 1.51# 4.00± 0.00## 4.00± 0.00## 4.00± 0.00## 4.00± 0.00## 4.00± 0.00## 4.00± 0.00## 3.00± 0.63##阳性药组Positive group 3.33± 1.63 3.17± 1.60 3.17± 1.60 3.00± 1.55 3.33± 1.21 1.50± 1.64 2.83± 1.47 2.33± 1.37 3.00± 1.55 2.67± 1.51 1.67± 1.03* 2.33± 1.63 1.67± 1.03中药大剂量组High-dose group(6)3.83± 0.41 3.83± 0.41 3.50± 0.55 3.17± 0.98 3.33± 0.52 2.50± 1.64 1.50± 0.55**1.33± 1.03* 0.50± 0.84**0.67± 1.03**1.17± 0.41**0.83± 0.41**0.67± 0.82**中药小剂量组Low-dose group(6)3.50± 0.84 3.83± 0.41 3.33± 0.82 2.33± 0.82 2.67± 0.82 1.00± 1.55**1.33± 0.82**1.50± 1.76 0.67± 0.52**0.67± 0.82**1.00± 0.63**1.33± 0.52**0.67± 0.82**
2.2.2 左后肢足垫厚及跖骨最高点改善情况:与正常组比较,模型组大鼠足垫厚测量值在3周、5周、11周时升高,有统计学意义(P<0.01);左后肢跖骨最高点测量值在1~6周、8~12周时显著增加(P<0.05或P<0.01)。与模型组比较,各治疗组间左后肢足垫厚及左后肢跖关节肿胀程度的改善无显著统计学意义(P>0.05)。见表8,9。
表6 各组大鼠左后肢前后径(mm)变化(±s,n=6)Tab.6 Changes of the anteroposterior diameters of the left hind limbs of rats in all groups(±s,n=6)
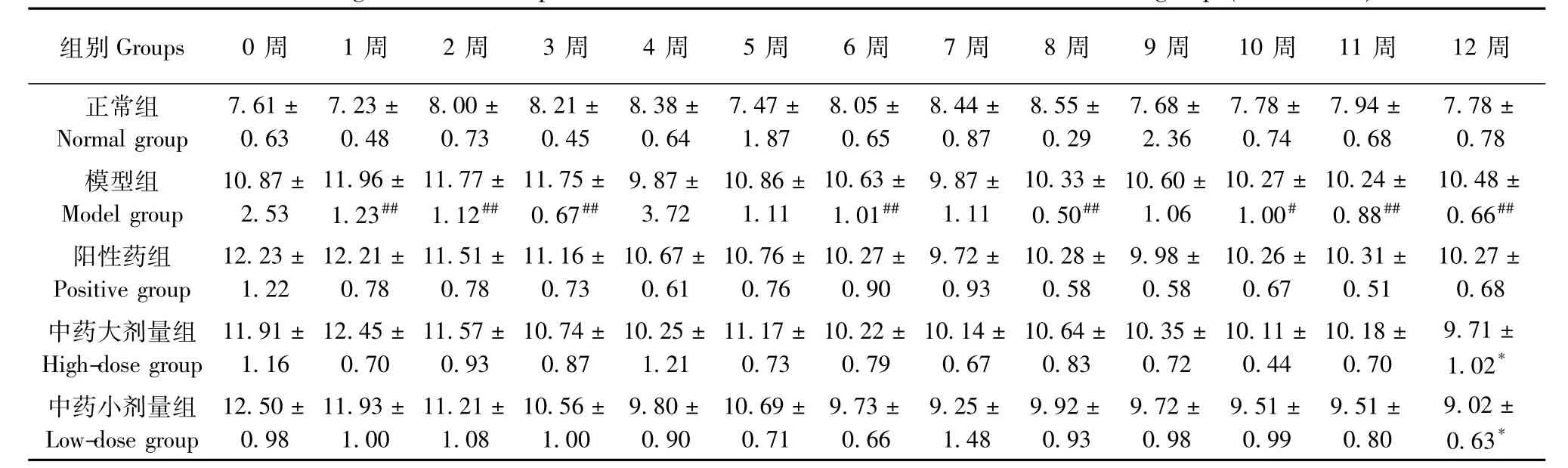
表6 各组大鼠左后肢前后径(mm)变化(±s,n=6)Tab.6 Changes of the anteroposterior diameters of the left hind limbs of rats in all groups(±s,n=6)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01Note.Compared with the normal group,#P<0.05,##P<0.01;Compared with the model group,*P<0.05,**P<0.01.
组别Groups 0周 1周 2周 3周 4周 5周 6周 7周 8周 9周 10周 11周 12周正常组Normal group 7.61± 0.63 7.23± 0.48 8.00± 0.73 8.21± 0.45 8.38± 0.64 7.47± 1.87 8.05± 0.65 8.44± 0.87 8.55± 0.29 7.68± 2.36 7.78± 0.74 7.94± 0.68 7.78± 0.78模型组Model group 10.87± 2.53 11.96± 1.23## 11.77± 1.12## 11.75± 0.67## 9.87± 3.72 10.86± 1.11 10.63± 1.01## 9.87± 1.11 10.33± 0.50## 10.60± 1.06 10.27± 1.00# 10.24± 0.88## 10.48± 0.66##阳性药组Positive group 12.23± 1.22 12.21± 0.78 11.51± 0.78 11.16± 0.73 10.67± 0.61 10.76± 0.76 10.27± 0.90 9.72± 0.93 10.28± 0.58 9.98± 0.58 10.26± 0.67 10.31± 0.51 10.27± 0.68中药大剂量组High-dose group 11.91± 1.16 12.45± 0.70 11.57± 0.93 10.74± 0.87 10.25± 1.21 11.17± 0.73 10.22± 0.79 10.14± 0.67 10.64± 0.83 10.35± 0.72 10.11± 0.44 10.18± 0.70 9.71± 1.02*中药小剂量组Low-dose group 12.50± 0.98 11.93± 1.00 11.21± 1.08 10.56± 1.00 9.80± 0.90 10.69± 0.71 9.73± 0.66 9.25± 1.48 9.92± 0.93 9.72± 0.98 9.51± 0.99 9.51± 0.80 9.02± 0.63*
表7 各组大鼠左后肢左右径(mm)变化(±s,n=6)Tab.7 Changes of the transverse diameters of the left hind limbs of rats in all groups(±s,n=6)
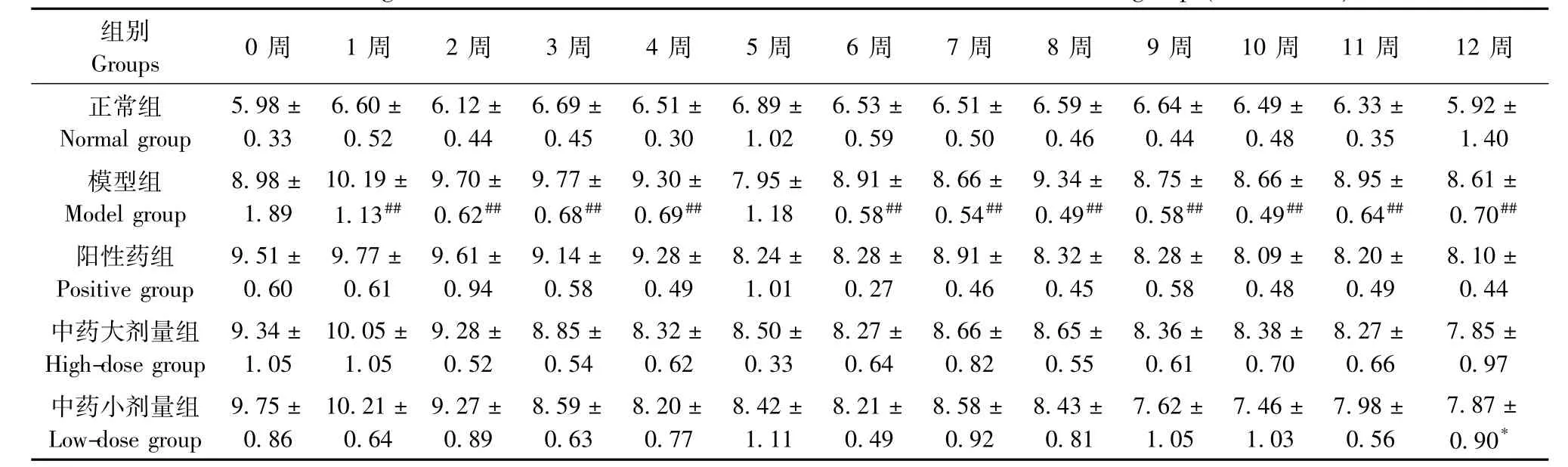
表7 各组大鼠左后肢左右径(mm)变化(±s,n=6)Tab.7 Changes of the transverse diameters of the left hind limbs of rats in all groups(±s,n=6)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01Note.Compared with the normal group,#P<0.05,##P<0.01;Compared with the model group,*P<0.05,**P<0.01.
组别Groups 0周 1周 2周 3周 4周 5周 6周 7周 8周 9周 10周 11周 12周正常组Normal group 5.98± 0.33 6.60± 0.52 6.12± 0.44 6.69± 0.45 6.51± 0.30 6.89± 1.02 6.53± 0.59 6.51± 0.50 6.59± 0.46 6.64± 0.44 6.49± 0.48 6.33± 0.35 5.92± 1.40模型组Model group 8.98± 1.89 10.19± 1.13## 9.70± 0.62## 9.77± 0.68## 9.30± 0.69## 7.95± 1.18 8.91± 0.58## 8.66± 0.54## 9.34± 0.49## 8.75± 0.58## 8.66± 0.49## 8.95± 0.64## 8.61± 0.70##阳性药组Positive group 9.51± 0.60 9.77± 0.61 9.61± 0.94 9.14± 0.58 9.28± 0.49 8.24± 1.01 8.28± 0.27 8.91± 0.46 8.32± 0.45 8.28± 0.58 8.09± 0.48 8.20± 0.49 8.10± 0.44中药大剂量组High-dose group 9.34± 1.05 10.05± 1.05 9.28± 0.52 8.85± 0.54 8.32± 0.62 8.50± 0.33 8.27± 0.64 8.66± 0.82 8.65± 0.55 8.36± 0.61 8.38± 0.70 8.27± 0.66 7.85± 0.97中药小剂量组Low-dose group 9.75± 0.86 10.21± 0.64 9.27± 0.89 8.59± 0.63 8.20± 0.77 8.42± 1.11 8.21± 0.49 8.58± 0.92 8.43± 0.81 7.62± 1.05 7.46± 1.03 7.98± 0.56 7.87± 0.90*
表8 各组大鼠左后肢足垫厚(mm)变化(±s,n=6)Tab.8 Changes of the Left hind limb foot pad thicknessin of the rats in all groups(±s,n=6)
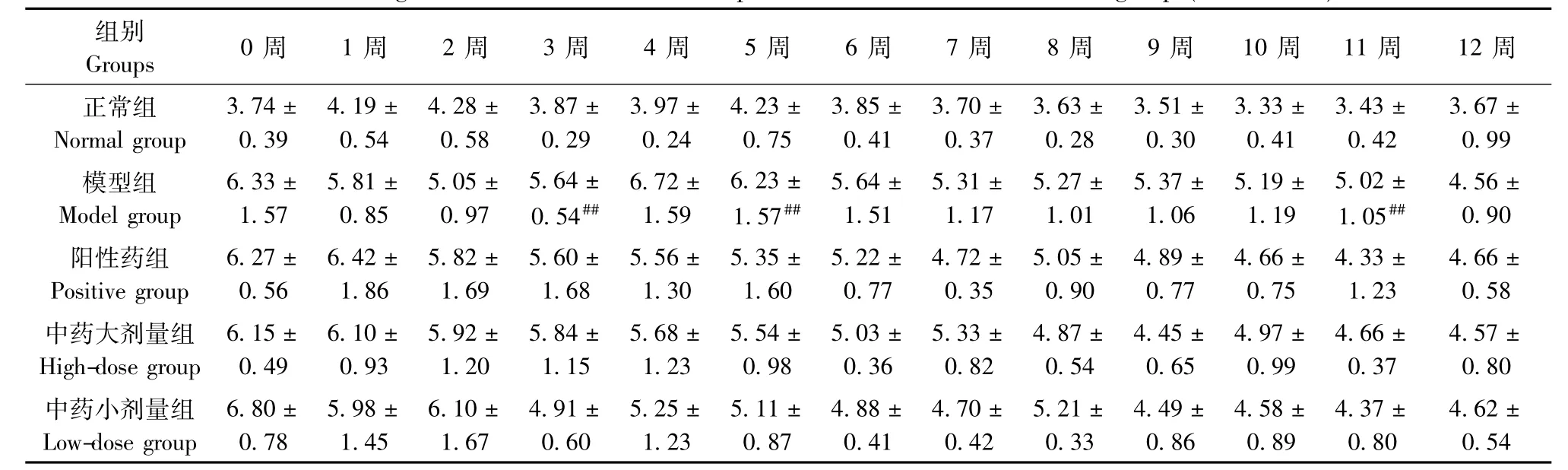
表8 各组大鼠左后肢足垫厚(mm)变化(±s,n=6)Tab.8 Changes of the Left hind limb foot pad thicknessin of the rats in all groups(±s,n=6)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01Note.Compared with the normal group,#P<0.05,##P<0.01;Compared with the model group,*P<0.05,**P<0.01.
组别Groups 0周 1周 2周 3周 4周 5周 6周 7周 8周 9周 10周 11周 12周正常组Normal group 3.74± 0.39 4.19± 0.54 4.28± 0.58 3.87± 0.29 3.97± 0.24 4.23± 0.75 3.85± 0.41 3.70± 0.37 3.63± 0.28 3.51± 0.30 3.33± 0.41 3.43± 0.42 3.67± 0.99模型组Model group 6.33± 1.57 5.81± 0.85 5.05± 0.97 5.64± 0.54## 6.72± 1.59 6.23± 1.57## 5.64± 1.51 5.31± 1.17 5.27± 1.01 5.37± 1.06 5.19± 1.19 5.02± 1.05## 4.56± 0.90阳性药组Positive group 6.27± 0.56 6.42± 1.86 5.82± 1.69 5.60± 1.68 5.56± 1.30 5.35± 1.60 5.22± 0.77 4.72± 0.35 5.05± 0.90 4.89± 0.77 4.66± 0.75 4.33± 1.23 4.66± 0.58中药大剂量组High-dose group 6.15± 0.49 6.10± 0.93 5.92± 1.20 5.84± 1.15 5.68± 1.23 5.54± 0.98 5.03± 0.36 5.33± 0.82 4.87± 0.54 4.45± 0.65 4.97± 0.99 4.66± 0.37 4.57± 0.80中药小剂量组Low-dose group 6.80± 0.78 5.98± 1.45 6.10± 1.67 4.91± 0.60 5.25± 1.23 5.11± 0.87 4.88± 0.41 4.70± 0.42 5.21± 0.33 4.49± 0.86 4.58± 0.89 4.37± 0.80 4.62± 0.54
2.2.3 右后肢前后径及左右径变化情况:与正常组比较,模型组大鼠右后肢前后径在0~4周、6周、8~12周时测量值显著升高(P<0.05或P<0.01);右后肢左右径测量值在1~4周、6~12周时增加,有统计学意义(P<0.05或P<0.01);与模型组比较,各治疗组右后肢肿胀程度改善情况无明显差异(P>0.05)。见表10,11。
表9 各组大鼠左后肢跖骨最高点(mm)变化(±s,n=6)Tab.9 Changes of the highest points of left hind limb metatarsal of the rats in all groups(±s,n=6)
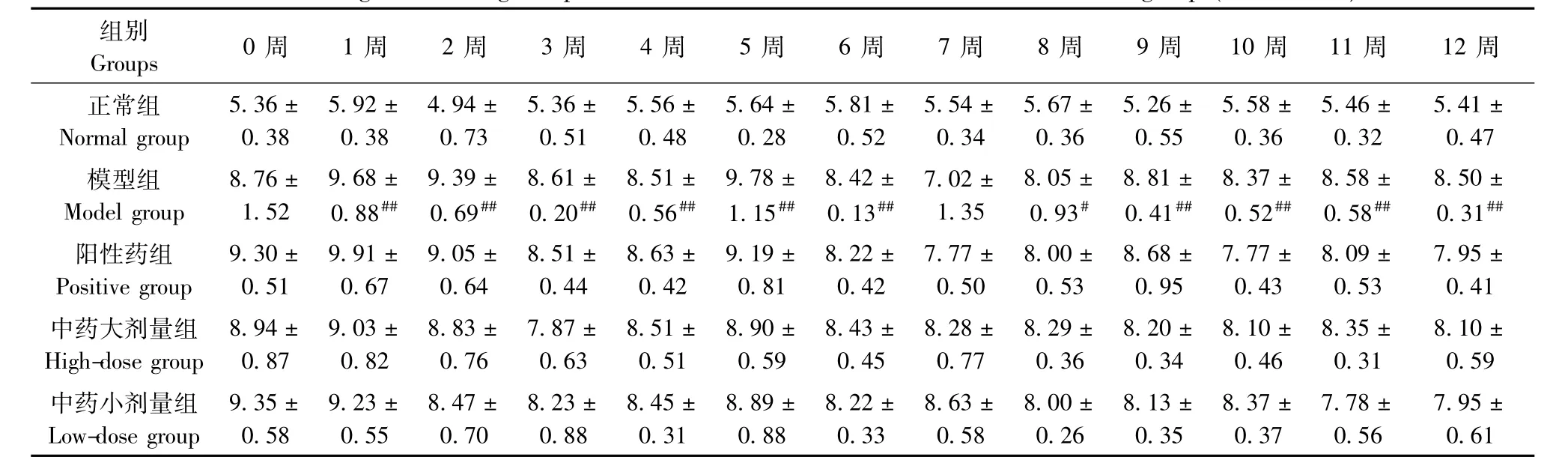
表9 各组大鼠左后肢跖骨最高点(mm)变化(±s,n=6)Tab.9 Changes of the highest points of left hind limb metatarsal of the rats in all groups(±s,n=6)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01Note.Compared with the normal group,#P<0.05,##P<0.01;Compared with the model group,*P<0.05,**P<0.01.
组别0周 1周 2周 3周 4周 5周 6周 7周 8周 9周 10周 11周 12周Groups正常组5.36±5.92±4.94±5.36±5.56±5.64±5.81±5.54±5.67±5.26±5.58±5.46±5.41± Normal group0.380.380.730.510.480.280.520.340.360.550.360.320.47模型组8.76±9.68±9.39±8.61±8.51±9.78±8.42±7.02±8.05±8.81±8.37±8.58±8.50± Model group1.520.88##0.69##0.20##0.56##1.15##0.13##1.350.93#0.41##0.52##0.58##0.31##阳性药组9.30±9.91±9.05±8.51±8.63±9.19±8.22±7.77±8.00±8.68±7.77±8.09±7.95± Positive group0.510.670.640.440.420.810.420.500.530.950.430.530.41中药大剂量组8.94±9.03±8.83±7.87±8.51±8.90±8.43±8.28±8.29±8.20±8.10±8.35±8.10± High-dose group0.870.820.760.630.510.590.450.770.360.340.460.310.59中药小剂量组9.35±9.23±8.47±8.23±8.45±8.89±8.22±8.63±8.00±8.13±8.37±7.78±7.95± Low-dose group0.580.550.700.880.310.880.330.580.260.350.370.560.61
表10 各组大鼠右后肢前后径(mm)变化(±s,n=6)Tab.10 Changes of the anteroposterior diameters of the right hind limbs of the rats in all groups(±s,n=6)
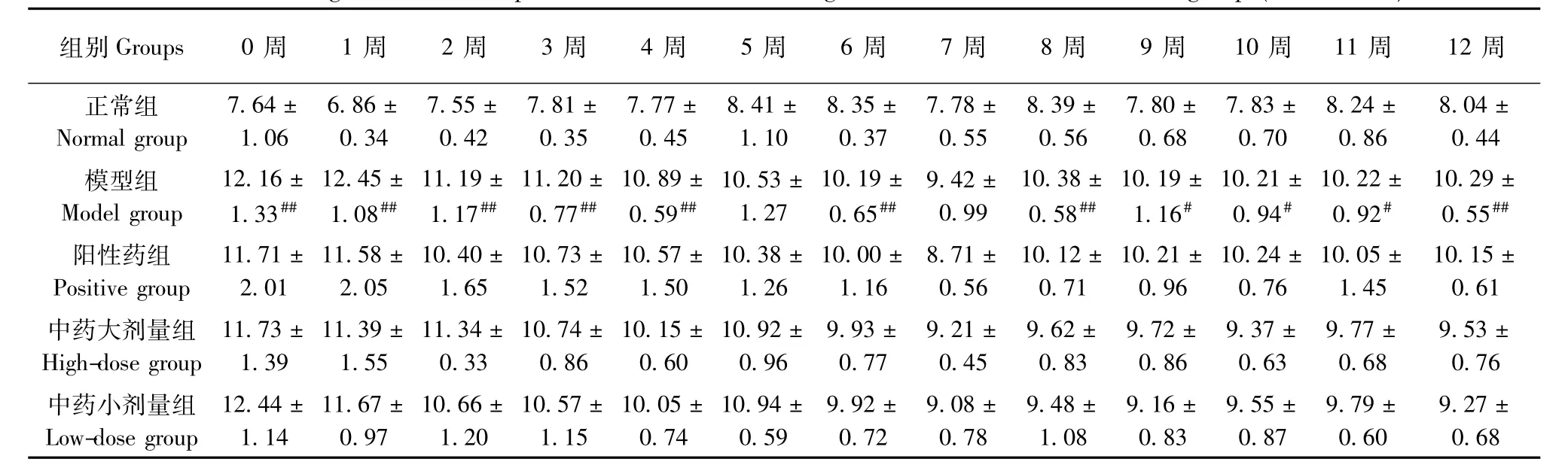
表10 各组大鼠右后肢前后径(mm)变化(±s,n=6)Tab.10 Changes of the anteroposterior diameters of the right hind limbs of the rats in all groups(±s,n=6)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01Note.Compared with the normal group,#P<0.05,##P<0.01;Compared with the model group,*P<0.05,**P<0.01.
组别Groups 0周 1周 2周 3周 4周 5周 6周 7周 8周 9周 10周 11周 12周正常组7.64±6.86±7.55±7.81±7.77±8.41±8.35±7.78±8.39±7.80±7.83±8.24±8.04± Normal group1.060.340.420.350.451.100.370.550.560.680.700.860.44模型组12.16±12.45±11.19±11.20±10.89±10.53±10.19±9.42±10.38±10.19±10.21±10.22±10.29± Model group1.33##1.08##1.17##0.77##0.59##1.270.65##0.990.58##1.16#0.94#0.92#0.55##阳性药组11.71±11.58±10.40±10.73±10.57±10.38±10.00±8.71±10.12±10.21±10.24±10.05±10.15± Positive group2.012.051.651.521.501.261.160.560.710.960.761.450.61中药大剂量组11.73±11.39±11.34±10.74±10.15±10.92±9.93±9.21±9.62±9.72±9.37±9.77±9.53± High-dose group1.391.550.330.860.600.960.770.450.830.860.630.680.76中药小剂量组12.44±11.67±10.66±10.57±10.05±10.94±9.92±9.08±9.48±9.16±9.55±9.79±9.27± Low-dose group1.140.971.201.150.740.590.720.781.080.830.870.600.68
表11 各组大鼠右后肢左右径(mm)变化(±s,n=6)Tab.11 Changes of the transverse diameters of the right hind limbs of the rats in all groups(±s,n=6)
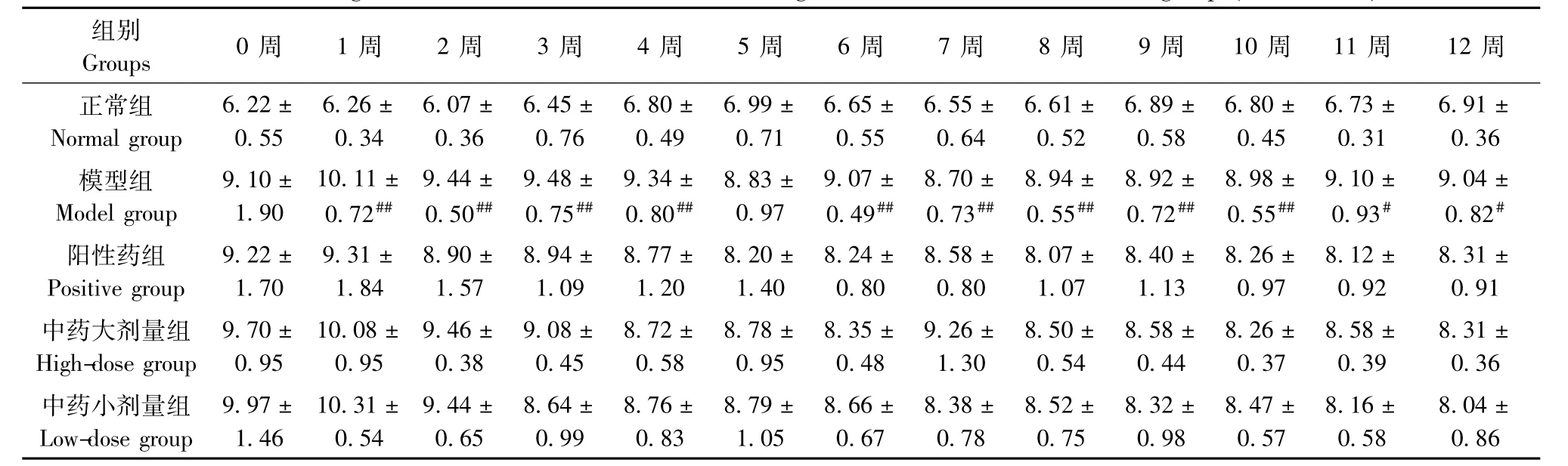
表11 各组大鼠右后肢左右径(mm)变化(±s,n=6)Tab.11 Changes of the transverse diameters of the right hind limbs of the rats in all groups(±s,n=6)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01Note.Compared with the normal group,#P<0.05,##P<0.01;Compared with the model group,*P<0.05,**P<0.01.
组别0周 1周 2周 3周 4周 5周 6周 7周 8周 9周 10周 11周 12周Groups正常组6.22±6.26±6.07±6.45±6.80±6.99±6.65±6.55±6.61±6.89±6.80±6.73±6.91± Normal group0.550.340.360.760.490.710.550.640.520.580.450.310.36模型组9.10±10.11±9.44±9.48±9.34±8.83±9.07±8.70±8.94±8.92±8.98±9.10±9.04± Model group1.900.72##0.50##0.75##0.80##0.970.49##0.73##0.55##0.72##0.55##0.93#0.82#阳性药组9.22±9.31±8.90±8.94±8.77±8.20±8.24±8.58±8.07±8.40±8.26±8.12±8.31± Positive group1.701.841.571.091.201.400.800.801.071.130.970.920.91中药大剂量组9.70±10.08±9.46±9.08±8.72±8.78±8.35±9.26±8.50±8.58±8.26±8.58±8.31± High-dose group0.950.950.380.450.580.950.481.300.540.440.370.390.36中药小剂量组9.97±10.31±9.44±8.64±8.76±8.79±8.66±8.38±8.52±8.32±8.47±8.16±8.04± Low-dose group1.460.540.650.990.831.050.670.780.750.980.570.580.86
2.2.4 右后肢足垫厚及跖骨最高点改善情况:与正常组比较,模型组大鼠右后肢足垫厚测量值在0周~5周、8周、10周、11周时明显升高(P<0.05或P<0.01);右后肢跖骨最高点测量值在0周~6周、8周~12周时显著升高,差异有统计学意义(P<0.01)。与模型组比较,各治疗组右后肢肿胀程度改善情况无明显差异(P>0.05)。见表12,13。
2.3 中药藤莓汤对CIA模型大鼠关节滑膜IL-6、TNF-αmRNA转录及蛋白表达水平的影响
与正常组比较,模型组大鼠关节滑膜IL-6、TNF-α mRNA转录及蛋白表达水平显著上调(P<0.01)。与模型组比较,阳性药组、中药大、小剂量组IL-6、TNF-α mRNA转录及蛋白表达水平显著下调,差异有统计学意义(P<0.01)(表14)。
表12 各组大鼠右后肢足垫厚(mm)变化(±s,n=6)Tab.12 Changes of the right hind limb foot pad thickness of the rats in all groups(±s,n=6)
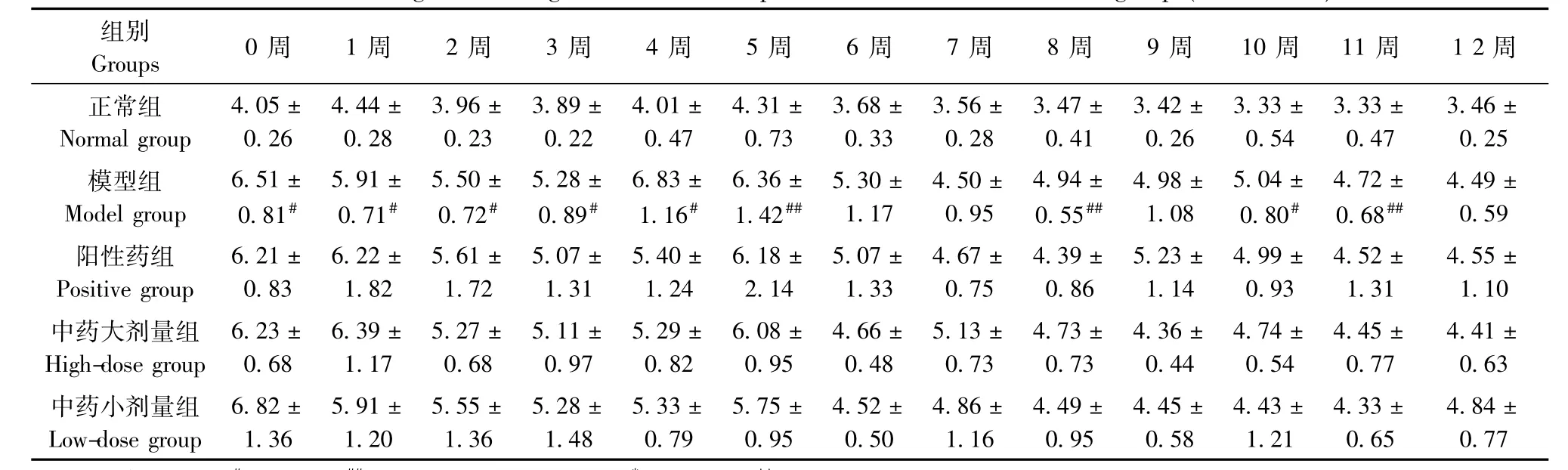
表12 各组大鼠右后肢足垫厚(mm)变化(±s,n=6)Tab.12 Changes of the right hind limb foot pad thickness of the rats in all groups(±s,n=6)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01Note.Compared with the normal group,#P<0.05,##P<0.01;Compared with the model group,*P<0.05,**P<0.01.
组别Groups 0周 1周 2周 3周 4周 5周 6周 7周 8周 9周 10周 11周 1 2周正常组Normal group 4.05± 0.26 4.44± 0.28 3.96± 0.23 3.89± 0.22 4.01± 0.47 4.31± 0.73 3.68± 0.33 3.56± 0.28 3.47± 0.41 3.42± 0.26 3.33± 0.54 3.33± 0.47 3.46± 0.25模型组Model group 6.51± 0.81# 5.91± 0.71# 5.50± 0.72# 5.28± 0.89# 6.83± 1.16# 6.36± 1.42## 5.30± 1.17 4.50± 0.95 4.94± 0.55## 4.98± 1.08 5.04± 0.80# 4.72± 0.68## 4.49± 0.59阳性药组Positive group 6.21± 0.83 6.22± 1.82 5.61± 1.72 5.07± 1.31 5.40± 1.24 6.18± 2.14 5.07± 1.33 4.67± 0.75 4.39± 0.86 5.23± 1.14 4.99± 0.93 4.52± 1.31 4.55± 1.10中药大剂量组High-dose group 6.23± 0.68 6.39± 1.17 5.27± 0.68 5.11± 0.97 5.29± 0.82 6.08± 0.95 4.66± 0.48 5.13± 0.73 4.73± 0.73 4.36± 0.44 4.74± 0.54 4.45± 0.77 4.41± 0.63中药小剂量组Low-dose group 6.82± 1.36 5.91± 1.20 5.55± 1.36 5.28± 1.48 5.33± 0.79 5.75± 0.95 4.52± 0.50 4.86± 1.16 4.49± 0.95 4.45± 0.58 4.43± 1.21 4.33± 0.65 4.84± 0.77
表13 各组大鼠右后肢跖骨最高点(mm)变化(±s,n=6)Tab.13 Changes of the right hind limb metatarsal highest point of the rats in all groups(±s,n=6)
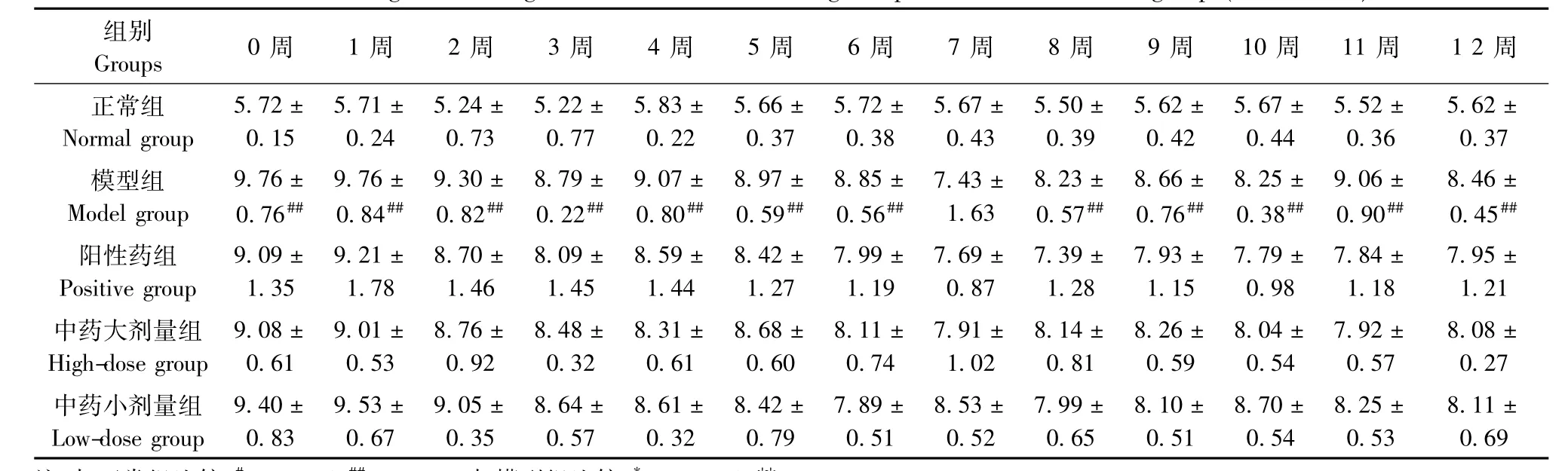
表13 各组大鼠右后肢跖骨最高点(mm)变化(±s,n=6)Tab.13 Changes of the right hind limb metatarsal highest point of the rats in all groups(±s,n=6)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01Note.Compared with the normal group,#P<0.05,##P<0.01;Compared with the model group,*P<0.05,**P<0.01.
组别Groups 0周 1周 2周 3周 4周 5周 6周 7周 8周 9周 10周 11周 1 2周正常组Normal group 5.72± 0.15 5.71± 0.24 5.24± 0.73 5.22± 0.77 5.83± 0.22 5.66± 0.37 5.72± 0.38 5.67± 0.43 5.50± 0.39 5.62± 0.42 5.67± 0.44 5.52± 0.36 5.62± 0.37模型组Model group 9.76± 0.76## 9.76± 0.84## 9.30± 0.82## 8.79± 0.22## 9.07± 0.80## 8.97± 0.59## 8.85± 0.56## 7.43± 1.63 8.23± 0.57## 8.66± 0.76## 8.25± 0.38## 9.06± 0.90## 8.46± 0.45##阳性药组Positive group 9.09± 1.35 9.21± 1.78 8.70± 1.46 8.09± 1.45 8.59± 1.44 8.42± 1.27 7.99± 1.19 7.69± 0.87 7.39± 1.28 7.93± 1.15 7.79± 0.98 7.84± 1.18 7.95± 1.21中药大剂量组High-dose group 9.08± 0.61 9.01± 0.53 8.76± 0.92 8.48± 0.32 8.31± 0.61 8.68± 0.60 8.11± 0.74 7.91± 1.02 8.14± 0.81 8.26± 0.59 8.04± 0.54 7.92± 0.57 8.08± 0.27中药小剂量组Low-dose group 9.40± 0.83 9.53± 0.67 9.05± 0.35 8.64± 0.57 8.61± 0.32 8.42± 0.79 7.89± 0.51 8.53± 0.52 7.99± 0.65 8.10± 0.51 8.70± 0.54 8.25± 0.53 8.11± 0.69
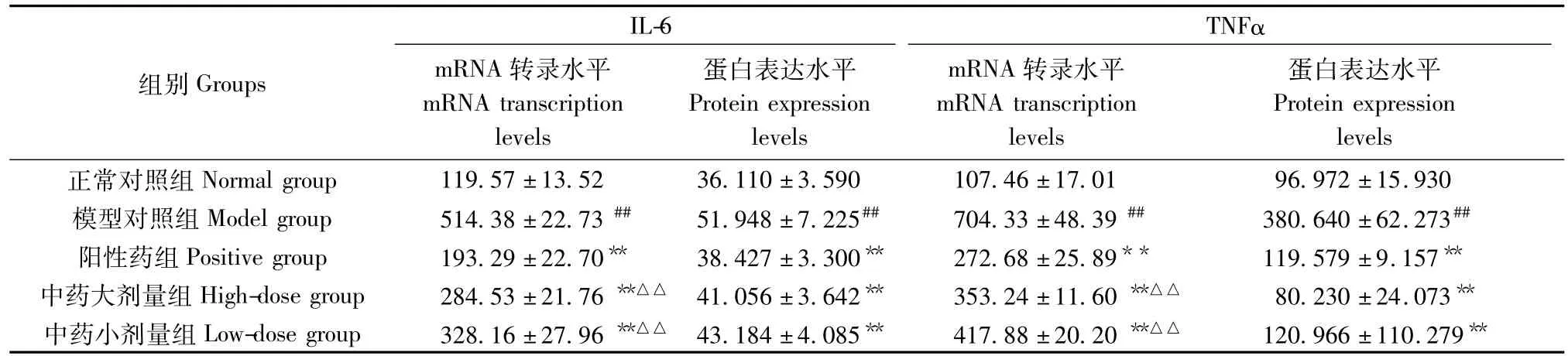
表14 各组大鼠滑膜组织IL-6、TNF-αmRNA转录及蛋白表达水平(n=6)Tab.14 Levels of mRNA transcription and protein expression of IL-6 and TNF-α in the synovial tissue of the rats in all groups(n=6)
2.4 中药藤莓汤对CIA模型大鼠右踝关节组织病理的影响
正常组大鼠右踝关节面光滑,软骨细胞排列整齐,关节周围组织未见炎性细胞浸润。模型组大鼠右踝关节软骨滑膜被覆上皮细胞轻度增生,关节腔缩小,周围软组织见轻度纤维增生,轻度炎性细胞浸润,以淋巴细胞为主。藤莓汤大剂量组右踝关节滑膜增生,有少量淋巴细胞浸润,关节软骨纤维化,周围软组织有轻度纤维组织增生,较模型组无明显差异;藤莓汤小剂量组关节周围软组织见少量炎性细胞浸润,关节腔略缩小,软骨、滑膜未见明显病变,关节病变较模型组有所减轻(图1,见文后彩插4)。
3 讨论
RA是一种以慢性、对称性、多滑膜关节炎及关节外病变为主要临床表现的自身免疫性疾病。急性活动期以关节红肿热痛为主,中晚期可见关节肿痛,变形,功能障碍。病理特征为血管翳形成,滑膜组织肥厚,骨及软骨破坏[3]。随着人类对RA发病机制深入研究,治疗对策及靶向性药物不断问世。然而,由于本病病因不明,病机复杂,病程漫长,后果严重,而且部分病人因肝肾功能损害或药物过敏,严重影响疗效[4-6]。因此,针对不同病理环节的治疗方法及手段乃是国际风湿免疫学界迫切需要解决的难点。RA属中医学“痹证”范畴,中医认为本病发生发展与外因风寒湿热不同致病因素的影响,内因机体先天禀赋或后天失调有关,邪正相搏,浊毒瘀闭肢体经络、骨节而致。RA急性活动期多以湿热瘀毒痹阻,关节红肿热痛为特点[7],当浊毒不化,交阻骨节,病深入络,渐见关节活动不利,肿大变形的中晚期病理特征,而且瘀浊蕴久化热成毒,作为伏邪,诱发急性发作过程,其恶性循环的病理机制导致了本病最终结局。藤莓汤为治疗RA经验方,可明显改善RA急性期关节晨僵、灼热肿胀、疼痛剧烈等症状,而且对相关炎性指标ESR、CRP及免疫指标RF、CCP有良好的纠正作用。方中忍冬藤味甘,性寒,为君,蛇莓甘苦,性寒,穿山龙、桑枝性平,味苦,为臣,四药配伍清热解毒,除湿通络。乳香、没药、乌蛇祛瘀止痛,白芥子化痰降浊散结,诸药共用,解热毒、化瘀浊、通经络、止痹痛,切中活动期RA的病理机制。为了进一步验证该方的疗效,本实验制备了RA动物体内试验的经典模型-CIA模型,通过上述研究,证明中药藤莓汤能有效改善CIA模型大鼠关节滑膜病理损伤,其作用机制可能与其下调介导免疫炎性反应的核心细胞因子高表达相关。关于RA发病机制的探索,国际医学领域经过几代人的不懈努力,取得了突破性进展,多项研究围绕在自身抗体和免疫复合物、T细胞介导的抗原特异性反应,T细胞独立的细胞因子网络,RA滑膜的肿瘤样侵蚀性生长行为等方面展开[8]。其共识为入侵或变异的抗原激活体内免疫活性细胞,产生包括RF在内的多种多克隆抗体,激活滑膜细胞,释放相关炎性介质,同时激活免疫复合物,激活补体系统而造成关节局部炎症损伤。随着认识的进一步深入,特别是T辅助细胞亚群Th17的发现,免疫-炎性反应-凋亡异常作为RA发病的核心环节被揭示。研究证明,炎性因子在RA病理改变中发挥重要作用。其中,NF-κB、TNF-α、IL-6、IL-17等为介导关节滑膜免疫炎性损伤的核心因素。IL-17A是IL-17家族的原型,也是Th-17细胞主要的效应分子,在抗胞外细菌、真菌感染的宿主防御中发挥重要作用。然而,过量的Th-17细胞反应或IL-17表达则容易导致慢性炎症和自身免疫疾病。IL-17不仅是T细胞源性促炎因子,也是炎症反应的微调因子。已证明[9]RA患者血清、滑膜、关节滑液中IL-17高表达。IL-17单独或与IL-1β、TNF-α联合刺激滑膜细胞、软骨细胞/成骨细胞及单核巨噬细胞分泌多种促炎因子,并与其发挥协同效应,放大靶器官免疫反应及炎症性破坏[10]。而且能诱导滑膜细胞、多形细胞产生金属蛋白酶,抑制软骨基质形成,刺激破骨细胞增生,介导骨质破坏。IL-6是由T淋巴细胞、单核细胞和成纤维细胞产生,在调节免疫应答,促进骨髓造血等方面均有重要作用。IL-6作为炎性介质对 RA致病作用主要在于增加 IL-1、TNF-α效应,是TNF-α的某些生物学效应的放大因子。IL-6具有前炎症功能,促进RA产生自身抗体及促进骨吸收的作用,参与RA的骨破坏及局部骨侵蚀。IL-6是第一个被认识的IL-17的靶基因,同时作为Th-17细胞分化过程中的必须因子正反馈调节IL-17的产生及功能[11,12],同时,IL-17又通过诱导IL-6维持Th-17细胞数量,以正反馈形式维持一种慢性炎症状态[13]。TNF-α参与RA多种致病机制,TNF-α诱导内皮细胞表达粘附分子,促进白细胞与血管内皮细胞进行粘附渗透引起局部炎症。通过NF-κB途径诱导纤溶酶原激活物、血管内皮生长因子等,促进滑膜的炎症和血管翳生成及发展,以及浸入滑膜下组织,促进软骨细胞及成纤维细胞分泌地诺前列酮,促进胶原降解及软骨损害[14]。由此可知,炎性因子参与RA的发病及病理损伤过程。炎性因子相互作用,相互促进,级联反应形成一个复杂的网络链,持续性、进行性损伤关节滑膜,乃至残损性骨破坏。本实验同时检测了NF-κB、P53等相关信号分子(相关文章在发表中),结果与文献报道相符[8,15],证明CIA模型成模12周内,能更确切的反映出活动期RA的病理特征及其机制。可能为丰富RA靶向治疗提供有价值的参考。
[1]Baharav E,Mor F,Halpern M,et al.Lactobacillus GG bacteria ameliorate arthritis in Lewis rats[J].J Nutr,2004,134:1964 -1969.
[2]Holmdahl R,Jansson L,Andersson M,et al.Immunogenetics of type II collagen autoimmunity and susceptibility to collagen arthritis[J].Immunology.1988,65(2):305-310.
[3]Ikeda M,Hosoda Y,Hirose S,et al.Expression of vascular endothelial growth factor isoforms and their receptors Flt-1,KDR,and neuropilin-1 in synovial tissues of rheumatoid arthritis[J].J Pathol,2000,191(4):426-33.
[4]陈小军,顾立刚,赵慧,等.桂枝芍药知汤对Ⅱ型胶原诱导性关节炎大鼠IFN-γ及IL-4水平的影响[J].北京中医药大学学报,2007,30(9):618-620.
[5]董宏生,李春红,胡荫奇,等.中药痹愈汤对类风湿关节炎骨破坏和修复的实验研究[J].中国实验方剂学杂志,2009,15(8):80-82.
[6]庞学丰,李玉玲,刘欢,等.热痹康汤对胶原诱导性关节炎大鼠血清基质金属蛋白酶-3的影响[J].风湿病与关节炎,2013,2(4):32-34.
[7]姜泉,曹炜.475例类风湿关节炎患者中医临床证候分析研究[J].中医杂志,2007,48(3):253-255.
[8]龙欣,唐福林.类风湿关节炎临床和基础研究进展[J].武警医学,2010,21(3):185-188.
[9]段发兰,李亚新,胡筱梅,等.活动期类风湿关节炎患者血清及关节液白细胞介素-17水平变化及与有关实验室指标的关系[J].微循环学杂志,2011,21(1):42-43,46.
[10]Weaver CT,Hatton RD,Mangan PR,et al.IL-17 family cytokines and the expanding diversity of effector T cell line ages[J].Annu Rev Immunol.2007,25:821-852.
[11]苗平,陆梅生,张冬青.受体与类风湿关节炎关联性研究新进展[J].免疫学杂志,2011,27(4):355-360.
[12]Liu X,Leung S,Wang C,Crucial role of interleukin-7 in T helper type 17 survival and expansion in autoimmune disease[J].Nat Med.2010,16(2):191-197.
[13]郭小芹,韩根成,黎燕.IL-17/IL-17R信号转导机制及功能的研究进展[J].国际免疫学杂志,2012,35(6):416 -421.
[14]王飙,王立群,杨建琼.炎性因子与类风湿性关节炎相关性的研究[J].中国医疗前沿,2013,8(17):33.
[15]曲世晶,李小峰,王彩虹,等.甲氨蝶呤联合环磷酰胺对胶原诱导性关节炎大鼠滑膜细胞p53表达的研究[J].中华风湿病学杂志,2009,13(1):42-44.
Effects of the Chinese herbal compound,Tengmei decoction,on inflammatory injury in joints of rat models of typeⅡcollagen-induced arthritis
LU Yan1,WANG Ya-nan1,LIU Hui1,MA Wei-guo1,ZHANG Ji-sheng1,TAN Ling2,LI Hui-hui3,LIN Zi-chao1,SHEN Zhi-ming1,WANG Jie1,MENG Feng-xian1
(1.Department of Rheumatology,Dongfang Hospital,the Second Clinical Medical College of Beijing University of Chinese Medicine,Beijing 100078,China;2.Department of Encephalopathy,Integrative Medicine Hospital in Changping District,Beijing 102208;3.Department of Rheumatology,Traditional Chinese Medicine Hospital in Miyun County,Beijing 101500)
Objective To explore the effects of Chinese herbal compound,Tengmei decoction,on type IIcollagen-induced arthritis(CIA)in rats,and to examine the changes of arthritis index(AI),limb swelling,joint tissue inflammatory infiltration,and the effects on immune-inflammatory factors.Methods Sprague-Dawley rat models of arthritis were successfully established by intradermal injection of type II collagen and Freund’s complete adjuvant.The model rats were randomly divided into model group,positive drug group,and high-and low-dose Chinese medicine groups,6 rats in each group.The intervention and treatment period was 12 weeks.To measure weekly the anteroposterior and transverse diameters of the rear ankles and wrists,the transverse diameter of the claw foot palm pad,the thickness and the highest point width of hind limb plantar joint swelling,and to evaluate the integrated scores of joints and limbs swelling using a vernier caliper.Results ①Compared with the normal group,the total arthritis scores and hind limbs AI scores of the model group were significantly increased(P<0.05 or P<0.01).The left forelimb AI scores were significantly increased during 10-12 weeks(P<0.05).The anteroposterior and transverse diameters of the left hind limb,the thickness of the highest point measurement of the left hind foot pad metatarsal were significantly increased(P<0.05 or P<0.01)in different time periods between 1-12 weeks.Compared with the model group,the total scores and the left hind limb joints AI scores of the high-and low-dose drug groups were decreased after 6 weeks(P<0.05).② Compared with the normal control group,levels of mRNA transcription and protein expression of IL-6 and TNF-α were significantly upregulated(P<0.01)in the model group.Compared with the model group,the levels of mRNA transcription and the expression of IL-6 and TNF-α proteins were significantly down-regulated in the positive group and Chinese medicine groups(P<0.01).③ Histological examination showed that the low-dose TCM significantly improved the CIA synovial hyperplasia and inflammatory cell infiltration.Conclusions The molecular mechanism of Chinese herbal compound Tengmei decotion in improving joint pathological injury of CIA rat models may be related to its inhibitory effect on the high expression of immune-inflammatory factors in the synovial tissue of CIA rats.
Chinese herbal compound,Tengmei decoction;Rat models;Arthritis,collagen II-induced;Arthritis index,AI;Pathological changes;Immune-inflammatory mechanism
R33
A
1671-7856(2015)04-0048-10
10.3969.j.issn.1671.7856.2015.004.010
陆妍(1986-),女,研究方向:风湿免疫及代谢性疾病的临床治疗及机制研究。E-mail:tracyloo@163.com。
孟凤仙(1955-),女,研究方向:风湿免疫及代谢性疾病的临床治疗及机制研究。Emai:mfx0823@163.com。
2015-02-03

