四氯化碳诱导肝硬化动物模型的相关影响因素
崔承虎,金世柱,韩明子,李瑞妮,荣为为,孙爆冷
0 引 言
肝硬化是临床常见的慢性进行性肝病,任何引起肝损伤的单一或多种因素长期作用于肝均可引起肝硬化,其发病机制尚未完全明确。病理组织学上以肝细胞大量坏死、结节再生、纤维组织增生和假小叶形成为特点[1]。肝硬化动物模型是肝硬化实验研究的基础。CCl4诱导大鼠肝硬化模型因其操作简便、价廉、病变典型,目前被广泛用于肝硬化动物模型的建立[2],但在CCl4模型中有多种因素影响建模效果,如药物浓度、给药方式等,而关于评价建模效果的研究尚少。Shen 等[3]皮下注射50%CCl4制造肝硬化模型,Hou 等[4]腹腔注射40%CCl4制造肝硬化模型,Semenov 等[5]则通过灌胃法建立动物肝硬化模型。目前尚无统一的标准制作肝硬化动物模型。本实验通过析因设计实验研究CCl4不同给药途径、浓度、给药时间建立肝硬化动物模型效果。
1 材料与方法
1.1 实验动物与材料 健康清洁级雄性SD 大鼠共90 只,3 周龄,体重80 ~120 g,实验动物合格证号:SCXK(黑)2012003,购于我院实验动物中心。分析纯CCl4(西陇化工股份有限公司,批号:140319),分析纯橄榄油(国药集团化学试剂有限公司,批号:20140422),无水乙醇(天津市天力化学试剂有限公司,批号:20140612),日立7020 全自动生化分析仪(日本Hitachi 公司)。
1.2 建模方法和分组 本实验有给药途径(A)、浓度(B)、给药时间(C)3 个因素,其中A 因素有皮下注射(A1)、腹腔注射(A2)、灌胃(A3)等3 个水平,B 因素有30% (B1)、50% (B2)2 个水平,C因素有8 周(C1)、10 周(C2)、12 周(C3)等3 个水平,共计18 个处理组,每组5 只。具体分组方法为A1B1C1:皮下注射+30%CCl4油剂+持续给药8周;A1B2C1:皮下注射+50%CCl4油剂+持续给药8周;以此类推。每组按各自给药途径和浓度给予CCl4-橄榄油溶液,3 天1 次,首次剂量为5 mL/kg,以后为3 mL/kg。每组大鼠以30%乙醇为唯一饮料。
1.3 大鼠模型取材检测 各组在规定时间采血及处理肝组织。具体方法为腹腔注射水合氯醛予以麻醉,固定后在腹中部做适当切口充分暴露腹腔,寻找下腔静脉用真空采血管采血,待离心后检测血清总胆红素(total bilirubin,TBil)、血清前清蛋白(prealbumin,PA)、血清清蛋白(albumin,Alb)、凝血酶原时间国际标准化比值(prothrombin time-international normalized ratio,PT-INR)、血清肌酐(serum creatinine,SCr)等,同时取肝组织行HE 染色和Masson 三色染色。采用肝硬化疾病评分模型(scoring model for liver cirrhosis disease,SLCD)和拉埃内克纤维化评分系统(Laennec fibrosis scoring system,LFSS)分别求得血清学和组织学上的肝硬化分值R值和L 值。
1.4 评分系统 SLCD 为血清学评分系统[6],选取了年龄、TBil、Alb、PA、PT-INR、SCr 等检测指标,R值计算公式如下:
R=0.16×(20-W)/10+0.24×(17.06-T)/16.44+0.2×(A-10.33)/11.95+0.14×(P-2.93)/11.63+0.14×(0.92-I)/0.16+0.12×(32.11-C)/11.61
根据R 值的大小判断肝硬化严重程度。R=1表示肝组织正常,0.702≤R <1 表示肝炎症反应和局灶性变形,0.542≤R <0.702 表示肝出现纤维组织增生现象,0.352≤R <0.542 表示假小叶形成为肝硬化期,R <0.352 表示肝硬化后期。式中W、T、A、P、I、C 分别代表大鼠年龄、TBil、Alb、PA、PT-INR、SCr 的血清检测值。
LFSS 为组织学上评估肝纤维化及肝硬化程度的评分系统[7],以L 值表示。根据纤维隔的宽度和数量以及假小叶的数量将肝纤维化和肝硬化程度分为0 ~4 期,4 期又分为4A、4B、4C 期,其中0 期为正常肝组织、1 ~3 期为纤维化期、4A ~4C 为肝硬化期,0 ~4C 期分别对应L 值为0 ~6 分。
1.5 统计学分析 采用SPSS 19.0 软件进行分析,所有定量资料采用均数±标准差()表示,统计方法采用F 检验,生存时间曲线分析使用Log-rank检验,以P≤0.05 为差异有统计学意义。
2 结 果
2.1 SLCD 析因分析 腹腔注射组R 值<皮下注射组和灌胃组,50% CCl4油剂组<30% CCl4油剂组,随着给药时间的延长R 值呈降低趋势,析因方差分析结果显示3 种因素主效应差异均有统计学意义(P <0.05)。见表1。析因方差分析表明,给药方式与给药时间及药物浓度均相关(P <0.05)。随着给药时间的延长,腹腔注射组R 值降低趋势大于皮下注射组和灌胃组。见图1。
2.2 LFSS 析因分析 各组大鼠肝硬化LFSS 评分L 值,结果见表2,可见腹腔注射组L 值>皮下注射组L 值、灌胃组,50%CCl4油剂组L 值>30%CCl4油剂组,12 周组>10 周组>8 周组。析因方差分析结果显示3 种因素主效应差异均有统计学意义(P<0.05),给药方式与给药时间药物浓度组之间无相互关系(P >0.05)。
2.3 生存分析 用Kaplan-Meier 法分析A1B1、A1B2、A2B1、A2B2、A3B1、A3B2大鼠的生存率分别为62.22%、52.15%、74.67%、57.03%、61.63%和48.12%,死亡率分别为37.78%、47.85%、25.33%、42.97%、38.37%和51.88%,可见腹腔注射组、皮下注射组、灌胃组的死亡率依次升高,50%CCl4组死亡率>30%CCl4组;但经log-rank 检验比较各组生存曲线,不同给药方式组及药物浓度组之间差异并无统计学意义(P >0.05)。见图2。
表1 各组大鼠SLCD 评分R 值比较(x±s)Table 1 The R value of different groups of rats based on the Scoring Model for Liver Cirrhosis Disease
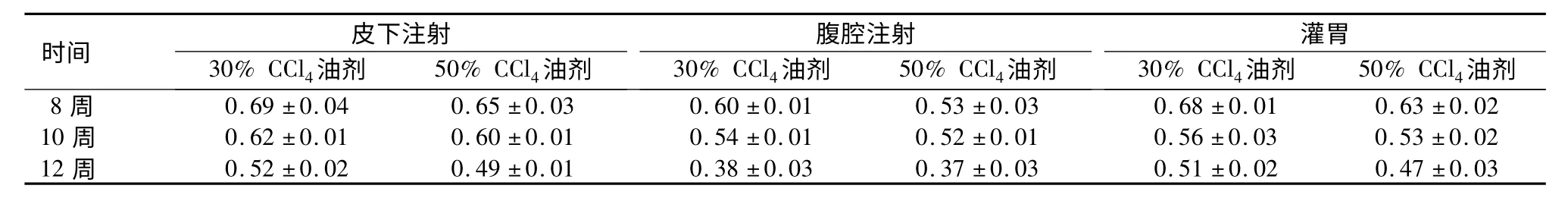
表1 各组大鼠SLCD 评分R 值比较(x±s)Table 1 The R value of different groups of rats based on the Scoring Model for Liver Cirrhosis Disease
时间30%CCl4油剂皮 下注射50%CCl4油剂30%CCl4油剂腹 腔注射50%CCl4油剂30%CCl4油剂灌胃50%CCl4油剂8 周 0.69±0.04 0.65±0.03 0.60±0.01 0.53±0.03 0.68±0.01 0.63±0.02 10 周 0.62±0.01 0.60±0.01 0.54±0.01 0.52±0.01 0.56±0.03 0.53±0.02 12 周 0.52±0.02 0.49±0.01 0.38±0.03 0.37±0.03 0.51±0.02 0.47±0.03

图1 SLCD 相互关系轮廓图Figure 1 Contour maps for correlation among different groups based on the Scoring Model for Liver Cirrhosis Disease
表2 各组大鼠LFSS 评分L 值比较Table 2 The L value of different groups of rats based on the Laennec Fibrosis Scoring System
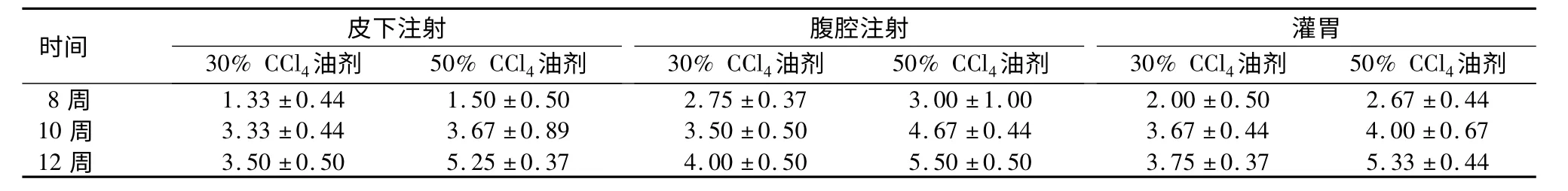
表2 各组大鼠LFSS 评分L 值比较Table 2 The L value of different groups of rats based on the Laennec Fibrosis Scoring System
时间30%CCl4油剂皮 下注射50%CCl4油剂30%CCl4油剂腹 腔注射50%CCl4油剂30%CCl4油剂灌胃50%CCl4油剂8 周 1.33±0.44 1.50±0.50 2.75±0.37 3.00±1.00 2.00±0.50 2.67±0.44 10 周 3.33±0.44 3.67±0.89 3.50±0.50 4.67±0.44 3.67±0.44 4.00±0.67 12 周 3.50±0.50 5.25±0.37 4.00±0.50 5.50±0.50 3.75±0.37 5.33±0.44

图2 大鼠生存曲线比较Figure 2 Survival curves of different groups of rats
3 讨 论
目前主要肝硬化模型包括酒精性、化学性损伤、胆管结扎性、血吸虫性、免疫性损伤[21]、肝炎性肝硬化模型[22]。其中肝炎性肝硬化模型最常用的方法有肝炎病毒转基因模型和人类肝嵌合模型,但均因小鼠的免疫机制对病毒抗原耐受,无法观察到宿主的免疫应答过程,肝炎性肝硬化模型常用来评估抗病毒药物的药效。
最常用的化学性损伤肝硬化模型应用的药物有CCl4,其为无色透明的具有强烈肝毒性的挥发性液体,肝是CCl4主要的代谢场所。现普遍认为CCl4经肝细胞细胞色素P450依赖性混合功能氧化酶的代谢生成高活性三氯甲基自由基(-CCL3),后者启动脂质过氧化作用破坏肝细胞膜,引起肝细胞损伤,最终形成肝硬化[2,8]。CCl4诱导肝硬化动物模型由于其操作简便、价廉、病变典型,目前广泛被用于肝硬化动物模型的建立,但成模率低、死亡率高是其缺点。
我们的结果显示不同给药方式与动物模型肝硬化严重程度存在相关性,即腹腔注射组肝硬化程度重于灌胃组和皮下注射组。腹腔注射是将药物打入肠道浆膜层外,药物被腹膜吸收后经门静脉直接进入肝,有操作简单、吸收快、肝药物浓度高等优点[9]。因此,腹腔注射法能够缩短造模时间,提高生存率。皮下注射CCl4由于其经吸收后进入全身循环,不但增加了脑、肾等毒性,还减少了肝药物浓度,延长造模时间,并且易引起注射部位的坏死和脓肿,降低造模效率[10-11]。
统计分析结果还显示随着药物浓度的增加和给药时间的延长,肝硬化程度越明显。这与肝硬化发生和发展的病理过程一致。随着CCl4浓度的升高,产生更多的自由基从而发挥更大的毒性作用。但是药物浓度的提高缩短造模时间的同时增加了死亡率。本实验中50%CCl4浓度组死亡率高于30%组,但经log-rank 检验比较两组生存率差异并无统计学意义,这可能与B 因素选取水平数少有关。
乙醇作为肝硬化重要致病因素,与CCl4联合应用能够提高造模效率。长期过度饮酒可导致人类肝硬化的发生和发展。乙醇在肝经代谢产生乙醛,后者能与蛋白质结合干扰正常的代谢从而产生直接细胞毒性作用。同时乙醇能诱导P450活性,加速CCl4向-CCL3转化,从而增加CCl4的肝毒性[12]。因此,联合应用乙醇不仅能减少CCl4浓度,而且还能够缩短造模时间,提高造模率[13-15]。
目前临床常用的肝硬化评分有CTP 分级和终末期肝病模型[23],但有诸多缺点[16-17]。CTP 分级将肝硬化分为A、B、C 3 个等级,缺乏连续性,并且腹水和肝性脑病的分级受主观因素的影响,难以客观正确的分级。MELD 能够准确评估晚期肝硬化,但对早期肝炎症、坏死、纤维化等病变无法做出判断,并且因公式中缺乏门脉高压及并发症的相关指标,无法判断门脉高压及并发症的预后。SLCD 相比CTP 分级和MELD 有以下优势:①所用到的6 项指标能客观的反映肝功能储备[18-19],使评分依据更加客观;②不仅能对终末期肝硬化进行评估,还能对早期肝脏炎症和纤维化阶段进行评估;③通过以数值的形式表达,使评分更具有准确性和连续性。病理学检查是诊断肝硬化的金标准。大多数肝纤维化评分系统[7,20,24],比如Metavir 评分单纯把肝硬化阶段分成一个类别,并没对肝硬化亚型分类,显著降低了评估细致性。而LFSS 评分不仅简单易懂,并且通过对肝硬化亚型分类,显著提高了评估的连续性,增加了肝硬化实验研究的准确性和可行性[7]。
本实验尚有诸多局限性。设计实验时考虑到因素数与水平数不宜过多,在药物浓度因素上只选取了2 个水平,这只能代表2 个水平组生存曲线之间差异无统计学意义,并不能代表其他药物浓度(如空白对照组)的情况。在操作过程中有些不可避免因素可能会影响实验结果,比如操作时引起的组织损伤(灌胃时对食管和胃的损伤,皮下注射、腹腔注射时引起的局部出血或坏死等)影响实验结果。本LFSS 评分系统虽然对肝硬化亚型分类,但评分为整数,仍缺乏连续性,影响了实验准确性。
总之,不同给药方式及药物浓度诱导动物肝硬化模型有显著影响,腹腔注射法不仅操作简单,而且能够缩短造模时间,减少动物死亡率,最终提高造模效率,值得在动物实验中广泛推广。
[1] Suraj S,Korosh K,Geoffrey CN.Non-invasive diagnosis of advanced fibrosis and cirrhosis[J].World J Gastroenterol,2014,20(45):16820-16830.
[2] Keiko I,Jiang CY,Zhang MJ,et al.Origin of myofibroblasts in the fibrotic liver in mice[J].Proc Natl Acad Sci USA,2014,111(32):E3297-E3305.
[3] Shen X,Cheng SS,Peng Y,et al.Attenuation of early liver fibrosis by herbal compound"Diwu Yanggan"through modulating the balance between epithelial-to-mesenchymal transition and mesenchymal-to-epithelial transition[J].BMC Complement Altern Med,2014,14(1):418-428.
[4] Hou YL,Tsai YH,Lin YH,et al.Ginseng extract and ginsenoside Rb1 attenuate carbon tetrachloride-induced liver fibrosis in rats[J].BMC Complement Altern Med,2014,14(1):415-425.
[5] Semenov DE,Zhukova NA,Ivanova EP,et al.Hepatoprotective properties of betulonic Acid amide and heptral in toxic liver injury induced by carbon tetrachloride in combination with ethanol[J].Bull Exp Biol Med,2015,158(3):336-341.
[6] 王正华,郑 军,王群兴,等.肝硬化疾病评分模型实验研究[J].第二军医大学学报,2011,32(5):485-489.
[7] Kim MY,Cho MY,Baik SK,et al.Histological subclassification of cirrhosis using the Laennec fibrosis scoring system correlates with clinical stage and grade of portal hypertension[J].J Hepatol,2011,55(5):1004-1009.
[8] Brai BI,Adisa RA,Odetola AA.Hepatoprotective properties of aqueous leaf extract of Persea Americana,Mill(Lauraceae)'avocado'against CCL4-induced damage in rats[J].Afr J Tradit Complement Altern Med,2014,11(2):237-244.
[9] Chen YW,Tsai MY,Pan HB,et al.Gadoxetic Acid-enhanced MRI and sonoelastography:non-invasive assessments of chemoprevention of liver fibrosis in thioacetamide-induced rats with shosaiko-to[J].PLoS One,2014,9(12):e114756.
[10] Akira M,Yoshiki I,Chai GX,et al.Role of STAT3 in liver regeneration:survival,DNA synthesis,inflammatory reaction and liver mass recovery[J].Lab Invest,2007,87(10):1018-1028.
[11] Marco D,Paolo C,Ferdinando G,et al.A novel model of CCL4-induced cirrhosis with ascites in the mouse[J].J Hepatol,2009,51(6):991-999.
[12] Sonia R,Eloy AZC,Laura EML,et al.Alcoholism and liver disease in Mexico:Genetic and environmental factors[J].World J Gastroenterol,2013,19(44):7972-7982.
[13] 王庐荆,贺 德,胡 翔,等.生态免疫营养对缺血再灌注的肝硬化大鼠肝脏保护的作用[J].广东医学,2013,34(3):359-361.
[14] Su XS,Wang YQ,Zhou GY,et al.Probucol attenuates ethanolinduced liver fibrosis in rats by inhibiting oxidative stress,extracellular matrix protein accumulation and cytokine production[J].Clin Exp Pharmacol Physiol,2014,41(1):73-80.
[15] Dian JC,Sanjoy R,Katelyn B,et al.Adenosine 2A receptor antagonist prevented and reversed liver fibrosis in a mouse model of ethanol-exacerbated liver fibrosis[J].PLoS One,2013,8(7):e69114.
[16] Eleazar C,Eduardo M,Bruno BV,et al.The impact of the introduction of MELD on the dynamics of the liver transplantation waiting list in Sαo Paulo,Brazil[J].J Transplant,2014,2014:219789.
[17] Gallegos-Orozco JF,Vargas HE.Liver transplantation:from Child to MELD[J].Med Clin North Am,2009,93(4):931-950.
[18] 强占荣,易彩霞,林 中,等.急慢性肝病患者血清白蛋白、前白蛋白及胆碱酯酶的变化特点[J].广西医学,2010,32(5):513-515.
[19] Chen TF,Gong ZJ.Comparative and retrospective analysis of prognosis on patients with severe hepatitis treated with artificial liver support system using the model for end-stage liver disease and Child-Turcotte-Pugh score system[J].Chinese Hepatology,2008,13(1):7-10.
[20] Kim SU,Jung KS,Lee S,et al.Histological subclassification of cirrhosis can predict recurrence after curative resection of hepatocellular carcinoma[J].Liver Int,2014,34(7):1008-1017.
[21] Koichi S,Kazunori A,Shumpei O,et al.Adenovirus-mediated gene transfer of interferon alpha inhibits hepatitis C virus replication in hepatocytes[J].Biochem Biophys Res Commun,2003,307(4):814-819.
[22] Philip M,Louis L,Rita DV,et al.Morphological and biochemical characterization of a human liver in a uPA-SCID mouse chimera[J].Hepatology,2005,41(4):847-856.
[23] 冯 洁,潘存伟,黄成军.非侵入性方法预测肝硬化食管静脉曲张程度的研究[J].医学研究生学报,2013,26(5):501-504.
[24] 李鸿利,韦 嘉,袁 媛,等.超声在监测兔酒精性脂肪肝模型建立中的应用[J].医学研究生学报,2015,28(5):486-490.

