乳清分离蛋白在难溶性钙盐表面吸附特性的研究
文丽杰,刘影帝,刘小鸣,胡锦华,*,周 鹏,,3,*
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;>2.江南大学食品学院,江苏无锡 214122;>3.江南大学食品安全与营养协同创新中心,江苏无锡 214122)
乳清分离蛋白在难溶性钙盐表面吸附特性的研究
文丽杰1,刘影帝1,刘小鸣2,胡锦华1,*,周 鹏1,2,3,*
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;>2.江南大学食品学院,江苏无锡 214122;>3.江南大学食品安全与营养协同创新中心,江苏无锡 214122)
本文主要研究了乳清分离蛋白(WPI)在三种难溶性钙盐表面的吸附特性及吸附WPI后钙盐的分散稳定性,考察的钙盐包括碳酸钙、羟基磷灰石和磷酸三钙。测定了WPI的吸附对钙盐颗粒的表面电荷、激光共聚焦成像、吸附等温线、吸附竞争性以及浊度的影响。实验结果表明,WPI在钙盐表面存在吸附,并引起了钙盐表面电荷量的增加;WPI与三种钙盐发生了不同类型的吸附行为;WPI中的β-乳球蛋白在钙盐表面的吸附优先于α-乳白蛋白;吸附WPI后的钙盐颗粒在溶液浊度测定时表现出比原本钙盐颗粒分散液更好的稳定性。该研究对改善高钙牛奶及高钙饮料的稳定性方面具有重要意义。
乳清分离蛋白,碳酸钙,磷酸钙,吸附,悬浮稳定性

近期有学者研究了乳蛋白在羟基磷灰石上的吸附[11],以此为基础,本研究旨在以食品中常用的蛋白配料——乳清分离蛋白(WPI)为研究对象,探索其在不同钙盐表面的吸附过程以及蛋白和钙盐之间的相互作用机理,为改善高钙食品及高钙饮料的稳定性提供理论依据。
1 材料与方法
1.1 材料与仪器
乳清分离蛋白(WPI 90) 美国Hilmar公司;碳酸钙(CaCO3) 日本Maruo公司,由比表面积检测法(BET法)测得CaCO3平均粒径1.30 μm,比表面积为13.8 m2/g;羟基磷灰石(HA,Ca5(PO4)3OH)和磷酸三钙(TCP,Ca3(PO4)2) 德国Budenheim化学公司,测得HA和TCP的平均粒径d(50)分别为2.06,1.93 μm,BET法测得比表面积分别为88.6、67.2 m2/g;异硫氰酸荧光素(FITC) 美国Sigma公司;其它试剂均为分析纯,实验用水为超纯水。
S3500激光粒度分析仪 美国麦奇克公司;Nano-ZS激光粒度仪 英国马尔文公司;TCS SP8激光共聚焦显微镜 德国莱卡公司;Gel Doc EZ凝胶成像仪 美国Bio-Rad公司;SevenEasy pH计 瑞士梅特勒-托利多公司;UV-1200可见分光光度计 上海美谱达公司。
1.2 实验方法
1.2.1 WPI在钙盐表面的吸附 根据不同的实验目的,在实验设计中采用两种不同的吸附方式。吸附方式1:精密称取20 mg难溶性钙盐置于0.5 mL超纯水,形成钙盐分散液,再加入0.5 mL WPI溶液(0.04~40 mg/mL),最终蛋白和钙盐悬浮液中的WPI浓度在0.02~20 mg/mL。悬浮液在室温下用旋转培养器培养2.5 h,确保钙盐对蛋白的吸附达到平衡[12-13],离心(7000 r/min,7 min)后分离沉淀和上清液,分别作进一步的检测。吸附方式2:为测定WPI中不同蛋白组分在钙盐表面吸附过程的差异性,分别称取2~450 mg钙盐于0.5 mL超纯水中,制备成钙盐分散液,再加入WPI溶液(0.5 mL,4 mg/mL)制成二者的共混悬浮液,在室温下旋转培养2.5 h后进行离心,将取得的上清液用聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分析,考察WPI中不同蛋白组分在吸附过程中的差异性。
1.2.2 钙盐吸附WPI前后颗粒表面电荷的变化 将悬浮液离心后所得的沉淀重新分散在超纯水中(0.05% w/w),用马尔文ZetasizerNano-ZS对再分散液进行表面电位的检测,保持温度20 ℃。重复实验三次。
1.2.3 WPI吸附在钙盐表面的图像表征 采用激光共聚焦显微镜进一步观察WPI在钙盐表面的吸附。将悬浮液离心后所得的沉淀重新分散在超纯水中得到浓度为0.05%(w/w)的再分散液,对照组为不添加WPI的钙盐分散液。用FITC进行染色后,在40×镜头和488 nm Ar/Kr的激光器下,通过FITC荧光通道观察图像。
1.2.4 钙盐吸附WPI后颗粒表面蛋白浓度的测定 为检测吸附在钙盐颗粒表面的蛋白量,采用Lowry法[14]分析吸附了WPI(WPI初始浓度小于1 mg/mL)后的CaCO3在水相中的再分散液经过离心后得到的上清液;采用Biuret法[15]分析HA和TCP吸附了WPI后的再分散液经离心分离后得到的上清液。上清液中蛋白量与初始蛋白浓度的差值就是被吸附到钙盐上的蛋白量,表面蛋白浓度则通过被吸附的蛋白量与钙盐颗粒的总表面积进行计算。重复实验三次。
1.2.5 WPI中不同蛋白组分在钙盐颗粒表面吸附过程的差异性考察 准确吸取0.5 mL按照吸附方式2制得的钙盐再分散液经过离心后得到的上清液,与0.5 mL样品缓冲液(0.5 mol/L Tris,4.0% w/v SDS和0.01% w/v溴酚蓝)混合,用沸水浴煮沸3 min后冷却,然后准确取样20 μL,上样于SDS胶板(12%的分离胶和4%的浓缩胶),用考马斯亮蓝R-250溶液对蛋白染色,再用7.5%乙酸和5%甲醇溶液脱色。通过凝胶成像仪定量分析蛋白条带亮度的变化,用上清液中的蛋白余量与初始蛋白总量的比值变化来分析上清液中的残余蛋白在不同实验条件下的差异性。实验重复三次。
1.2.6 钙盐吸附WPI后的再分散液的溶液稳定性表征 将表面吸附了WPI之后的钙盐重新分散到超纯水中,得到0.125%(w/w)再分散液,用可见分光光度计进行浊度的表征,记录900 nm[11]波长下120 min内的再分散液吸光度值的变化。通过(1)式得到溶液吸光度值随时间的减少量:
吸光度值变化(%)=(At/A0)×100
式(1)
式中,At为t时间再分散液的吸光度值,A0为起始吸光度值。重复实验三次。
1.3 数据统计分析
数据统计采用SAS8.0软件,方差分析使用一般线性模型,当p<0.05时,认为在统计学上有显著性差异。
2 结果与讨论
2.1 表面电位的表征
分别测定WPI和难溶性钙盐在超纯水中的pH,测得WPI水溶液的pH为7.0,HA和TCP分散液的pH均在7.0~7.5范围内,而CaCO3的水相分散液pH约为9.3。考虑到引入其他离子可能会对WPI在钙盐颗粒表面吸附过程和特性造成影响,因此本实验没有进行pH的调节。本实验仅在纯水相介质中研究WPI在钙盐颗粒表面的吸附和它们之间的相互作用。
ζ-电位表征了分散在水中的颗粒其表面所带电荷的状态。图1是CaCO3、HA和TCP颗粒表面吸附了不同浓度的WPI后ζ-电位的变化情况。如图1所示,加入了WPI之后,钙盐颗粒表面的ζ-电位绝对值增大,随着WPI浓度的增加,表面电位会达到最大值。例如,超纯水中不添加蛋白的TCP,其颗粒表面ζ-电位值为-2.7 mV,随着添加的WPI蛋白浓度逐渐增大到2 mg/mL,TCP的ζ-电位变化到-13.2 mV,但是继续增大蛋白的浓度,ζ-绝对值则不再变化。WPI的等电点约为pH4.2~pH5.3,当溶液的pH高于其等电点时,WPI蛋白组分本身带负电荷,因此当加入了WPI后TCP表面ζ-电位的变化表明WPI被吸附到了钙盐颗粒表面,从而使钙盐颗粒表面带上了更多负电荷。当蛋白在钙盐颗粒表面的吸附达到饱和状态后,ζ-电位不再变化。

图1 CaCO3、HA和TCP颗粒表面ζ-电位随吸附WPI浓度的变化Fig.1 The ζ-potential change of CaCO3,HA and TCP upon different WPI concentration
2.2 激光共聚焦表征
激光共聚焦(CLSM)图像(图2)进一步证实了WPI在不同种类的钙盐颗粒表面的吸附。FITC是针对蛋白染色的荧光染料,在只含有钙盐的对照组(未给出)的成像中证实FITC不能对钙盐染色。将钙盐与WPI旋转培养2.5 h后离心,将所得到的沉淀进行再分散,用FITC染色后通过激光共聚焦显微镜的FITC通道进行观察。如图2所示,不同钙盐的颗粒表面都吸附上了WPI,在FITC图像中可以观察到在没有被染色的钙盐颗粒(黑色的、近似球状的中心)的外部包裹了一圈灰色圆环,也就是被FITC染色的WPI吸附到了钙盐颗粒表面。

图2 吸附WPI后CaCO3,HA和TCP颗粒激光共聚焦图像Fig. 2 CLSM images of CaCO3,HA and TCP coated with WPI

对于HA和TCP而言,二者都属于磷酸钙盐,它们的基本元素组成相同,HA和TCP上都存在2种不同类型的吸附位点,即C-位点(钙离子)和P-位点(磷酸根离子)[18-19]。与CaCO3类似,C-位点与WPI的羧基、P-位点与WPI的氨基都能通过静电相互作用进行结合,且C-位点与羧基的亲和力大于P-位点与氨基的亲和力。因此C-位点与WPI的羧基间的作用是WPI在HA和TCP上吸附的主要驱动力。
2.3 吸附等温线的表征
图3用吸附等温线表达了WPI在三种不同钙盐颗粒上吸附行为。吸附等温线描述的是吸附过程,通常分为4种类型,即C、L、H和 S型等温线[20]。C型等温线是一条过原点的直线,表明吸附质在液相和吸附剂表面相的分配比是恒定的。L型等温线是最常见的吸附模式,表现为吸附质在吸附剂表面逐渐增多,直到达到吸附饱和,并且在达到吸附饱和前,曲线的斜率几乎不变。H型等温线是一种特殊的L型等温线,表现为在很低的浓度下,吸附质就能被显著地吸附,使得曲线的初始斜率接近无穷。S型等温线的起始部分斜率小,当液相吸附质的平衡浓度达到一定值,吸附等温线会出现一个突跃,其后曲线的增长又趋于平缓。从图3中可以看出,WPI在CaCO3表面的吸附等温线可以归类于S型。这可以解释为:溶剂(水)在吸附剂(CaCO3)表面有强烈的竞争吸附,所以在低浓度时,吸附质(WPI)在钙盐表面没有明显的被吸附优势,而当吸附质的平衡浓度增加到一定值时,已被吸附的WPI分子对溶液中的WPI有明显的吸引作用。WPI在HA表面的吸附等温线则是明显的L型,平衡时溶液中WPI浓度的增加,被HA表面吸附的WPI逐渐增加,直到达到吸附饱和状态。WPI在TCP表面的吸附等温线表现为H型,在低浓度下,WPI就显著被吸附在TCP上,说明TCP对WPI拥有很高的亲和性。同属于磷酸钙类的HA和TCP在吸附WPI的过程中表现出了明显不同的吸附类型和吸附量(表面蛋白浓度),这可能主要是由两种磷酸钙晶体结构的差异性引起的。一方面,HA中的Ca与磷酸基团的距离一般小于TCP晶胞中的Ca与磷酸基团的距离,从晶体结构上判断HA中Ca和磷酸基团的反应活性小于TCP中的;另一方面,TCP晶胞中单位面积的Ca和磷酸基团的数目明显地多于HA[21]。因此,在HA和TCP比表面积相差不大的情况下(HA和TCP的比表面积分别为88.6、67.2 m2/g),TCP对WPI的亲和力和吸附量显著高于HA。

图3 CaCO3、HA和TCP对WPI的吸附等温线Fig.3 The adsorption isotherms of WPI onto CaCO3,HA and TCP
2.4 表面蛋白组成和优先吸附
图4是在钙盐颗粒吸附了WPI后,用SDS-PAGE定量分析了WPI中不同蛋白组分在上清液中的残余量的变化情况。与对照组(纯WPI溶液)相比,蛋白条带的整体强度是随着钙盐添加量的增加而逐渐减小的,说明被钙盐颗粒吸附之后,留在上清液中的蛋白浓度逐渐减小。将WPI中的不同蛋白组分β-乳球蛋白(β-Lg)和α-乳白蛋白(α-La)的条带进行比较可以发现WPI在三种不同的钙盐颗粒表面的吸附过程类似,β-Lg的条带强度减弱的程度要比α-La的条带更为快速,说明β-Lg比α-La在钙盐颗粒表面的吸附更具优势。如图4A1和图4A2所示,当CaCO3浓度达到450 mg/mL时,上清液中几乎没有β-Lg存在,而仍有约1/3的α-La残留。也就是说WPI中β-Lg和α-La在这三种钙盐表面相互作用时,β-Lg会被优先吸附。
WPI的不同组分在钙盐表面吸附过程的差异性或许与蛋白的电荷分布有关。有研究表明蛋白表面的电荷分布对HA与蛋白间的亲和力非常重要[9]。β-Lg所带正电荷均匀分布在其表面,而α-La的正电荷主要集中在一个区域[22-23],因此,电荷分布的差异使得β-Lg能在钙盐颗粒表面被优先吸附。另一方面,β-Lg的等电点为pH5.2,α-La的等电点则在pH4.3左右[24]。在本实验条件下(pH7),α-La比β-Lg所带净负电荷更多,与同样带负电荷的钙盐间静电排斥力更大,从而一定程度上阻碍了钙盐表面对α-La的吸附。此外,从动力学角度来看,到达界面的速率也会决定混合物中组分吸附行为的差异性[25]。β-Lg是WPI中的主要蛋白组分,其含量大于α-La,在与钙盐颗粒表面相互作用时,量多的β-Lg比α-La更有优势。
2.5 悬浮液稳定性的表征
通过分光光度法来表征一定时间内的悬浮液的稳定性。图5是吸附了WPI后的钙盐再分散液的溶液吸光度随时间的变化情况。不同的钙盐颗粒吸附WPI后,其再分散液都表现出了相似的稳定性变化。没有吸附WPI的对照组沉降速率很快,而WPI的吸附使得钙盐再分散液的稳定性有了明显的改善。以吸附了WPI的CaCO3为例(图5A),增加WPI的浓度,可以看到再分散液的溶液吸光度值减小的速率显著下降,也就是说吸附了更多WPI的CaCO3颗粒沉降速率下降,钙盐再分散液的稳定性得到明显改善。同样的现象在吸附了WPI的HA和TCP中也能被观察到。
图6所示为吸附了WPI的钙盐再分散液(10% w/w)在室温下静置10 h后的照片。与图5的结果一致,加入WPI的蛋白浓度越高,钙盐再分散液的稳定性改善效果越好,达到吸附饱和后,蛋白浓度对钙盐再分散液的溶液稳定性则没有更进一步的提升。

图4 WPI组分在三种钙盐上的吸附优先性Fig.4 The adsorption difference of β-Lg and α-La onto various calcium particles注:A1~C1为上清液残留WPI蛋白组分的SDS-PAGE凝胶电泳;A2~C2为电泳图对应的定量分析;A:CaCO3;B:HA;C:TCP;电泳图上的数字表示难溶性钙盐的浓度(mg/mL)。
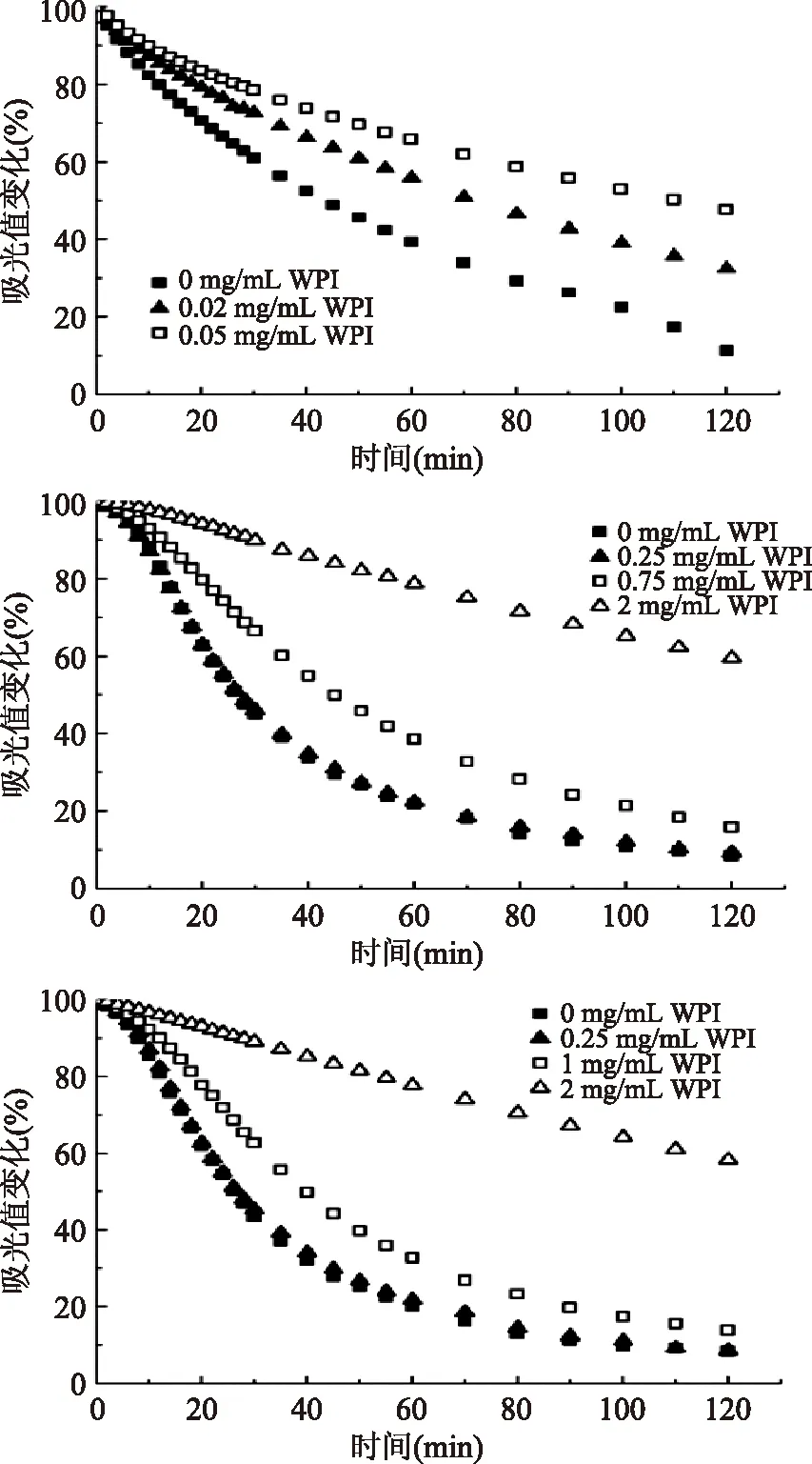
图5 吸附了WPI的CaCO3、HA和TCP的再分散液(0.125% w/w)的溶液稳定性随时间的变化Fig.5 Suspension stability of CaCO3,HA and TCP particles(0.125% w/w)coated with WPI

图6 静置10 h后WPI吸附量对钙盐分散液的悬浮稳定性影响Fig.6 Apparent stability of CaCO3、HA and TCP particles coated with WPI after 10 h注:制备吸附WPI的CaCO3中WPI浓度:O~D分别为0、0.02、0.05、0.075、0.2 mg/mL WPI;制备吸附WPI的HA中WPI浓度:O~D分别为0、0.5、1、2、4 mg/mL WPI;制备吸附WPI的TCP中WPI浓度:O~D分别为0、0.5、2、4、6 mg/mL WPI,离心得到吸附WPI后的钙盐重新分散在水中得到悬浮液(2% w/w)静置10 h后拍照。
3 结论
本文研究了WPI在三种难溶性钙盐(CaCO3、HA及TCP)的颗粒表面的吸附过程。WPI与钙盐之间主要是通过钙盐颗粒表面的Ca2+位点和WPI的羧基之间较为强烈的相互作用以及钙盐颗粒表面的碳酸根或磷酸根与WPI的氨基间相对弱势的相互作用进行吸附。与α-La相比,β-Lg在三种钙盐表面的吸附更具优势。吸附了WPI之后的钙盐比钙盐自身带有更多的负电荷,其再分散液都显示出更好的溶液稳定性。这将为研发货架期内产品性质更加稳定的高钙食品及高钙饮料提供实验依据。
[1]Nagahara K,Isogai M,Shibata K,et al. Osteogenesis of hydroxyapatite and tricalcium phosphate used as a bone substitute[J].The International Journal of Oral & Maxillofacial Implants,1992,7(1):72-79.
[2]Sudo S,Fujikawa T,Nagakura T,et al. Structures of mollusk shell framework proteins[J]. Nature,1997,387(6633):563-564.
[3]Siffert B,Fimbel P. Parameters affecting the sign and magnitude of the eletrokinetic potential of calcite[J]. Colloids and Surfaces,1984,11:377-389.
[4]Fowkes F M,Mostafa M A. Acid-Base Interactions in Polymer Adsorption[J]. Industrial & Engineering Chemistry Product Research and Development,1978,17(1):3-7.
[5]Somasundaran P,Agar G E. The zero point of charge of calcite[J]. Journal of Colloid and Interface Science,1967,24(4):433-440.
[6]Pokrovsky O S,Mielczarski J A,Barres O,et al. Surface Speciation Models of Calcite and Dolomite/Aqueous Solution Interfaces and Their Spectroscopic Evaluation[J]. Langmuir,2000,16(6):2677-2688.
[7]Huang Y C,Fowkes F M,Lloyd T B,et al. Adsorption of calcium ions from calcium chloride solutions onto calcium carbonate particles[J]. Langmuir,1991,7(8):1742-1748.
[8]朱江. 羟基磷灰石与磷酸钙材料的制备及对α-磷酸三钙生物学效应的研究[D].长春:吉林大学,2014:5-12.
[9]Luo Q,Andrade J D. Cooperative Adsorption of Proteins onto Hydroxyapatite[J]. Journal of Colloid and Interface Science,1998,200(1):104-113.
[10]Kandori K,Kuroda T,Togashi S,et al. Preparation of calcium hydroxyapatite nanoparticles using microreactor and their characteristics of protein adsorption[J]. 2011,115:653-659.
[11]Tercinier L,Ye A,Anema S,et al. Adsorption of milk proteins on to calcium phosphate particles[J]. Journal of Colloid and Interface Science,2013,394:458-466.
[12]Yin G,Liu Z,Zhan J,Ding F X,et al. Impacts of the surface charge property on protein adsorption on hydroxyapatite[J]. Chemical Engineering Journal,2002,87:181-186.
[13]Wassell D T H,Hall R C,Embery G. Adsorption of bovine serum albumin onto hydroxyapatite[J]. Biomaterials,1995,16:697-702.
[14]Lowry O H,Rosenbrough N J,Farr A L,et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry,1951,193:265-275.
[15]Gornall A G,Bardawill C J,David M M. Determination of serum proteins by means of the Biuret reaction[J]. Journal of Biological Chemistry,1949,177:751-766.
[16]Thompson D W,Pownall P G. Surface Electrical Properties of Calcite[J].Journal of Colloid and Interface Science,1989,131:74-82.
[17]Wernett P C,Sanders N D,Bashey A R,et al. Tappi proceedings-coating conference. 1995:407-418.
[18]Kawasaki T,Niikura M,Kobayashi Y. Fundamental study of hydroxyapatite high-performance liquid chromatography:III. Direct experimental confirmation of the existence of two types of adsorbing surface on the hydroxyapatite crystal[J]. Journal of Chromatography A,1990,515:125-148.
[19]Ohta K,Monma H,Takahashi S. Adsorption characteristics of proteins on calcium phosphates using liquid chromatography[J]. Journal of Biomedical Materials Research,2001,55:409-414.
[20]Giles C H,Smith D,Huitson A. A general treatment and classification of the solute adsorption isotherm. I. Theoretical[J]. Journal of Colloid and Interface Science,1974,47:755-765.
[21]郭灵虹. 体内及体外磷酸钙与蛋白质生物材料相互作用[D].成都:四川大学,2001:45-50.
[22]Vries R D. Monte Carlo simulations of flexible polyanions complexing with whey proteins at their isoelectric point[J]. Journal of Chemical Physics,2004,120:3475-3481.
[23]Casal E,Montilla A,Moreno F J,et al. Use of chitosan for selective removal of beta-lactoglobulin from whey[J]. Journal of dairy science,2006,89:1384-1393.
[24]孙炜炜. 乳清分离蛋白-葡聚糖接枝改性及功能性质研究[D].广州:华南理工大学,2012:12-13.
[25]Dickinson E. Double Emulsions Stabilized by Food Biopolymers[J]. Food Biophysics,2011,6:1-11.
Study on the adsorption of whey protein isolate on the insoluble calcium particles
WEN Li-jie1,LIU Ying-di1,LIU Xiao-ming2,HU Jin-hua1,*,ZHOU Peng1,2,3,*
(1.State Key Laboratory of Food Science & Technology,Jiangnan University,Wuxi 214122,China;2.School of Food Science & Technology,Jiangnan University,Wuxi 214122,China;3.Synergetic Innovation Center of Food Safety and Nutrition,Wuxi 214122,China)
The investigation on the adsorption of whey protein isolate(WPI)onto different calcium particles,including calcium carbonate,hydroxyapatite and tricalcium phosphate,were carried out via different characterizations including ζ-potential,confocal laser scanning microscope,adsorption isotherms,preference adsorption and suspension stability. The surface charge of calcium particles were increased after WPI was adsorbed. Different adsorption behaviors were concluded for different calcium particles according to the calculated adsorption isotherms. β-Lactoglobulin was observed to be preferentially adsorbed on to the particle surface compared with α-lactalbumin. The stability of the insoluble calcium salt suspension were improved with WPI adsorbed,which was a great significance for the improvement of calcium fortified milk or beverage.
whey protein isolate;calcium carbonate;calcium phosphate;adsorption;suspension stability
2015-01-13
文丽杰(1990-),女,硕士研究生,研究方向:食品科学,E-mail:wenlijie@163.com。
*通讯作者:胡锦华(1982-),女,博士,副教授,研究方向:食品科学,E-mail:hujinhua@jiangnan.edu.cn。 周鹏(1975-),男,博士,教授,研究方向:食品科学,E-mail:zhoupeng@fingnan.edu.cn。
国家自然科学基金(31471697);复旦大学聚合物分子工程国家重点实验室开放课题(K2015-20);食品科学与技术国家重点实验室开发课题(SKLF-ZZB--01401);教育部科学技术研究项目(113032A);教育部新世纪优秀人才支持计划(NCET-11-0666);江南大学自主科研计划(JUSRP11440)。
TS201.1
A
1002-0306(2015)19-0062-06
10.13386/j.issn1002-0306.2015.19.004

