两种乳中脂肪球粒径、脂肪酶活性以及游离脂肪酸的比较分析
王风梅,梁 琪*,文鹏程,张 炎,黄绍海
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.甘肃省功能性乳品实验室,甘肃兰州 730070;3. 兰州雪顿生物乳业有限公司,甘肃兰州 730050)
两种乳中脂肪球粒径、脂肪酶活性以及游离脂肪酸的比较分析
王风梅1,2,,梁 琪1,2,*,文鹏程1,2,,张 炎1,2,,黄绍海1,3
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.甘肃省功能性乳品实验室,甘肃兰州 730070;3. 兰州雪顿生物乳业有限公司,甘肃兰州 730050)
以萨能奶山羊乳和荷斯坦牛乳为研究对象,用罗兹哥特法和激光动态散射仪分别测定了两种乳的脂肪含量、脂肪球粒径大小以及分布;用脂肪酶活性的临床分析方法测定了脂蛋白脂肪酶在乳脂肪和脱脂乳中的分布;采用硅胶-氧化铝柱层析分离脂肪酸,用气相色谱质谱测定了两种乳中游离脂肪酸的种类及含量。结果表明:萨能奶山羊乳和荷斯坦牛乳中的脂肪含量分别为4.04、3.55 g/100 mL;平均脂肪粒径为3.46、3.16 μm;脂肪球粒径与脂肪含量之间存在线性正相关关系。萨能奶山羊乳和荷斯坦牛乳脂蛋白脂肪酶的活性分别为229.62±9.31、(366.81±24.33)U/L,其中乳脂肪中脂蛋白脂肪酶的含量分别为51.35%、27.09%,脱脂乳中含量分别为48.65%、72.91%;萨能奶山羊乳和荷斯坦牛乳中总的游离脂肪酸分别为211.38、717.02 mg/kg;短链游离脂肪酸含量分别为205.51、20.05 mg/kg;其中辛酸和癸酸是影响萨能奶山羊乳风味的主效成分。
乳,脂肪球粒径,游离脂肪酸,气相色谱-质谱法(GC-MS)
羊乳营养丰富,具有独特的保健功效,营养学家称其为“最接近母乳的食品”[1]。关于山羊乳的膻味研究很多,报道结果并不一致。山羊奶中短中链的游离脂肪酸(C4~C10)和一些支链脂肪酸含量较高是造成羊奶和羊奶制品膻味的主要原因[2-3]。乳中的游离脂肪酸(Free fatty Acid,FFA)是乳中脂蛋白脂肪酶(Lipoprotein Lipase,LPL)脂解甘油三酯释放出来的产物[4-5]。LPL是一种糖蛋白,在牛奶中大部分与酪蛋白结合形成酪蛋白胶束。LPL对脂肪酸具有位置特异性,LPL主要水解脂肪sn-1和sn-3位置的脂肪酸[6-7]。然而,乳中的短链脂肪酸主要集中在sn-1和sn-3位置上。乳中脂肪含量越高,脂解反应的底物越充足,反应产生的游离脂肪酸越多。乳脂肪球膜(Milk Fat Globule Membrane,MFGM)具有阻止LPL与乳脂肪中甘油三酯的作用,但是随着脂肪球粒径的增大脂肪球表面张力变大,MFGM阻止乳脂肪球(Milk Fat Globule,MFG)破坏和聚合的能力越小,MFG越不稳定,更易于被乳本身的脂肪酶脂解产生FFA,这是影响游离脂肪酸生成的一个原因[8]。
目前,对于脂肪球粒径测定及相关的研究在国外已经有报道,但是国内相关的报道还很少;另外,Wiking对乳中LPL对脂肪酸价的影响进行了研究[9],但是国内还鲜为报道;李林强报道了萨能奶山羊乳与荷斯坦牛乳游离脂肪酸的比较,并从基因方面调控了短链游离脂肪酸的形成[10],但是没有关于萨能奶山羊乳与荷斯坦牛乳中脂肪球粒径的大小以及脂蛋白脂肪酶活对游离脂肪酸的影响进行研究。
本文以萨能奶山羊和荷斯坦牛乳为研究对象,通过对乳中脂肪含量、MFG粒径、LPL在乳中的含量以及乳中FFA的测定,分析比较萨能奶山羊乳和荷斯坦牛乳的脂肪含量、MFG粒径、LPL的分布、FFA的种类及含量以及游离脂肪酸对萨能奶山羊乳以及荷斯坦牛乳风味品质的影响,为乳制品的发展提供理论依据。
1 材料与方法
1.1 材料与仪器
萨能奶山羊乳 甘肃兰州,荷斯坦牛乳采自甘肃农业大学奶牛场,供试牛羊体健康、生长发育正常。乳样采集后迅速冷却冷冻;带回实验室对部分指标进行测定。剩余乳样一部分直接在-80 ℃超低温冰箱保存备用;另一部分采用4500 r/min离心10 min后将脂肪和脱脂乳分别在-80 ℃超低温冰箱保存备用。
正己烷、甲醇、甲酸、三氟化硼乙醚溶液(色谱纯) 烟台市双双化工有限公司;重蒸乙醚(将无水乙醚在旋转蒸发仪中蒸馏,去掉馏头和馏尾部分,将中间馏分备用)、EDTA、氯化钠、浓硫酸、无水硫酸钠(分析纯) 国药集团化学试剂有限公司,200~300目的中性氧化铝、100~200目的硅胶(分析纯) 天津市凯信化学工业有限公司。
1.2 实验方法
1.2.1 脂肪含量的测定 乳中脂肪含量采用罗兹哥特法测定[11]。试样10 mL,加入抽脂瓶中,加2 mL氨水,充分混匀,置于60 ℃水浴中加热5 min,再振摇2 min,加入10 mL乙醇,充分摇匀,于冷水中冷却,加入25 mL乙醚,振摇5 min,加入25 mL石油醚,再振摇5 min,静置30 min,待上层液澄清时,读取醚层体积。放出一定体积醚层于已经恒重的烧瓶中,蒸馏回收乙醚和石油醚,挥发残余醚后,放入100~105 ℃烘箱中干燥1.5 h,取出放入干燥器中冷却至室温后称重,重复操作至恒重,计算结果。
1.2.2 显微结构分析 显微结构的分析参照Olivia Ménard的方法[12]。在室温条件下用倒置显微镜对萨能奶山羊和荷斯坦牛乳进行微观结构的分析。
1.2.3 脂肪球粒径的分析 脂肪粒径的分析参照He S的方法[13]。新鲜萨能奶山羊乳和荷斯坦牛乳经纱布过滤后,用35 mmol/L的EDTA/NaOH pH7缓冲溶液按1∶50稀释以破坏酪蛋白胶束。在室温的条件下,取处理好的样品用激光动态散射仪进行脂肪球粒径分析。脂肪和水的折射率为1.45和1.33。
1.2.4 LPL的测定 脂蛋白脂肪酶的测定采用Olivecrona报道的临床脂酶活性分析的方法[14-15]。实验优化了牛奶的浓度和保温时间。1 μL的牛奶或者10 mg的乳脂肪用5 mmol/L脱盐胆酸钠,0.1 mmol/L SDS,20 mmol/L Tris(pH8.5)1∶1稀释(vol/vol或者wt/vol),保温20 min被发现是最好的。
1.2.5 游离脂肪酸的测定 游离脂肪酸的测定参照Zehra Güler等人的方法[16-19]。
最高车速(km/h) ..................................................312
1.2.5.1 游离脂肪酸的提取 取5 g牛奶置于离心管中,加1 mL 0.5 mol/L的硫酸溶液和5 mL的乙醇溶液摇匀,加10 mL含有正庚酸标准品的乙醚溶液,10 mL正己烷;涡旋震荡1 min,4500 r/min 0 ℃离心10 min,静止30 min,取上清液于具塞试管。重复以上步骤提取一次;再用5 mL乙醚和正己烷再提取一次;加3 g无水硫酸钠静置过夜。
1.2.5.2 游离脂肪酸的分离 用正己烷湿润柱硅胶氧化铝层析柱(400 mm×16 mm),硅胶和氧化铝的比值为1∶4。将上清液过层析柱,用10 mL正己烷∶乙醚为1∶1的溶液洗去其他可溶性脂类,再用15 mL 6%的甲酸乙醚溶液洗脱层析柱,收集洗脱液于三角瓶中并用氮气浓缩。
1.2.5.3 脂肪酸的甲酯化 浓缩液与20 mL的14%的三氟化硼甲醇溶液于80 ℃水浴15~30 min,冷却至室温,将溶液转移至离心管,并用饱和食盐水溶洗容器三次,合并饱和食盐水。加5 mL的乙醚震荡,以5000 r/min离心5 min,取上清液。再用5 mL乙醚重复提取一次,合并提取液。将提取液用氮气浓缩至1 mL,供气相色谱仪测定。
1.2.5.4 GC-MS条件 色谱条件:色谱柱SE-54弹性毛细管柱(30 m×250 μm×0.25 μm);升温程序:50 ℃保持4 min,以10 ℃/min升至150 ℃,保持3 min,以10 ℃/min升到230 ℃,保持30 min;载气(He)流速为1.2 mL/min;进样量为1 μL;不分流进样。
质谱条件:电子轰击(EI)离子源;电子能量70 eV;质谱为5973 N四极杆质谱仪;离子源温度:230 ℃;四极杆温度:150 ℃;质量扫描范围m/z:33~660。
1.3 数据处理与统计
各组数据均为3次实验的平均值,以平均值±标准差表示;数据采用SPSS19.0进行统计分析;采用Origin7.0作图。
2 结果与分析
2.1 萨能奶山羊乳与荷斯坦牛乳脂肪含量分析
由表1可知萨能奶山羊乳和荷斯坦牛乳脂肪含量呈极显著差异(p<0.01)。杨琴报道萨能奶山羊乳脂肪含量为4.00%;Abdullahi报道中国荷斯坦牛乳脂肪的含量为3.85 g/100 g[20-21]。这两个结果与本文报道的结果相接近。
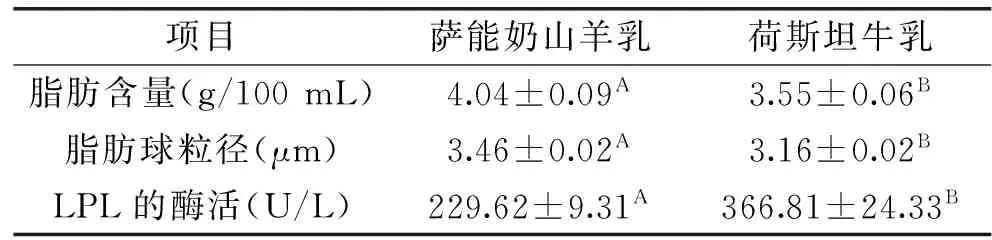
表1 萨能奶山羊乳和荷斯坦牛乳脂肪含量、脂肪平均粒径以及脂蛋白脂肪酶的活性Table 1 Fat content,mean diameter of fat globules size and LPL activity of Saanen Goats milk and Holstein milks
注:A、B表示同一行中不同的上标字母为差异极显著(p<0.01)。
2.2 萨能奶山羊乳与荷斯坦牛乳脂肪的微观结构
通过光学显微镜图片可以看出(图1)。乳中脂肪球以椭圆形球体存在于乳浆中。这与山羊乳、水牛乳微观结构相一致[8,12]。由图1中A、B萨能奶山羊乳脂肪球的大小和密集程度均高于荷斯坦牛乳中脂肪球粒径。

图1 萨能奶山羊乳(A)和荷斯坦牛乳(B)光学显微镜图片 Fig.1 Micrographs of Saanen goats(A)and Holstein milks(B)taken by optical microscopy and showing the differences in fat content and fat globule size distribution注:基准尺=50μm。
2.3 萨能奶山羊乳与荷斯坦牛乳脂肪脂肪球粒径的分布
由表1可知萨能奶山羊乳脂肪球平均粒径3.46 μm极显著的高于荷斯坦牛乳中脂肪球平均粒径3.16 μm(p<0.01)。由图2A中可以看出萨能奶山羊乳与荷斯坦牛乳的脂肪球的范围都为0.5~10 μm。这个范围较Pisanu S测得的萨能奶山羊乳脂肪球粒径分布范围1~20 μm[22]。由图2B图可以看出,萨能奶山羊乳与荷斯坦牛乳中脂肪球粒径主要分布范围为在3~5 μm和2~5 μm;其中萨能奶山羊乳脂肪球分布集中在3.5 μm处;荷斯坦牛乳脂肪球粒径分布集中在3 μm处,这与两种乳脂肪球平均粒径相一致。不同乳中脂肪球粒径受乳产量、脂肪含量、基因等因素的影响存在显著的差异[8,23]。

图2 萨能奶山羊乳与荷斯坦牛乳脂肪球粒径分布 Fig.2 Fat globule size distribution in the milks obtained from Saanen goats and Holstein milk 注:A图中的x轴数值为对数形式,B图中的x轴数值为线性形式。
萨能奶山羊乳脂肪球粒径相比荷斯坦牛乳脂肪球粒径大,这与萨能奶山羊较高的脂肪含量有关。由表1萨能奶山羊乳与荷斯坦牛乳脂肪球粒径与脂肪含量,通过用SPSS19.0软件对其进行相关性分析,得出的线性正相关关系如下:
粒径(μm)=0.557×脂肪含量(g/100 mL)+1.195(R2=0.881)
这个结果与El-Zeini报道的脂肪含量越高的乳,其脂肪球粒径越大的结果相一致[8,12]。从物理的角度看,由于较大的脂肪球表面张力越大,因此在挤奶、运输和加工的过程中脂肪球越更容易破裂;另外,较大的脂肪球更容易聚集和从乳中分离出脂肪[12]。
2.4 萨能奶山羊乳与荷斯坦牛乳脂肪LPL酶在乳脂肪与脱脂乳中的分布
萨能奶山羊乳LPL的活性229.62 U/L极显著的低于荷斯坦牛LPL的活性366.81 U/L(p<0.01)如表1所示。荷斯坦牛乳中LPL的酶活是萨能奶山羊酶活的1.5倍左右。LPL的酶活受物种、哺乳阶段以及饲养等因素的影响。有研究报道荷斯坦牛乳和羊乳常中LPL的活性都小于200 U/L,但是荷斯坦牛乳中LPL的活性是羊乳常乳的1.58倍左右与本文测定结果相一致[24]。
两种乳中LPL在脂肪相和脱脂乳中含量见图3。萨能奶山羊乳中LPL在乳脂肪和脱脂乳中的含量分别为51.35%和48.65%这与DeFeo报道的羊乳中LPL在乳脂肪和脱脂乳中的含量为46%和54%接近;荷斯坦牛中LPL在脱脂乳中的含量为72.91%与普通牛乳LPL在酪蛋白中的含量占78%相接近[25]。萨能奶山羊乳脂肪相中LPL所占百分数较高可能是与萨能奶山羊乳中脂肪含量较高有关[23]。虽然萨能奶山羊乳中LPL的活性较低,但是与脂肪接触的LPL的百分比较高。LPL与脂肪接触会发生水解反应产生游离脂肪酸。

表2 萨能奶山羊乳与荷斯坦牛乳中游离脂肪酸的含量Table 2 Free fatty acids prepared from fresh milk of Saanen Goat and Holstein

图3 萨能奶山羊乳与荷斯坦牛乳LPL在脂肪相与脱脂乳中的分布Fig.3 The distribution of LPL activity in Cream phrase and Skim milk from Saanen Goat and Holstein milk注:a、b表示不同的字母为差异显著p<0.05。
2.5 萨能奶山羊乳与荷斯坦牛乳脂肪FFA的分析
萨能奶山羊乳和荷斯坦牛乳FFA种类及含量如表2和图4所示,萨能奶山羊乳中总游离脂肪酸(TFFA)的含量为717.02 mg/kg,大约是荷斯坦牛乳中TFFA 211.38 mg/kg的3.5倍。Catrienus测得的普通牛乳中TFFA为119.17 mg/kg[26]。
短链的游离脂肪酸(Short Chain Free Fatty Acid,SCFFA),荷斯坦牛乳包含四种SCFFA,而萨能奶山羊乳中只包含了三种SCFFA。两种乳中含量最高的SCFFA是癸酸,然后依次是辛酸、己酸和丁酸,这个趋势与两种乳中结合的短链脂肪酸的趋势是一致的。对于中链(Medium Chain Free Fatty Acid,MCFFA)和长链的游离脂肪酸(Long Chain Free Fatty Acid,LCFFA)含量较高的是肉豆蔻酸、棕榈酸、硬脂酸和油酸;这些脂肪酸中含量最高的是棕榈酸,然后依次是油酸、肉豆蔻酸、硬脂酸。
由于SCFFA风味阈值较低,虽然SCFFA在乳中含量较低,但是对乳的风味具有重要的影响。荷斯坦牛乳中SCFFA有丁酸、己酸、辛酸、癸酸;且这几种脂肪酸的含量分别为2.81±0.43、4.35±0.10、4.78±0.77、(9.50±2.24)mg/kg;然而丁酸、己酸、辛酸、癸酸风味阈值分别为24.64、14.16、7.20、7.68 mg/kg[27],只有癸酸的含量略高于其风味阈值。萨能奶山羊乳中己酸的含量与荷斯坦牛乳接近,但是萨能奶山羊乳中辛酸、癸酸的含量为43.38、133.98 mg/kg,含量远高于其风味阈值,同时分别是荷斯坦牛乳辛酸、癸酸的10倍和14倍。对于MCFFA和LCFFA肉豆蔻酸、棕榈酸、油酸和硬脂酸虽然具有较高的含量,但是它们的风味阈值也较高;例如C14∶0的FFA的风味阈值为100 mg/kg[28]。因此MCFFA和LCFFA不是影响风味的主要游离脂肪酸。从测试结果得出辛酸和癸酸是影响萨能奶山羊乳风味的主效成分。
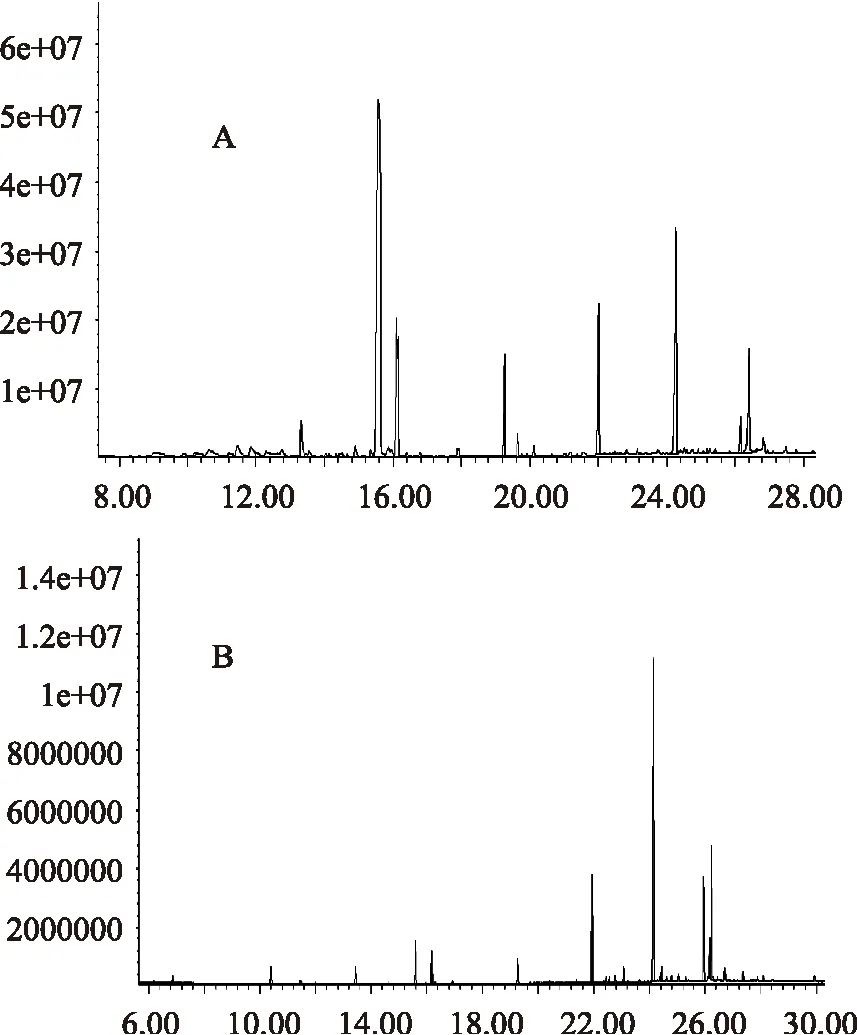
图4 萨能奶山羊乳(A)与荷斯坦牛乳(B)中游离脂肪酸总离子图Fig.4 The ion chromatogram of free fatty acids prepared from Saanen goats milk(A)and Holstein milk(B)
Alonso L等用气质联用技术鉴定了羊乳中的30余种支链脂肪酸,并指出该脂肪酸和4-甲基辛酸是引起乳制品羊膻味和羊羔味的重要物质[29]。羊乳中SCFA的含量大约高出牛乳中含量的1倍,其中癸酸和辛酸含量比牛乳高出3~5倍。这几种脂肪酸本身并没有膻味,在乳中它们之间(尤其C6和C8之间)存在着相互作用,在一定条件下,结合成一种较稳定的络合物,或者以相互结合的形式(通过氢键)存在时才能发出典型的山羊乳膻味[30]。因此,山羊乳的中短链脂肪酸组成是引起羊乳膻味的直接原因。本文没有检测到当支链的脂肪酸,但是检测到C6~C10偶数链的脂肪酸,而萨能奶山羊中C6的脂肪酸的含量小于荷斯坦牛乳中的含量。所以认为辛酸和癸酸是影响萨能奶山羊乳风味的主效成分。
由于FFA是乳LPL脂解甘油三酯释放出来的产物,而脂肪含量、脂肪球粒径、LPL等都是影响FFA形成的原因,本文通过对脂肪含量、脂肪球粒径、LPL活性的测定解释了萨能奶山羊乳中较高含量的FFA可能是由于萨能奶山羊乳相对于荷斯坦牛乳较大的脂肪球粒径使得脂肪球较容易破裂,从而使脱脂乳中游离的LPL与脂肪接触,增加了LPL与脂肪接触的含量,脂解产生较多的FFA。虽然该乳中LPL的含量较荷斯坦牛乳中低,但是萨能奶山羊乳脂肪相中较高LPL所占的百分比较高,同时该乳较高的脂肪含量也为LPL提供了较为充足的水解底物,从而使萨能奶山羊乳水解产生较多的FFA。另外LPL具有位置特异性,主要水解sn-1和sn-3位置的脂肪酸,而乳脂肪中sn-1和sn-3主要是SCFFA。
3 结论
萨能奶山羊乳与荷斯坦牛乳脂肪含量为4.04、3.55 g/100 mL;平均脂肪球粒径分别为3.46、3.16 μm,脂肪球粒径分别集中分布在3~5、2~5 μm处;脂肪球粒径与脂肪含量存在线性正相关关系:粒径(μm)=0.557×脂肪含量(g/100 mL)+1.195(R2=0.881)。萨能奶山羊乳与荷斯坦牛乳LPL的活性分别为229.62±9.31、(366.81±24.33)U/L;在脂肪相中百分比分别为51.35%、27.09%,在脱脂乳中的百分比分别为48.65%、72.91%。萨能奶山羊与荷斯坦牛乳游离脂肪酸总量为717.02、211.38 mg/kg;其中短链游离脂肪酸含量为205.51、22.05 mg/kg。辛酸和癸酸是影响萨能奶山羊乳风味的主效成分。
[1]李龙柱,张富新,葛萍,等.巴氏杀菌对原料羊乳卫生质量的影响[J].食品工业科技,2014,35(1):223-226.
[2]Attaie R,Richter R L. Formation of volatile free fatty acids during ripening of cheddar r-like hard goat cheese[J].Journal of Dairy Science,1996,79(5):717-724.
[3]Chilliard Y,Ferlay A,Rouel J,et al. Effect of feeding treatments and lactation stage on composition and organoleptic quality of goat milk Domiati cheese[J]. Small Ruminant Research,2004,52(1-2):109-116.
[4]Collins Y,McSweeney P L H,Wilkinson M G. Lipolysis and free fatty acid catabolism in cheese:a review of the current knowledge[J].International Dairy Journal,2003(13):841-866.
[5]Kim Ha J,Lindsay R C. Release of volatile branched-chain and other fatty acids from ruminant milk fats by various lipases[J]. Journal of Dairy Science,1993,76(3):677-690.
[6]Ouattara G C,Jeon I J,Hart-Thakur R A,et al. Fatty acids released from milk fat by lipoprotein lipase and lipolytic psychrotrophs[J]. Journal of Food Science,2004,69(8):C659-C664.
[7]Deeth H C. Lipoprotein lipase and lipolysis in milk[J]. International Dairy Journal,2006,16(6):555-562.
[8]El-Zeini HM.Microstructure,rheological and geometrical properties of fat globules of milk from different animal species[J].Polish Journal of Food and Nutrition Sciences,2006,(15):147-154.
[9]Wiking L,Dickow J A. Effect of homogenization temperature and pressure on lipoprotein lipase activity and free fatty acids accumulation in milk[J]. Food and Nutrition Sciences,2013,4:101-108.
[10]李林强,昝林森. 西农萨能奶山羊乳和荷斯坦牛乳挥发性游离脂肪酸组成比较及分子机理分析[J]. 食品与生物技术学报,2011,30(6):822-826.
[11 AOAC W H. Official methods of analysis of the Association of Official Analytical Chemists[J]. Association of Official Analytical Chemists,Arlington,VA,USA,1990.
[12]Ménard O,Ahmad S,Rousseau F,et al. Buffalo vs. cow milk fat globules:Size distribution,zeta-potential,compositions in total fatty acids and in polar lipids from the milk fat globule membrane[J]. Food Chemistry,2010,120(2):544-551.
[13]He S,Ma Y,Wang J,et al. Characterization of fat globules and milk fat globule membrane proteins in milk of different yak breeds[J]. Dairy Science & Technology,2010,90(5):601-609.
[14]Olivecrona T,Olivecrona G. Determination and clinical significance of lipoprotein lipase and hepatic lipase[J]. Handbook of lipoprotein testing,2000,2:479-497.
[15]Dickow J A,Larsen L B,Hammershøj M,et al. Cooling causes changes in the distribution of lipoprotein lipase and milk fat globule membrane proteins between the skim milk and cream phase[J]. Journal of Dairy Science,2011,94(2):646-656.
[16]Kim Ha J,Lindsay R C. Method for the quantitative analysis of volatile free and total branched-chain fatty acids in cheese and milk fat[J]. Journal of Dairy Science,1990,73(8):1988-1999.
[17]Güler Z,Gürsoy-BalcA C. Evaluation of volatile compounds and free fatty acids in set types yogurts made of ewes’,goats’ milk and their mixture using two different commercial starter cultures during refrigerated storage[J]. Food Chemistry,2011,127(3):1065-1071.
[18]Güler Z,Keskin M,Masatçl.Effects of breed and lactation period on some characteristics and free fatty acid composition of raw milk from Damascus goat and German Fawn x Hair goat B1crossbreeds[J]. Turkish Journal Veterinary & Animal Science,2007,31(5):347-354.
[19]Ha JK,Lindsay RC.Volatile Branched-chain Fatty Acids and Phenolic Compounds in Aged Italian Cheese Flavors[J]. Journal of Food Science 1991,56(5):1241-1248-74.
[20]Abdullahi A Y,Yang J B. Assessment of Potential Milk Production of Chinese Hesitan[J]. Journal of Animal and Veterinary Advances,2012,11(2):165-170.
[21]杨琴,蔡雷江,孙宗奇,等.萨能奶山羊乳的营养特性及酸羊奶产品开发[J].贵州农业科学,2009,37(1):116-119.
[22]Pisanu S,Marogna G,Pagnozzi D,et al. Characterization of size and composition of milk fat globules from Sarda and Saanen dairy goats[J]. Small Ruminant Research,2013,109(2):141-151.
[23]Wiking L,Stagsted J,Bjorck L.Milk fat globule size is affected by fat production in dairy cows[J]. International Dairy Journal,2004,14:909-913.
[24]薛海晓,芦晶,张书文,等.生鲜羊乳脂肪酶活力研究[J].中国食品学报,2014,14(12):12-17.
[25]DeFeo A A,Dimick P S,Kilara A. Purification and partial characterization of caprine milk lipoprotein lipase[J]. Journal of Dairy Science,1982,65(12):2308-2316.
[26]Chilliard Y,Selselet-Attou G,Bas P,et al. Characteristics of lipolytic system in goat milk[J]. Journal of Dairy Science,1984,67(10):2216-2223.
[27]De Jong C,Badings H T. Determination of free fatty acids in milk and cheese procedures for extraction,clean up,and capillary gas chromatographic analysis[J]. Journal of High Resolution Chromatography,1990,13(2):94-98.
[28]Rychlik M,Bosset J O. Flavour and off-flavour compounds of Swiss Gruyere cheese. Identification of key odorants by quantitative instrumental and sensory studies[J]. International Dairy Journal,2001,11(11):903-910.
[29]Alonso L,Fontecha J,Lozada L,et al. Fatty acid composition of caprine milk:major,branchedchain and trans fatty acids. Dairy Science,1999,82:878-884.
[30]冯芝,罗永康.山羊乳脱膳技术的研究[J].中国乳业,2008(5):48-49.
Comparison of milk fat globule,Lipoprotein Lipase activity and free fatty acids from two breeds milk
WANG Feng-mei1,2,,LIANG Qi1,2,*,WEN Peng-cheng1,2,,ZHANG Yan1,2,,HUANG shao-hai1,3
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.Functional Dairy Product Engineering Laboratory of Gansu,Lanzhou 730070,China;3.Xuedun Biological Dairy Limited Company of Lanzhou,Lanzhou 730050,China)
The milk of Saanen Goat and Holstein Cattle were used as the material to investigate the fat content and fat globule size by Rose Gottileb method and laser light scattering respectively. The Lipoprotein lipase activity and the free fatty acids which were separated from the milk fat were researched using the chromatographic column containing alumina and silica gel as measured by lipase activity analysis in clinica and the gas chromatograph mass spectrometer respectively. The results showed that the fat content of Saanen Goat milk and Holstein milk were 4.04,3.55 g/100 mL respectively,the mean fat globule size were 3.46,3.16 μm respectively,the linear and positive relationship was found in the milks between fat globule size and fat content. The Lipoprotein Lipase activity in Saanen milk and Holstein milk were 229.62±9.31,(366.81±24.33)U/L,the distribution of Lipoprotein Lipase of Saanen milk and Holstein milk in the cream phase was 51.35% and 27.09%,in skim milk were 48.65% and 72.91%. The total free fat acids from Saanen Goat and Holstein Cattle were 211.38 and 717.02 mg/kg,the short chain free fat acids were 22.05 and 205.51 mg/kg. The caproic acids and caprylic acid were the main effect flavour components in Saanen goat milk.
milk;fat globule size;free fatty acids;gas chromatograph mass spectrometer
2014-12-30
王风梅(1989-),女,硕士研究生,研究方向:乳品科学与技术,E-mail:Wangfengmei1989@126.com。
*通讯作者:梁琪(1969-),女,博士,教授,研究方向:乳品科学与技术、食品科学、食品品质,E-mail:liangqi@gsau.edu.cn。
国家国际科技合作专项项目(211DFA32550);兰州市研政产合作项目(2012-2-87);国家青年基金项目(31301457)。
TS251.1
A
1002-0306(2015)19-0095-06
10.13386/j.issn1002-0306.2015.19.011

