茶多酚的抗菌特性研究进展
杨海伦,刘小香,*,朱军莉,励建荣
(1.浙江医学高等专科学校基础医学部,浙江杭州 310053;2.浙江工商大学食品与生物工程学院,浙江省食品安全重点实验室,浙江杭州 310035;3.渤海大学,辽宁省食品安全重点实验室,辽宁锦州 121031)
茶多酚的抗菌特性研究进展
杨海伦1,刘小香1,*,朱军莉2,励建荣3
(1.浙江医学高等专科学校基础医学部,浙江杭州 310053;2.浙江工商大学食品与生物工程学院,浙江省食品安全重点实验室,浙江杭州 310035;3.渤海大学,辽宁省食品安全重点实验室,辽宁锦州 121031)
茶多酚(Tea Polyphenols,TP)是从茶叶中提取出来的纯天然物质,具有广谱的抗菌活性,为目前广泛应用的天然食品保鲜剂之一。随着人们对食品安全的重视,茶多酚由于具备更高的安全性而被人们认可和接受。本文根据国内外对茶多酚抗菌特性的研究现状,对茶多酚的化学成分、抗菌活性、细菌毒素灭活作用以及抗菌机理等方面作了系统介绍,旨在为茶多酚在食品与医药领域得到更为合理与广泛的应用提供一定的理论参考。
茶多酚,天然食品保鲜剂,抗菌特性,抗菌机理,研究进展
近年来,食品安全问题日渐成为人们关注的焦点,传统的食品保鲜剂已不能满足人们对食品安全的需求。因此,直接来源于生物体自身组成成分或其代谢产物的天然保鲜剂愈益被消费者所接受。这些天然保鲜剂,不仅具有良好的抗菌作用,而且对人体的安全性高,有些还具备保健功效。目前所使用的天然植物保鲜剂中,茶多酚(Tea Polyphenols,TP)是研究最多的一种。1995年7月,在第十一届全国添加剂标准化技术委员会上,茶多酚被正式列为食品添加剂,并作为“九五”重点科技攻关项目而使其在食品领域的研究应用备受关注。由于茶多酚具有良好的抗菌活性和抗氧化作用[1],还有抗肿瘤和抗辐射等保健功效[2-3],其已成为目前广泛应用的天然食品保鲜剂。此外,茶多酚在医药上也具有广泛的应用前景,并有望作为新型的抗菌剂应用于治疗多种细菌、某些真菌与病毒引起的感染[4-5]。
茶多酚的抗菌活性早在100年前就被证实[6],国内外的研究者也长期致力于茶多酚抗菌特性的研究工作。目前,国内对茶多酚抗菌特性的研究仅局限于茶多酚抑菌种类、抑菌效果与影响因素等方面,国外的研究则相对更加广泛深入。本文主要从茶多酚的化学组成、抗菌活性、细菌毒素灭活作用以及抗菌机理等方面对茶多酚的抗菌特性进行概述,以期为其在食品与医药领域得到合理有效的应用提供一定的理论参考。
1 化学组成
根据制备工艺的不同,茶叶可分为绿茶(未发酵茶)、乌龙茶(半发酵茶)和红茶(发酵茶)。中国和日本等亚洲国家茶叶消费以绿茶为主,因此国内一般认为茶多酚即绿茶多酚,是从绿茶中分离提纯出来的多酚类化合物。按照化学结构,茶多酚可分为四类,即黄烷醇类(儿茶素)、花色苷类、黄酮醇类和酚酸类。在这四类物质中,儿茶素含量最高,通常占茶叶干重的30%~40%,是茶多酚的主要功能活性物质。儿茶素类化合物主要有4种,包括表没食子儿茶素没食子酸酯(EGCG,(-)-epigallocatechin gallate)、表没食子儿茶素(EGC,(-)-epigallocatechin)、表儿茶素没食子酸酯(ECG,(-)-epicatechin gallate)和表儿茶素(EC,(-)-epicatechin)。其中,EGCG是最主要的儿茶素物质(约占儿茶素的50%~80%),也是最重要的功能性物质[2]。虽然绿茶在国内的消费量较大,但在世界范围内,西方国家茶叶消费以红茶为主,占世界茶叶总消费量的78%。在红茶的加工过程中,约75%的儿茶素被氧化和聚合,产生红茶的代表性物质茶黄素,而乌龙茶则兼具一定量的儿茶素和茶黄素[2,5]。
2 茶多酚的抗菌活性
2.1 直接抗菌活性
茶多酚具有广谱性的抗菌效果,既可抑制G+菌,也可抑制G-菌。研究证明,茶多酚对蜡样芽孢杆菌(Bacilluscereus)、金黄色葡萄球菌(Staphylococcusaureus)、霍乱弧菌(Vibriocholerae)、弯曲杆菌(Campylobacterjejuni)、单增李斯特菌(Listeriamonocytogenes)、致病性大肠杆菌(EscherichiacoliO157∶H7)、沙门氏菌(Salmonella)、假单胞菌(Pseudomonasspp.)等一系列典型食品致病菌及腐败菌都有抑制作用[5,7-9]。不同的细菌对多酚的耐受力不同,取决于多酚类物质结构以及细菌种类。由于结构不同,茶多酚的4种主要儿茶素物质的抗菌活性也不尽相同,表现出的抗菌活性强弱顺序为EGCG>ECG>EGC>EC[10]。Friedman等[11]检测了7种儿茶素物质对蜡样芽胞杆菌的抑制作用,得出以下研究结果:没食子儿茶素没食子酸酯(GCG,(-)-gallocatechin-3-gallate),EGCG,儿茶素没食子酸酯(CG,(-)-catechin-3-gallate),ECG在纳摩尔水平即能表现出对蜡样芽孢杆菌的抗菌活性;一些儿茶素物质的抗菌活性比某些传统抗生素的活性更强,如四环素(etracycline)和万古霉素(ancomycin);缺失没食子酸支链的儿茶素物质不具有抗菌活性。茶多酚对不同细菌的抑制作用也有较大差别,一般情况下,茶多酚对G+菌的抑制作用比对G-菌的抑制作用强。Yoda等[12]通过比较葡萄球菌(S.aureus,S.epidermidis,S.hominis,S.haemolyticus)和G-杆菌(Escherichiacoli,Klebsiellapneumoniae,Salmonellatyphi,Proteusmirabilis,Pseudomonasaeruginosa,Serratiamarcescens)对EGCG的敏感性发现,EGCG对葡萄球菌的最低抑菌浓度(MICs,minimum inhibitory concentrations)为50~100 μg/mL,而对G-杆菌的最低抑菌浓度均不低于800 μg/mL。Araghizadeh等[13]对绿茶提取物抗菌活性的研究也发现茶多酚对G+菌的抑制作用明显高于对G-菌的抑制作用。
2.2 协同抗菌作用
茶多酚的抗菌作用也体现在能与多种已知的抗生素具有协同作用。如茶多酚和四环素对金黄色葡萄球菌及表皮葡萄球菌(Staphylococcusepidermidis)具有协同作用[14];茶多酚和青霉素共同使用对表皮葡萄球菌具有协同作用[15];对耐甲氧西林金黄色葡萄球菌(MRSA),茶多酚和多种抗生素共同使用都具有协同效应,包括青霉素,苯唑青霉素,氨苄青霉素与亚胺培南[5,16-17];对具不同程度耐药性的大肠杆菌,茶多酚和氯霉素,环丙沙星或者头孢噻肟共同作用均具有协同效应[18-20]。
2.3 食品体系抗菌活性
茶多酚作为天然的食品保鲜剂在食品中应用非常广泛,不少研究证明茶多酚能有效抑制食品中微生物的生长。Bari等[21]发现在熟的碎牛肉,鸡肉及猪肉的冷藏过程中,绿茶提取物能显著抑制荚膜梭状芽孢杆菌(Clostridiumperfringens)的孢子萌发及生长。茶多酚在水产品中贮藏过程中能有效降低微生物的污染。Fan等[22]用0.2%茶多酚浸泡银鲫90 min后冰上冷藏,能有效抑制腐败菌的生长,货架期可比未经茶多酚处理的对照延长7 d。另外,茶多酚能有效降低梅鱼鱼丸、石首鱼鱼片及黑鲷鱼冷藏过程中的微生物总数[9,23-24]。钟艳梅等[25]比较了茶多酚、山梨酸钾、苯甲酸钠对新鲜原果汁的保鲜效果,发现100 mg/kg的茶多酚与500 mg/kg的山梨酸钾防腐效果相当,对酵母菌、大肠杆菌和金黄色葡萄球菌均有明显抑制作用,能有效保持果汁原有风味并延长保鲜期7~10 d。但是,在某些情况下,食品中的一些成分可能会对茶多酚的抑菌作用产生影响。如在脑心浸出液肉汤培养基中,绿茶提取物对金黄色葡萄球菌和单增李斯特菌均有明显抑制作用,但是在碎牛肉中,绿茶提取物对这两种细菌的抑制作用却并不显著。该研究结果预示着多酚物质与蛋白质的结合可能抑制其与细菌的相互作用,但是这种现象还需进一步研究[26]。
3 茶多酚对细菌毒素的灭活作用
很多病原菌都能通过产生外毒素而诱发疾病。细菌外毒素通常以蛋白质形式存在,且这些蛋白毒素的三级结构对其毒性起决定作用。因此,破坏细菌毒素的三级结构可阻止其与宿主细胞膜受体的相互作用。近年来,越来越多的报道显示茶多酚对细菌毒素有很好的灭活作用。金黄色葡萄球菌的外毒素肠毒素B(SEB,Staphylococcal enterotoxin B)能引发急性肠胃炎。在小鼠腹膜腔内注射绿茶提取物或EGCG,能结合并抑制SEB。EGCG对SEB的抑制作用存在着剂量和时间的依赖性[27]。此外,茶叶提取物对肉毒杆菌的神经毒素、霍乱弧菌的霍乱毒素及大肠杆菌的Shiga毒素均具一定的灭活作用[28]。近年来,研究者对于变形链球菌的研究发现,茶多酚,特别是EGCG,对于变形链球菌(Streptococcusmutans)的毒力因子葡糖基转移酶具有明显的抑制作用,能起到良好的预防龋齿的作用[29]。
4 茶多酚的抗菌机理
目前,国内外对于茶多酚的抗菌机理还不十分明确,被认为是多种因素共同作用的结果。既然茶多酚已经作为天然的食品保鲜剂广泛应用于食品的加工及贮藏过程中,充分了解其抗菌机制是非常必要的。目前国内外对于茶多酚抗菌机理的研究主要集中在以下三个方面:
4.1 茶多酚破坏细胞膜的功能
相关研究表明,G+菌比G-菌对EGCG更为敏感的原因在于,EGCG对G+菌和G-菌细胞膜的结合能力不同[12]。EGCG对金黄色葡萄球菌的抑制作用可被纯化的肽聚糖阻断,但不能被脂多糖或右旋糖苷阻断。EGCG极易结合暴露在G+菌细胞表面的肽聚糖层,而G-菌的肽聚糖层外还有一层主要由脂多糖构成的外膜,阻止了EGCG与G-菌的肽聚糖层的结合,最终导致G+菌和G-菌对EGCG敏感性的差异。由此也可推断,EGCG与肽聚糖的结合最终可能引起细胞膜的损伤。除与细菌的肽聚糖结构相互作用,还有相当多的报道显示儿茶素物质可结合细胞膜的磷脂双分子层,从而导致细胞膜的破坏[30-31]。细菌细胞膜的破坏削弱了细菌与宿主细胞结合的能力[32],同时也抑制了细菌聚集结合形成生物膜,而生物膜的形成与细菌的致病性和耐受性密切相关[33-34]。另外,Shah等[35]对金黄色葡萄球菌的研究发现,细菌细胞膜的破坏还会抑制细菌毒素的释放,削弱细菌的毒力。Yi等[36-37]研究了茶多酚对铜绿假单胞菌(Pseudomonasaeruginosa)和粘质沙雷氏菌(Serratiamarcescens)的抑制作用,发现茶多酚可导致细菌细胞膜的通透性增加。另外,通过对细胞膜蛋白的双向电泳分析,发现经茶多酚处理过的细菌的膜蛋白成分发生了很大变化,推测这些膜蛋白变化可能导致细胞代谢紊乱。
4.2 茶多酚对细菌特定靶蛋白的抑制作用
传统的抗生素大多具备作用于细菌的靶蛋白,例如四环素类抗生素可结合核蛋白体的30S亚单位,从而阻止氨酰基-tRNA同核糖核蛋白体结合;利福霉素(rifamycin)可结合RNA聚合酶而抑制细菌的RNA转录起始。因此,人们也研究了茶多酚对一些特定细菌靶蛋白的抑制作用,发现茶多酚也能通过作用于细菌的某些靶蛋白而起到抗菌作用。DNA旋转酶是喹诺酮类(4-quinolones)抗菌剂的作用靶蛋白,这类药物通过抑制DNA旋转酶的活性影响DNA的正常形态与功能,阻碍DNA的正常复制、转录、转运与重组,从而产生杀菌作用。Gradisar等[38]发现儿茶素物质能通过结合DNA旋转酶B亚基的ATP结合位点而抑制纯化的DNA旋转酶的活性。二氢叶酸还原酶(dihydrofolate reductase)是甲氧苄氨嘧啶(trimethoprim)作用的靶蛋白,该抗菌剂可通过抑制二氢叶酸还原酶活性来阻碍二氢叶酸的合成,最终导致DNA合成的紊乱。Navarro-Martínez等[39]发现EGCG与甲氧苄氨嘧啶在结构上有一定的相似性,EGCG也是二氢叶酸还原酶的抑制因子。此外,细菌的脂肪酸合成酶也是一些抗生素作用的靶蛋白。Zhang等[40]研究结果显示,EGCG和相关的儿茶素物质能够抑制脂肪酸延伸过程中的FabG和FabI还原酶。EGCG通过竞争性地抑制FabG和FabI还原酶的辅因子来抑制这两个酶的活性,没食子结构对其抑制活性非常关键。以上研究结果都证实茶多酚,特别是EGCG,能够作用于细菌的靶蛋白起到抗菌作用。但这些结果都是通过纯化的蛋白进行的体外实验,目前并没有直接证据显示茶多酚物质可以穿过细胞膜屏障而进入细胞内起作用,茶多酚能否在细胞内对这些靶蛋白产生抑制作用还需要进一步的研究和验证。
4.3 茶多酚的氧化抑菌作用
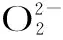
Arakawa等[42]还证实茶多酚的抗菌作用依赖于过氧化氢的产生,因为添加过氧化氢酶可以完全抑制茶多酚的抗菌作用。不过,Cui等[8]通过原子力显微镜和流式细胞仪检测EGCG处理后细胞的形态和细胞内活性氧水平,发现EGCG在抑制G+菌和G-菌的过程中,EGCG产生的过氧化氢起到的作用是不同的。对于G+菌,EGCG主要是通过直接结合肽聚糖层来起到抑制作用,过氧化氢的氧化作用不明显;对于G-菌,则主要是由于EGCG产生过氧化氢对细菌产生了氧化抑制作用。Maeta等[45]研究茶多酚对酵母的作用发现,茶多酚可在弱碱性的培养基中产生过氧化氢,1 mg/mL的绿茶多酚就可以在培养基中产生约400 μmol/L的过氧化氢,并且可促使酵母细胞产生氧化应激反应。作者所在研究团队近年来通过研究茶多酚对铜绿假单胞菌抑制作用机制也发现,茶多酚在弱碱性条件通过产生过氧化氢对细菌产生抑制作用,同时诱导抗氧化相关基因的上调表达,并导致细菌对高温、有机酸等多种胁迫条件产生耐受性[46-47]。目前,国内外对于茶多酚氧化抑菌作用的研究还非常有限,茶多酚对细胞产生氧化损伤的现象主要来自于对人体细胞系的研究结果。例如,高浓度(10-3mol/L)的EGCG可以作为氧化剂对人细胞DNA产生氧化损伤,但是低浓度(10-8~10-5mol/L)的EGCG就表现出抗氧化的效果[40]。Nakagawa等[48]发现50 μmol/L EGCG可以在磷酸缓冲液(pH7.8)中产生约40 μmol/L的过氧化氢,从而造成肿瘤细胞的凋亡。
5 结语
随着茶多酚在食品领域越来越广泛的应用,人们必须更加全面和深入地了解茶多酚的抗菌特性。本文初步总结了前人对于茶多酚的抗菌特性的研究成果,目前尚存在某些不足及有待加强之处。茶多酚抗菌效果的检测方法尚缺乏统一标准,对来源于不同文献的数据进行比较分析存在困难;大多数实验数据均来自于非食品体系的研究结果,至于食品成分对茶多酚抗菌作用的影响还需进一步研究;茶多酚和其他植物来源的抗菌物质协同作用的研究较少,开发对茶多酚有增效活性的天然物质也将是今后的一个重要发展方向;食源致病菌的耐药情况越来越严重,而目前茶多酚对食源耐药菌的抑制作用或者协同抑菌的研究不多;茶多酚之所以能够得到广泛应用,是因为人们对其安全性的认可,但是,茶多酚与细菌相互作用的研究还非常有限,对于茶多酚是否会诱导细菌产生对其他抗菌剂以及逆境条件(如食品加工过程中的高温、低温、酸碱、高盐等极端条件)产生耐受性还不是很清楚,缺少风险评估;另外,目前国内外对于茶多酚抑菌机制尚不十分清楚,使得茶多酚的应用缺乏科学的依据和指导,很大程度上限制了茶多酚在食品和医药领域的进一步推广。因此,为了更好地开发茶多酚的应用潜能,对于茶多酚的抗菌特性及机理的研究必须更加广泛和深入。
[1]Pandey R,Ter Beek A,Vischer NO,et al. Quantitative analysis of the effect of specific tea compounds on germination and outgrowth of Bacillus subtilis spores at single cell resolution[J]. Food Microbiology,2015,45(Pt A):63-70.
[2]Shen T,Khor SC,Zhou F,et al. Chemoprevention by lipid-soluble tea polyphenols in diethylnitrosamine/phenobarbital-induced hepatic precancerous lesions[J]. Anticancer Research. 2014,34(2):683-693.
[3]吴亮宇,林金科. 茶多酚抗辐射研究进展[J]. 茶叶,2011,37(4):213-221.
[4]Gordon NC,Wareham DW. Antimicrobial activity of the green tea polyphenol(-)-epigallocatechin-3-gallate(EGCG)against clinical isolates of Stenotrophomonas maltophilia[J]. International Journal of Antimicrobial Agents,2010,36(2):129-131.
[5]Friedman M. Overview of antibacterial,antitoxin,antiviral,and antifungal activities of tea flavonoids and teas[J]. Molecular Nutrition & Food Research,2007,51(1):116-134.
[6]Mcnaught JG. On the action of cold or lukewarm tea on Bacillus typhosus[J]. Journal of the Royal Army Medical Corps,1906,7:372-373.
[7]Reygaert WC. The antimicrobial possibilities of green tea[J]. Front Microbiology,2014,5:434.
[8]Cui Y,Oh YJ,Lim J,et al. AFM study of the differential inhibitory effects of the green tea polyphenol(-)-epigallocatechin-3-gallate(EGCG)against Gram-positive and Gram-negative bacteria[J]. Food Microbiology,2012,29(1):80-87.
[9]Yi S,Li J,Zhu J,et al. Effect of tea polyphenols on microbiological and biochemical quality of Collichthys fish ball[J]. Journal of the Science of Food and Agriculture,2011,91(9):1591-1597.
[10]王慧敏,朱军莉,陆海霞,等. 茶多酚抑制腐败希瓦氏菌机理研究[J]. 茶叶科学,2014,34(2):149-155.
[11]Friedman M,Henika PR,Levin CE,et al. Antimicrobial activities of tea catechins and theaflavins and tea extracts against Bacillus cereus[J]. Journal of Food Protection,2006,69(2):354-361.
[12]Yoda Y,Hu ZQ,Zhao WH,et al. Different susceptibilities of Staphylococcus and Gram-negative rods to epigallocatechin gallate[J]. Journal of Infection and Chemotherapy,2004,10(1):55-58.
[13]Araghizadeh A,Kohanteb J,Fani MM. Inhibitory activity of green tea(Camellia sinensis)extract on some clinically isolated cariogenic and periodontopathic bacteria[J]. Medical Principles and Practice,2013,22(4):368-372.
[14]Sudano Roccaro A,Blanco AR,Giuliano F,et al. Epigallocatechin-gallate enhances the activity of tetracycline in staphylococci by inhibiting its efflux from bacterial cells[J]. Antimicrobial Agents and Chemotherapy,2004,48(6):1968-1973.
[15]Haghjoo B,Lee LH,Habiba U,et al. The synergistic effects of green tea polyphenols and antibiotics against potential pathogens[J]. Advances in Bioscience and Biotechnology,2013,4:959-967.
[16]Stapleton PD,Shah S,Hara Y,et al. Potentiation of catechin gallate-mediated sensitization of Staphylococcus aureus to oxacillin by nongalloylated catechins[J]. Antimicrobial Agents and Chemotherapy,2006,50(2):752-755.
[17]Aboulmagd E,Al-Mohammed HI,Al-Badry S. Synergism and postantibiotic effect of green tea extract and imipenem against methicillin-resistant Staphylococcus aureus[J]. The Journal of Microbiology,2011,1:89-96.
[18]Fanaki NH,Kassem MA,Fawzi MA,et al. Influence of aqueous green tea extract on the antimicrobial activity of some antibiotics against multiresistant clinical isolates[J]. Egyptian Journal of Medical Microbiology,2008,17:449-460.
[19]Cui Y,Kim SH,Kim H,et al. AFM probing the mechanism of synergistic effects of the green tea polyphenol(-)-epigallocatechin-3-gallate(EGCG)with cefotaxime against extended-spectrum beta-lactamase(ESBL)-producing Escherichia coli[J]. PloS One,2012,7(11):e48880.
[20]Passat DN. Interactions of black and green tea water extracts with antibiotics activity in local urinary isolated Escherichia coli[J]. Journal of Al Nahrain University,2012,15:134-142.
[21]Juneja VK,Bari ML,Inatsu Y,et al. Control of Clostridium perfringens spores by green tea leaf extracts during cooling of cooked ground beef,chicken,and pork[J]. Journal of Food Protection,2007,70(6):1429-1433.
[22]Fan W,Chi Y,Zhang S. The use of a tea polyphenol dip to extend the shelf life of silver carp(Hypophthalmicthys molitrix)during storage in ice[J]. Food Chemistry,2008,108(1):148-153.
[23]Feng L,Jiang T,Wang Y,et al. Effects of tea polyphenol coating combined with ozone water washing on the storage quality of black sea bream(Sparus macrocephalus)[J]. Food Chemistry,2012,135(4):2915-2921.
[24]Li T,Li J,Hu W,et al. Quality enhancement in refrigerated red drum(Sciaenops ocellatus)fillets using chitosan coatings containing natural preservatives[J]. Food Chemistry,2013,138(2-3):821-826.
[25]钟艳梅,李耀斌. 茶多酚对新鲜原果汁保鲜效果的影响[J]. 现代食品科技,2011,27(6):630-633.
[26]Kim S,Ruengwilysup C,Fung DY. Antibacterial effect of water-soluble tea extracts on foodborne pathogens in laboratory medium and in a food model[J]. Journal of Food Protection,2004,67(11):2608-2612.
[27]Hisano M,Yamaguchi K,Inoue Y,et al. Inhibitory effect of catechin against the superantigen staphylococcal enterotoxin B(SEB)[J]. Archives of Dermatological Research,2003,295(5):183-189.
[28]Friedman M,Rasooly R. Review of the inhibition of biological activities of food-related selected toxins by natural compounds[J]. Toxins(Basel). 2013,5(4):743-775.
[29]Xu X,Zhou XD,Wu CD. The tea catechin epigallocatechin gallate suppresses cariogenic virulence factors of Streptococcus mutans[J]. Antimicrobial Agents and Chemotherapy,2011,55(3):1229-1236.
[30]Sirk TW,Brown EF,Friedman M,et al. Molecular binding of catechins to biomembranes:relationship to biological activity. Journal of Agricultural and Food Chemistry,2009,57(15):6720-6728.
[31]Sirk TW,Brown EF,Sum AK,et al. Molecular dynamics study on the biophysical interactions of seven green tea catechins with lipid bilayers of cell membranes[J]. Journal of Agricultural and Food Chemistry,2008,56(17):7750-7758.
[32]Sharma A,Gupta S,Sarethy IP,et al. Green tea extract:possible mechanism and antibacterial activity on skin pathogens[J]. Food Chemistry,2012,135(2):672-675.
[33]Lee P,Tan KS. Effects of Epigallocatechin gallate against Enterococcus faecalis biofilm and virulence. Archives of Oral Biology,2015,60(3):393-399.
[34]Vidigal PG,Müsken M,Becker KA,et al. Effects of green tea compound epigallocatechin-3-gallate against Stenotrophomonas maltophilia infection and biofilm[J]. PLoS One,2014,9(4):e92876.
[35]Shah S,Stapleton P D,Taylor PW. The polyphenol(-)-epicatechin gallate disrupts the secretion of virulence-related proteins by Staphylococcus aureus[J]. Letters in Applied Microbiology,2008,46(2):181-185.
[36]Yi SM,Zhu JL,Fu LL,et al. Tea polyphenols inhibit Pseudomonas aeruginosa through damage to the cell membrane[J]. International Journal of Food Microbiology,2010,144(1):111-117.
[37]Yi S,Wang W,Bai F,et al. Antimicrobial effect and membrane-active mechanism of tea polyphenols against Serratia marcescens[J]. World Journal of Microbiology and Biotechnology,2014,30(2):451-60.
[38]Gradisar H,Pristovsek P,Plaper A,et al. Green tea catechins inhibit bacterial DNA gyrase by interaction with its ATP binding site[J]. Journal of Medicinal Chemistry,2007,50(2):264-271.
[39]Navarro-Martínez MD,Navarro-Perán E,Cabezas-Herrera J,et al. Antifolate activity of epigallocatechin against Stenotrophomonas maltophilia[J]. Antimicrobial Agents and Chemotherapy,2005,49(7):2914-2920.
[40]Zhang YM,Rock CO. Evaluation of epigallocatechin gallate and related plant polyphenols as inhibitors of the FabG and FabI reductases of bacterial type II fatty-acid synthase[J]. The Journal of Biological Chemistry,2004,279(30):30994-31001.
[41]Akagawa M,Shigemitsu T,Suyama K. Production of hydrogen peroxide by polyphenols and polyphenol-rich beverages under quasi-physiological conditions[J]. Bioscience,Biotechnology,and Biochemistry,2003,67(12):2632-2640.
[42]Akagawa M,Shigemitsu T,Suyama K. Role of hydrogen peroxide in bactericidal action of catechin[J]. Bioscience,Biotechnology,and Biochemistry,2004,27(3):277-281.
[43]Nakagawa H,Hasumi K,Woo JT,et al. Generation of hydrogen peroxide primarily contributes to the induction of Fe(II)-dependent apoptosis in Jurkat cells by(-)-epigallocatechin gallate[J]. Carcinogenesis,2004,25(9):1567-1574.
[44]Long LH,Clement MV,Halliwell B. Artifacts in cell culture:rapid generation of hydrogen peroxide on addition of(-)-epigallocatechin,(-)-epigallocatechin gallate,(+)-catechin,and quercetin to commonly used cell culture media[J]. Biochemical and Biophysical Research Communications,2000,273(1):50-53.
[45]Maeta K,Nomura W,Takatsume Y,et al. Green tea polyphenols function as prooxidants to activate oxidative-stress-responsive transcription factors in yeasts[J]. Applied and Environmental Microbiology, 2007,73(2):572-580.
[46]Liu X,Li J,Yang Y,et al. Exposure of Pseudomonas aeruginosa to green tea polyphenols enhances the tolerance to various environmental stresses[J]. World Journal of Microbiology and Biotechnology,2012,28(12):3373-3380.
[47]Liu X,Li J,Wang Y,et al. Green tea polyphenols function as prooxidants to inhibit Pseudomonas aeruginosa and induce the expression of oxidative stress-related genes[J]. Folia Microbiologica(Praha),2013,58(3):211-217.
[48]Kanadzu M,Lu Y,Morimoto K. Dual function of(-)-epigallocatechin gallate(EGCG)in healthy human lymphocytes[J]. Cancer Letters,2006,241(2):250-255.
Research progress in antibacterial properties of tea polyphenols
YANG Hai-lun1,LIU Xiao-xiang1,*,ZHU Jun-li2,LI Jian-rong3
(1.Faculty of Basic Medicine,Zhejiang Medical College,Hangzhou 310053,China;2.College of Food Science and Biotechnology,Zhejiang Gongshang University,Food Safety Key Lab of Zhejiang Province,Hangzhou 310035,China;3. Food Safety Key Lab of Liaoning Province,Bohai University,Jinzhou 121013,China)
Tea polyphenols(TP)as the natural compounds extracted from tea with broad-spectrum antimicrobial activity,are widely used as natural food preservatives. With the increasing concern of food safety,TP was recognized and accepted for its better security. Based on the research status on antimicrobial properties of TP at home and abroad,the researches that concerned with the chemical composition,antimicrobial activities,inactivation effect on bacterial toxins and antimicrobial mechanisms of TP were reviewed systematically in this paper. This work aimed at providing some references for wider and more proper application of TP in food and medicine field.
tea polyphenols;natural food preservative;antimicrobial property;antimicrobial mechanism;research progress
2015-02-12
杨海伦(1995-),女,大专,研究方向:中草药活性成分研究,E-mail:806549068@qq.com。
*通讯作者:刘小香(1982-),女,博士,副教授,研究方向:食品微生物安全,E-mail:liuxiaoxiang413@126.com。
国家自然科学基金(31501581);浙江医学高等专科学校科研基金项目(2013B03);国家自然科学基金(31271954)。
TS201.1
A
1002-0306(2015)21-0385-05
10.13386/j.issn1002-0306.2015.21.072

