地榆多酚分离纯化及其抗氧化性研究
毛迪锐,姜贵全,张诗朦,孙继伟,曹佳硕
(北华大学林学院,吉林吉林 132013)
地榆多酚分离纯化及其抗氧化性研究
毛迪锐,姜贵全*,张诗朦,孙继伟,曹佳硕
(北华大学林学院,吉林吉林 132013)
通过比较 7 种大孔树脂对地榆多酚的吸附率和解吸率的影响,筛选出 XAD-8 树脂适宜分离地榆多酚。地榆多酚分离纯化的条件为:上样浓度 2.5 mg/mL,pH5.0,平衡吸附时间 3 h,洗脱液乙醇体积分数 60%,上样流速 1.0 mL/min,洗脱流速 1.5 mL/min,纯化后地榆多酚纯度由 20.79%提高到 62.97%。地榆多酚具有较强的抗氧化能力,清除羟自由基和还原能力均高于VC,地榆多酚对羟自由基和DPPH自由基的半抑制质量浓度(IC50)分别为0.179 mg/mL和 0.691 mg/mL。
地榆,多酚,纯化,抗氧化
地榆(Sanguisorbaofficinalis)是蔷薇科地榆属的多年生草本植物。地榆主要分布在灌丛、山坡、草地、草原、草甸及疏林下。地榆中含有多种药用化学成分,主要包括鞣质、三萜皂苷、黄酮、蒽醌[1]等;具有止血、抗氧化、抗肿瘤、抗菌、消炎等多种药理作用[2]。地榆药用部位为根部,所以主要研究其根部所含有的活性成分。毛迪锐等文献[3]报道,地榆根中含有丰富的多酚类物质。植物多酚是具有多羟基结构的植物体主要次生代谢物,具有抗氧化、抑制癌变、抗过敏、抗辐射等多种功效。多酚粗提取物分离纯化的主要方法有大孔树脂吸附法[4]、沉淀分离法[5]、层析分离法[6]、HPLC半制备色谱[7]、高效逆流色谱[8]等。大孔吸附树脂是一种具有三维立体空间的有机高分子聚合物,在植物多酚的分离纯化中被广泛应用[9-11]。
目前,国内对地榆多酚的分离纯化和抗氧化能力研究未见报道。因此,本实验选取了 7 种大孔树脂,通过比较吸附率和解吸率,筛选出适宜分离地榆多酚的树脂,并对地榆多酚的分离纯化工艺进行优化,研究其抗氧化能力,为合理开发利用地榆多酚提供科学依据。
1 材料与方法
1.1 材料与仪器
地榆 采于吉林市二道林场,根洗净、风干、粉碎,过40目筛分器,备用。
HP20大孔树脂 三菱化学公司;XAD7HP、XAD1600大孔树脂 北京慧德易科技有限责任公司;XAD-8、LSA-10大孔树脂 西安蓝晓科技新材料股份有限公司;HB1600大孔树脂 上海旻永实业有限公司;D001大孔树脂 安徽三星树脂科技有限公司;没食子酸标准品 美国Sigma公司;其他试剂 均为国产分析纯。
SE202F电子分析天平 奥豪斯上海公司;JY92-2D超声波细胞粉碎机 宁波新芝生物科技股份有限公司;LG10-2.4A高速离心机 北京医用离心机厂;RE52CS-1旋转蒸发器 上海亚荣生化仪器厂;JH722S可见分光光度计 上海菁华科技仪器有限公司;HZQ-C空气浴振荡器 哈尔滨市东联电子技术开发有限公司;真空冷冻干燥机 德国Christ公司。
1.2 实验方法
1.2.1 地榆多酚提取液的制备 称取地榆根粗粉100 g,加入2000 mL 60%乙醇,在超声功率330 W的条件下提取20 min,超声提取2次,合并滤液,离心分离(6000 r/min,15 min),取上清液于旋转蒸发器中浓缩,除掉乙醇,浓缩液备用。
1.2.2 地榆多酚浓度的测定 采用参照国标(GB/T 8313-2008)方法中的Folin-Ciocalteu法,测定多酚含量。根据标准曲线计算地榆多酚浓度。
1.2.3 大孔树脂的预处理 称取7种不同极性的大孔树脂各10 g,用95%乙醇浸泡24 h,使其充分溶胀,用蒸馏水洗至无醇味;再用1 mol/L的盐酸溶液浸泡24 h,用蒸馏水洗至中性;最后用1 mol/L的氢氧化钠溶液浸泡24 h,用蒸馏水洗至中性,备用。
1.2.4 筛选大孔树脂 准确称取预处理后经滤纸吸干的大孔树脂2.0 g,置于100 mL三角瓶中,加入40 mL浓度为2.5 mg/mL的地榆多酚溶液,恒温(30 ℃)水浴振荡器中(100 r/min)振荡吸附24 h,抽滤,测上清液的吸光度值,按公式(1)、式(2)计算吸附率和吸附量。将充分吸附后的大孔树脂,用蒸馏水洗净表面残留的多酚溶液,置于100 mL三角瓶中,各加入40 mL 60%的乙醇溶液进行解吸。在相同条件下恒温振荡解吸24 h,抽滤,测定吸光度,按公式(3)计算解吸率。根据吸附率和解吸率,优选出适合地榆多酚分离纯化的大孔树脂。
式(1)
式(2)
式(3)
式中:A为吸附率(%);Q为吸附量(mg/g);D为解吸率(%);C0为溶液初始多酚浓度(mg/mL);C1为吸附后溶液剩余多酚浓度(mg/mL);C2为解吸液中多酚的浓度(mg/mL);V1为吸附液体积(mL);V2为解吸液体积(mL);M为干树脂质量(g)。
1.2.5 大孔树脂静态吸附动力学曲线的绘制 分别称取筛选出的大孔树脂2.0g,置于100mL三角瓶中,加入40mL浓度为2.5mg/mL的地榆多酚溶液,按照1.2.4的方法,静态吸附,每隔1h取出一个样品,抽滤,测定吸光度,计算吸附量,绘制静态吸附动力学曲线。
1.2.6 地榆多酚分离纯化条件的优化
1.2.6.1 多酚质量浓度对吸附量的影响 准确称取筛选的树脂 2.0g加入100mL三角瓶中,分别量取40mL质量浓度为1.0、1.5、2.0、2.5、3.0、3.5mg/mL的地榆多酚溶液,恒温振荡,抽滤收集吸附液,测定吸光度值,计算吸附量,确定适宜的上样多酚质量浓度。
1.2.6.2 多酚溶液pH对吸附量的影响 将地榆多酚溶液用盐酸-柠檬酸二钠缓冲溶液和磷酸氢二钠-磷酸二氢钠缓冲溶液分别调节pH至2.0、3.0、4.0、5.0、6.0、7.0、8.0。准确称取大孔树脂2.0g,分别置于100mL三角瓶中,加入浓度为2.5mg/mL的不同pH的地榆多酚溶液40mL,振荡吸附8h,达到吸附饱和,抽滤收集吸附液,测定吸光度,计算吸附量,确定适宜上样多酚溶液pH。
1.2.6.3 洗脱液乙醇体积分数对解吸率的影响 称取充分吸附后的大孔树脂2.0g,置于100mL三角瓶中,分别加入体积分数为20%、40%、60%、80%、95%的乙醇溶液40mL,在30 ℃、100r/min的恒温振荡器中解吸振荡8h。抽滤,收集解吸液,测定解吸液的吸光度,计算解吸率,确定适宜的洗脱液乙醇的体积分数。
1.2.6.4 上样流速对洗脱液中多酚质量浓度的影响 称取 4份预处理过的大孔树脂,分别湿法装入层析柱中(1.5cm×30cm),将地榆多酚提取液(按照1.2.6.1和1.2.6.2的结果调整浓度和pH),按照0.5、1.0、1.5、2.0mL/min的上样流速进行动态吸附,分步收集过柱液,测定各管的多酚吸光度值,计算多酚浓度,确定到达泄露点时的流出液体积(泄露点为流出液中多酚浓度为上样液浓度的1/10)。从而考察上样流速对洗脱液中多酚质量浓度的影响。
1.2.6.5 洗脱流速对树脂解吸率的影响 将吸附饱和的树脂分别湿法装入层析柱中(1.5cm×30cm),将洗脱液乙醇分别按照0.5、1.0、1.5、2.0mL/min的洗脱流速进行洗脱。通过计算解吸率,确定适宜的洗脱流速。
1.2.7 地榆多酚纯度 将上样液和解吸液分别蒸发浓缩,冻干6h。准确称量冻干粉质量,并称取0.01g定容于10mL容量瓶,测吸光度,按公式(4)计算纯化前后的纯度。
多酚纯度(%)=多酚质量浓度×溶液体积/冻干粉质量×100
式(4)
1.2.8 地榆多酚抗氧化能力的研究
1.2.8.1 羟自由基清除能力的测定 根据文献[12]的方法测定地榆多酚羟自由基清除能力。将纯化后的地榆多酚配制成不同浓度的溶液,各取2mL加入具塞试管中,加入6mmol/L的FeSO4溶液2mL,摇匀,再加入6mmol/L水杨酸溶液2mL,摇匀,最后加入6mmol/L过氧化氢溶液2mL,在37 ℃水浴锅中反应30min,于510nm处测吸光度。按照公式(5)计算羟自由基清除率。VC为对照。
式(5)
式中:A0为未加入样品的溶液的吸光度值;A1为加入样品和H2O2溶液的吸光度值;A2为未加入H2O2溶液的吸光度值。
1.2.8.2 DPPH自由基清除能力的测定 参考Brand Williams[13]和古绍彬[14]的方法略作修改。准确配制质量浓度为2.5×10-2mg/mL的DPPH标准溶液。分别取0、2、4、6、8、10 mL标准溶液用乙醇定容至10 mL,分别在515 nm波长处的吸光度值,制作标准曲线。
以无水乙醇为溶剂,配制不同浓度的地榆多酚溶液,分别取0.2 mL样液,加入7.8 mL质量浓度为2.5×10-2mg/mL的DPPH标准液,以乙醇代替样液为空白。混合溶液摇匀,在515 nm波长处,测定其在不同时间的吸光度值,根据标准曲线计算DPPH的质量浓度,按照公式(6)计算清除率。
清除率(%)=(1-反应30 min时DPPH的浓度/DPPH起始浓度)×100
式(6)
1.2.8.3 还原能力的测定 地榆多酚还原能力的测定根据陈海光等[15]方法,取不同浓度的纯化后的样品溶液各0.5 mL,加入0.2 mo1/L磷酸盐缓冲液(pH6.6)和1%的铁氰化钾溶液各2.5 mL,混匀后置50 ℃水浴中反应20 min,然后加入10%的三氯乙酸溶液2.5 mL,混合后离心分离(6000 r/min,8 min)。取上清液和蒸馏水各2.5 mL,加入1 mL 0.1%三氯化铁溶液混合均匀,静置10 min后,以试剂作空白调零,在700 nm波长处测定吸光度,吸光度增加,表明还原能力增加。以VC做对照。
1.3 数据统计与分析
每次均进行3次平行实验,结果取平均值。实验数据用SPSS 12.0软件分析。
2 结果与分析
2.1 标准曲线的绘制
以吸光度Y为纵坐标,没食子酸溶液质量浓度X(μg/mL)为横坐标,得回归方程为:Y=0.01X+0.0409,R2=0.9952,表明没食子酸在10~100 μg/mL范围内浓度与吸光度呈良好的线性关系。
2.2 大孔树脂的筛选
7种大孔树脂对地榆多酚的静态吸附实验结果见图1。由图1可以看出,各种大孔树脂对地榆多酚的吸附、解吸效果不同。从吸附效果看,吸附率较高的为XAD-8和XAD7HP大孔树脂,吸附率分别为85.79%、84.45%。从解吸角度看,解吸率较高的为XAD-8和HP20,解吸率分别为96.58%、83.56%。综合考虑吸附率与解吸率,XAD-8大孔树脂不仅具有较强的吸附能力,而且解吸率也较高,因此选取XAD-8作为分离地榆多酚的大孔树脂。
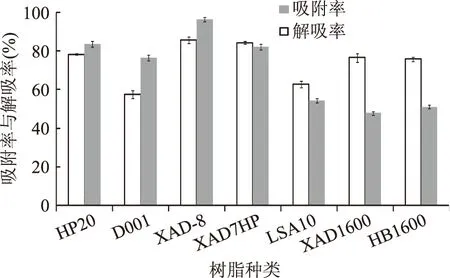
图1 7种大孔树脂对地榆多酚的吸附率与解吸率Fig.1 Adsorption and desorption rate of 7 resins for polyphenols from Sanguisorba officinalis
2.3 大孔树脂静态吸附动力学曲线
大孔树脂静态吸附动力学曲线见图2。由图2可知,随着吸附时间的增加,大孔树脂对地榆多酚的吸附量也随之增大,在3 h时,已经基本达到吸附平衡,时间继续增加时,吸附量变化不大,因此,XAD-8树脂对地榆多酚的吸附平衡时间为3 h。
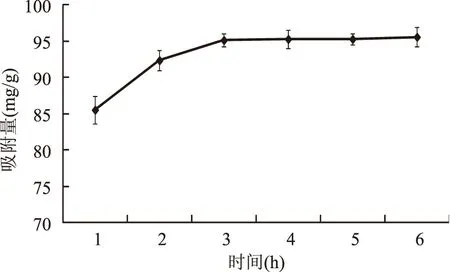
图2 XAD-8 树脂静态吸附动力学曲线Fig.2 Kinetic curves of static adsorption of XAD-8 macroporous resins
2.4 地榆多酚分离纯化条件的优化
2.4.1 多酚溶液质量浓度对吸附量的影响 从图3中可以看出,在低浓度条件下,随着上样液浓度的增大,可吸附物质也随之增加,当上样液浓度达到2.5 mg/mL时,吸附量最大,继续增大上样液的浓度,吸附量反而下降。这是因为根据吸附平衡理论,浓度太高时,容易发生多层吸附,堵塞微孔,降低内孔利用率,导致吸附量降低[16]。因此多酚质量浓度为2.5 mg/mL较合适。
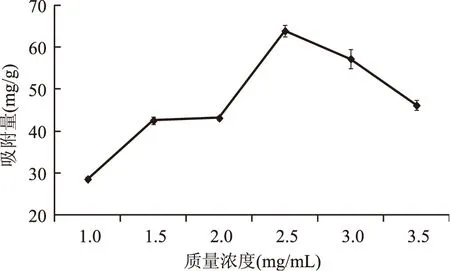
图3 上样浓度对吸附量的影响Fig.3 Effect of sample concentration on adsorption quantity
2.4.2 多酚溶液pH对吸附量的影响 由图4可以看出,随着pH的升高,XAD-8大孔树脂对地榆多酚的吸附量也不断增大,当pH达到5.0时,吸附量最大,达到46.32 mg/g。当pH继续升高时,吸附量反而下降。原因可能是多酚类化合物具有较多的羟基,容易电离出羟基上的H+,使水溶液呈弱酸性,而在酸性条件下,不易发生H+的电离,从而保证了多酚以分子的形式存在,利于吸附。故选择多酚溶液pH为5.0左右为宜。
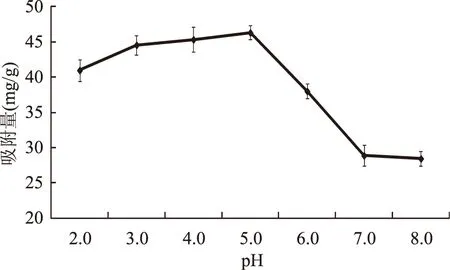
图4 pH对吸附量的影响Fig.4 Effect of pH value on the adsorption quantity
2.4.3 洗脱液乙醇体积分数对解吸率的影响 由图5可以看出乙醇体积分数对地榆多酚解吸率有较大的影响,随着乙醇体积分数的增大,解吸率也随之升高,当乙醇体积分数为60% 时,解吸率最大,为95.14%;但继续增加乙醇的体积分数时,解吸率反而略有下降。分析原因:多酚是一类极性化合物,随着乙醇体积分数的增加,溶剂的极性发生了改变,使得被吸附的多酚不易被洗脱下来。所以,选用体积分数60%乙醇溶液作为地榆多酚的洗脱液。
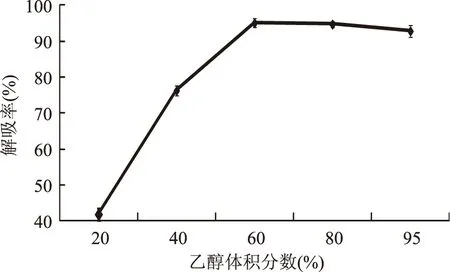
图5 乙醇体积分数对解吸率的影响Fig.5 Effect of ethanol concentration on desorption rate
2.4.4 上样流速对洗脱液多酚质量浓度的影响 从图6可知,上样流速不同,出现漏点所需要的洗脱体积也不相同,分别为170,150,100,80 mL附近。这是因为流速的变化会影响溶质向树脂内表面的扩散,从而影响吸附效果。从图6中可以看出,上样流速过快,多酚与树脂还未来得及充分接触发生吸附,便很快通过层析柱而流出柱外,所以出现泄露点较快;上样流速为0.5 mL/min时,出现泄露点的时间较晚,操作时间长,降低分离效率;综合实际生产考虑,选用1.0 mL/min的流速进行上样。
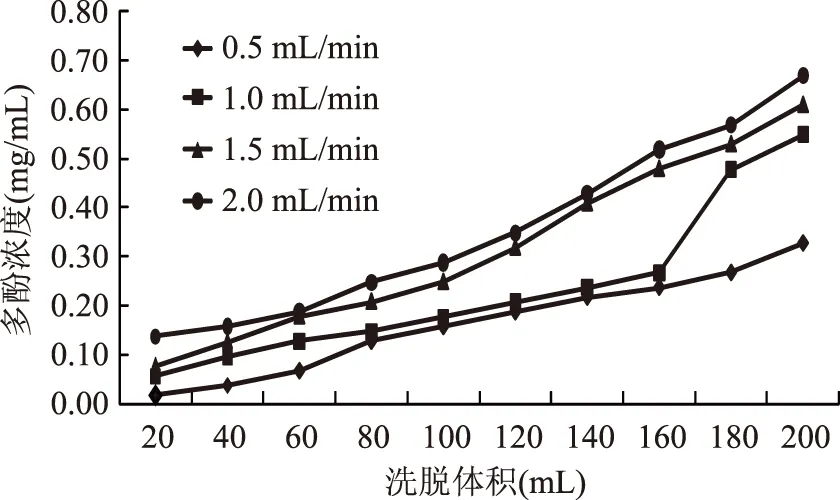
图6 上样流速对洗脱液多酚质量浓度的影响Fig.6 Effect of sample flowing rate of eluent concentration of polyphenols
2.4.5 洗脱流速对树脂解吸率的影响 如图7所示,当洗脱流速分别为0.5、1.0、1.5、2.0 mL/min时,解吸率分别为56.06%、71.81%、79.52%、65.59%,洗脱流速为1.5 mL/min时解吸率最高,故洗脱流速为1.5 mL/min最佳。

图7 洗脱流速对解吸率的影响Fig.7 Effect of elution speed on desorption rate
2.5 地榆多酚纯度
地榆多酚经XAD-8树脂纯化后,多酚纯度从20.79%±0.71%提高到62.97%±1.24%,纯度提高3.0倍左右。
2.6 地榆多酚抗氧化能力的研究
2.6.1 羟自由基清除能力的测定 由图8可知,在低浓度时,VC的清除能力高于多酚,当浓度大于0.25 mg/mL时,地榆多酚的清除能力超过VC,在浓度为1.0 mg/mL时,清除率达到87.8%。地榆多酚具有较强的清除羟自由基的能力,羟自由基的半抑制质量浓度(IC50)为0.179 mg/mL。
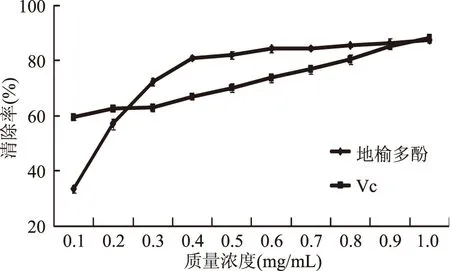
图8 地榆多酚清除羟自由基的能力Fig.8 Scavenging hydroxyl free radical capacity of Sanguisorba officinalis polyphenols
2.6.2 DPPH自由基清除能力的测定 以吸光度Y为纵坐标,DPPH标准溶液质量浓度X(mg/mL)为横坐标,得回归方程为:Y=0.1107X-0.0104(R2=0.9996),说明吸光度与DPPH溶液浓度线性关系良好。由图9可知,地榆多酚对DPPH自由基具有显著的清除能力。在0.5~3.0 mg/mL的质量浓度范围内,地榆多酚清除DPPH自由基的能力随着浓度的增加而增加,质量浓度达到2.5 mg/mL以后,增加趋势趋于平缓。地榆多酚清除DPPH自由基的能力与浓度呈线性相关:Y=18.44x+37.25(R2=0.991),半抑制质量浓度(IC50)为0.691 mg/mL。
2.6.3 还原能力的测定 由图10可知,随着质量浓度的增加,地榆多酚和VC的吸光度值都增加,表明还原能力随着多酚质量浓度的增加而增加。在0.5~3.0 mg/mL范围内,地榆多酚的还原能力大于VC。地榆多酚溶液的还原能力与浓度呈线性相关:Y=0.170x+0.422(R2=0.961)。
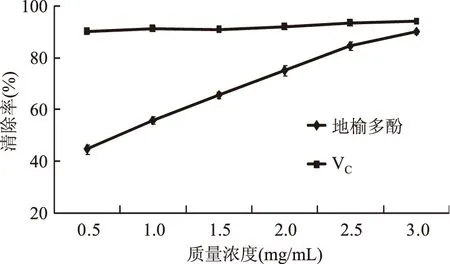
图9 地榆多酚清除DPPH自由基的能力Fig.9 Scavenging DPPH free radical capacity of Sanguisorba officinalis polyphenols
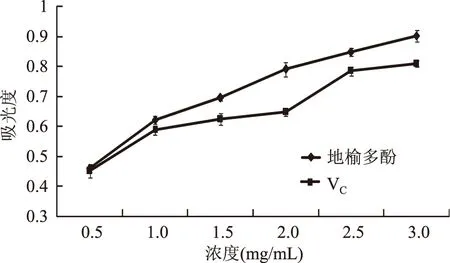
图10 地榆多酚的还原能力Fig.10 The reduction capability of Sanguisorba officinalis polyphenols
3 结论
通过比较吸附率和解吸率,XAD-8大孔树脂是分离纯化地榆多酚的最佳树脂类型。地榆多酚分离纯化的工艺条件为:上样液浓度2.5 mg/mL,pH5.0,吸附平衡时间为3 h,洗脱液乙醇体积分数60%;上样流速1.0 mL/min,洗脱流速1.5 mL/min。地榆多酚经XAD-8树脂纯化后多酚纯度从20.79%提高到62.97%,提高3.0倍。XAD-8树脂对地榆多酚具有吸附速度快,解吸效果好等优点。
抗氧化能力研究结果表明地榆多酚具有较强的抗氧化能力。地榆多酚具有还原能力和对羟基自由基、DPPH自由基清除能力。在0.5~3.0 mg/mL范围内,地榆多酚的还原能力大于VC。当浓度大于0.25 mg/mL时,地榆多酚的清除羟自由基的能力超过VC;地榆多酚对羟自由基和DPPH自由基的半抑制质量浓度(IC50)分别为0.179 mg/mL和0.691 mg/mL。实验结果可以为地榆多酚的进一步开发利用提供理论基础。
[1]袁振海,孙立立.地榆现代研究进展[J].中国中医药信息杂志,2007,14(3):90-92.
[2]夏红,孙立立,孙敬勇,等.地榆化学成分及药理活性研究进展[J].食品与药品,2009,11(7):67-69.
[3]毛迪锐,姜贵全,曹佳硕,等.响应面法优化地榆根多酚提取工艺[J].北华大学学报(自然科学版),2015,16(1):100-105.
[4]孙协军,李秀霞,励建荣,等. 树脂法分离纯化山楂黄酮[J].食品工业科技,2014,35(16):201-206.
[5]戴群晶.用茶末及废茶枝叶提取高纯茶多酚的研究[J].现代食品科技,2007,23(1):45-48.
[6]TANG Zhonghai,QIN Jingping,XU Xiaona,et al. Applying silica gel column chromatography purify resveratrol from extracts of morus alha L.Leaf[J].Journal of Medicinal Plants Research,2011,5(14):3020-3027.
[7]欧阳乐,王振宇,刘冉,等. HPLC法分离鉴定樟子松树皮多酚研究[J].食品工业科技,2013,34(13):276-280.
[8]Kohler N,Wray V,Winterhalter P. Preparative isolation of procyanidins from grape seed extracts by high-speed counter-current chromatography[J]. Journal of Chromatography A,2008,1177:114-125.
[9]刘荣,何娇,王振宇.大孔树脂对樟子松树皮多酚的纯化工艺的研究[J].食品工业科技,2013,34(11):201-206.
[10]陶莎,黄英,康玉凡,等.大孔吸附树脂分离纯化红小豆多酚工艺及效果[J].农业工程学报,2013,29(23):276-285.
[11]张智,于震,王振宇,等.落叶松树皮多酚纯化工艺研究[J].食品工业科技,2014,35(5):187-191.
[12]陈晨,胡文忠,田沛源,等.超声辅助提取香蕉皮多酚工艺优化及其抗氧化性的分析[J].食品科学,2014,35(2):12-17.
[13]Brand-Williams W,Cuvelie M E,Berset C. Use of a free radical method to evaluate antioxidant activity[J]. Lebensm Wiss Technology,1995,28(1):25-30.
[14]古绍彬,吴影,董红敏,等.苹果多酚抗氧化作用及其清除自由基能力的研究[J].中国粮油学报,2013,28(4):58-62.
[15]陈海光,刘朝霞,于立梅.山竹果皮中多酚类物质的抗氧化性研究[J].食品工业科技,2011,32(9):107-110.
[16]张泽生,赵春艳,曹力心,等.大孔吸附树脂分离纯化山楂果中原花青素的研究[J].现代食品科技,2006,22(2):16-19.
Separation,purification and antioxidant activity of polyphenols fromSanguisorbaofficinalis
MAO Di-rui,JIANG Gui-quan*,ZHANG Shi-meng,SUN Ji-wei,CAO Jia-shuo
(Forestry College of Beihua University,Jilin 132012,China)
Through comparing the adsorption and desorption rates of 7 kinds of macroporous resin to polyphenols,the XAD-8 resin was selected to purify polyphenols ofSanguisorbaofficinalis. The optimal purification conditions were the sample concentration of 2.5 mg/mL,pH5.0,the adsorption equilibrium of 3 h,ethanol elution volume fraction of 60%,the sample flow rate of 1.0 mL/min,elution flow rate 1.5 mL/min. After purification ofSanguisorbaofficinalispolyphenols,the polyphenol purity were increased from 20.79% to 62.97%. Polyphenols had strong antioxidant capacity,the scavenging hydroxyl free radical activities and reducing activities of it were superior to VC,the IC50values of hydroxyl radical and DPPH radical were respectively 0.179 mg/mL and 0.691 mg/mL.
Sanguisorbaofficinalis;polyphenols;purification;antioxidant
2015-02-13
毛迪锐(1978-),女,硕士,讲师,研究方向:天然产物开发利用,E-mail:mdrteacher@163.com。
*通讯作者:姜贵全(1975-),男,博士,教授,研究方向:天然产物化学,E-mail:jiangguiquan11@163.com。
吉林省植物化工创新团队(20130521022JH); 吉林省医药专项(20140311056YY)。
TS201.1
A
1002-0306(2015)21-0068-05
10.13386/j.issn1002-0306.2015.21.005

