新疆发酵驼乳对糖尿病大鼠血清氨基酸代谢的影响
刘健彤,肖雪筠,余 兰,塔布斯·马那尔,新华·那比,*
(1.新疆医科大学 药理教研室,新疆军区机关医院,新疆乌鲁木齐 830011;2.新疆医科大学 药理教研室,新疆乌鲁木齐 830011)
新疆发酵驼乳对糖尿病大鼠血清氨基酸代谢的影响
刘健彤1,肖雪筠2,余 兰2,塔布斯·马那尔2,新华·那比2,*
(1.新疆医科大学 药理教研室,新疆军区机关医院,新疆乌鲁木齐 830011;2.新疆医科大学 药理教研室,新疆乌鲁木齐 830011)
目的:利用HPLC法,开展糖尿病血清代谢组学研究新疆发酵驼乳抗糖尿病作用,并比较驼乳发酵前后氨基酸含量变化。方法:高糖高脂饲料喂养8周并注射链尿佐菌素30 mg·kg-1建立糖尿病大鼠模型,成模后大鼠随机分为五组,分别给予发酵驼乳低、中、高剂量和西格列汀,正常组大鼠给予新鲜驼乳。4周后采用HPLC法测定血清游离氨基酸含量。结果:与正常组比较,模型组大鼠血清天冬氨酸、苯丙氨酸含量升高,苏氨酸、酪氨酸含量降低。发酵驼乳中剂量组可降低天冬氨酸、苯丙氨酸含量,提升甘氨酸、精氨酸含量。发酵驼乳高剂量组显著升高血清精氨酸含量。西格列汀组可降低血清天冬氨酸含量,提升甘氨酸、精氨酸、亮氨酸和异亮氨酸含量。结论:发酵驼乳中高剂量组可降低糖尿病大鼠血清天冬氨酸、苯丙氨酸含量,增加甘氨酸、精氨酸含量,对糖尿病大鼠血清氨基酸代谢紊乱有一定调节作用。
发酵驼乳,糖尿病大鼠,HPLC,血清氨基酸
糖尿病(diabetes)是一种以高血糖症为主要特征的代谢性疾病,与胰岛素分泌缺乏或其生物功能受损有关[1]。糖代谢紊乱会影响氨基酸的代谢,氨基酸代谢在糖尿病物质代谢中起到的作用日益受到关注[2]。有学者以糖尿病患者和正常人的尿液为研究对象,分析了糖尿病患者尿液的特征代谢谱,发现糖尿病患者尿液中的糖、脂、氨基酸等代谢通路都发生了紊乱[3]。有研究[4]利用血浆代谢谱分析证明了酪氨酸、苯丙氨酸和异亮氨酸等支链芳香族氨基酸能够预测2型糖尿病的风险,其中亮氨酸、异亮氨酸、缬氨酸与2型糖尿病的关系研究最为广泛[5]。亮氨酸能够协助增加胰岛素敏感性、抵抗高脂饲养诱发的肥胖、降低血糖[6-8];还能够促进细胞对葡萄糖的摄取利用、使实验动物血糖降低[9]。进一步测定血浆氨基酸可能有助于确定早期糖尿病的风险因素。氨基酸刺激胰岛素分泌的理论也已得到证实,调节氨基酸代谢可能对糖尿病治疗具有重大意义。
新疆哈萨克民族的饮食主要以肉食为主,摄入动物脂肪较多,但哈萨克族2型糖尿病患病率却仅为1.56%,这与2型糖尿病的发病机制相悖。本课题组前期研究发现新疆发酵驼乳具有抗炎免疫调节作用和降糖作用[10],发酵乳酪乳清具有抗动脉粥样硬化作用。糖尿病和动脉粥样硬化都与慢性炎症有关,为此,本课题组认为哈萨克族糖尿病发病率低可能与经常食用发酵乳品有关。
新疆发酵驼乳含有多种益生菌,营养价值较高,其中的异亮氨酸、亮氨酸、苏氨酸等氨基酸的比例均高于鸡蛋、牛乳和内蒙古驼乳。本研究采用HPLC法分析给予发酵驼乳后各组大鼠血浆的氨基酸水平,为进一步探讨发酵驼乳防治糖尿病的作用机制提供依据。
1 材料与方法
1.1 材料与仪器
链尿佐菌素(STZ) sigma公司;柠檬酸三钠-柠檬酸缓冲液(0.1 mol·L-1);戊巴比妥钠 德国默克公司;磷酸西格列汀片,规格:100 mg;无水乙酸钠 优级纯,天津市光复化工厂;甲醇和乙腈 色谱纯,美国TEDIA公司;Milipore超纯水 美国Millipore公司。氨基酸对照品 上海国药集团化学试剂有限公司,纯度均大于98%。
实验动物采用健康雄性Wistar大鼠 新疆医科大学实验动物中心,生产许可证:SCXK(新)2011-0004;饲养环境光照12 h/d,室温21±2 ℃,湿度50%±5%。体重180±20 g;高糖高脂饲料(2.5%胆固醇、0.5%胆酸钠、10%猪油、20%蔗糖、67%基础饲料)喂养。
菌株 新疆传统发酵驼乳样品中分离,并由中国农业科学院微生物研究所鉴定;新鲜驼乳 新疆吉木萨尔县。
Waters e2695高效液相色谱仪 美国Waters公司;Waters 2475荧光检测器 美国Waters公司;Waters 2487紫外检测器 美国Waters公司;HSC-12A氮吹仪 天津恒奥科技;SK-1快速混匀器 金坛市医药仪器厂;TDL-5A菲恰尔离心机;MLS-3750高压灭菌锅;DK-600A电热恒温水浴箱;SANYO CO2孵箱;苏净安泰洁净台。
1.2 实验方法
1.2.1 原料预处理及菌种的活化与扩大培养 取新鲜驼乳,在3000 r/min下离心脱脂20 min,弃去上层脂肪后,在15~20 MPa下均质1~2 min,脱脂驼乳于95 ℃下杀菌10 min,后冷却至37 ℃备用。将乳酸菌菌种冻干粉溶解于少量灭菌蒸馏水中,用无菌枪头吸取菌体溶解液置于MRS固体培养基中涂面和划线,于37 ℃下培养48 h。挑取单个菌株于MRS肉汤液体培养基中,于37 ℃恒温培养箱培养24 h,活化2~3代。挑取单个酵母菌菌种在沙氏琼脂培养基中划线,于37 ℃下培养48~72 h后,挑取单个菌株于麦芽汁液体培养基中,于35 ℃恒温培养箱培养24 h,活化2~3代[11]。取上述乳酸菌培养液和酵母菌培养液各5 mL,经3000 r/min离心10 min,收集菌体,用0.9%生理盐水洗涤2次后,混匀制成供试菌悬液,以2%接种量接种于灭菌脱脂驼乳中,分别置于37 ℃和35 ℃培养24 h,制成母发酵剂后备用。
1.2.2 乳酸菌发酵剂活力测定及发酵乳样品的制备 刃天青还原实验法:在9 mL脱脂乳中加入1 mL发酵剂和0.005%刃天青溶液1 mL,在36.7 ℃的恒温培养箱中培养35 min,观察溶液是否完全褪色[12]。新鲜驼乳由4层无菌纱布过滤2遍,经过3000 r/min离心30 min,重复离心3次,脱脂;发酵所需容器高压灭菌15 min,温度121 ℃。脱脂后的驼乳90~95 ℃水浴灭菌15 min,冷却为40~45 ℃;无菌条件下接种,接种量7%、培养温度为37 ℃,发酵时间控制为24 h;发酵结束后冷却并置于4 ℃冰箱中保存20~24 h进行后发酵。
1.2.3 动物模型制备 取Wistar雄性大鼠80只,体重为(180±20)g,适应性饲养3 d,随机抽取10只大鼠做正常对照组,喂普通标准大鼠饲料,剩余70只大鼠给予高糖高脂饲料进行造模,自由进水,每周称体重一次。在第8周末,大鼠禁食不禁水12 h,正常对照组大鼠一次性腹腔注射0.1 mol·L-1pH4.4的柠檬酸三钠-柠檬酸缓冲液,其余造模组的大鼠一次性腹腔注射STZ30 mg·kg-1。3 d后,禁食12 h,尾尖取血,用精密血糖仪测定空腹血糖(FBG),注射STZ1周、2周,测定FBG(测定前禁食12 h),3次FBG均≥11.1 mmol·L-1作为糖尿病模型大鼠。
1.2.4 实验动物分组 随机将成模的60只大鼠分为:模型组、阳性药西格列汀组(30 mg·kg-1)、发酵驼乳低剂量(6.97×106乳酸菌+2.2×104酵母菌)CFU·mL-1、中剂量(6.97×107乳酸菌+2.2×105酵母菌)CFU·mL-1、高剂量(6.97×108乳酸菌+2.2×106酵母菌)CFU·mL-1组,取同批正常大鼠作为正常对照组,每天固定时间(10:00~12:00)灌胃给药,正常组大鼠给予等量蒸馏水,模型组给予灭菌驼乳,灌胃容积为10 mL·kg-1。除正常对照组外,其余5组继续喂食高脂高糖饲料,自由饮水,连续灌胃4周。药物干预4周后,各组大鼠禁食不禁水12 h,用3%的戊巴比妥钠溶液30 mg·kg-1腹腔麻醉,开腹,经腹主动脉取全血置预冷的含EDTA的采血管,立即离心(10000 r/min,10 min,4 ℃),分离血浆,置于-80 ℃冰箱保存。
1.2.5 色谱条件 流动相A:有机相:甲醇∶水∶乙腈=20∶20∶60(v∶v∶v)混匀。流速:1.0 mL/min;检测波长:254 nm;柱温:35 ℃;进样量:10 μL,使用前超生脱气10 min,梯度洗脱程序见表1。流动相B:(水相)缓冲盐:称无水乙酸钠7.4 g加水940 mL,加冰乙酸调pH约8.0至6.5,然后加70 mL乙腈,混匀,用0.45 μm滤膜过滤。

表1 梯度曲线
1.2.6 对照品溶液制备 准确称取氨基酸标准品各10 mg,置于25 mL容量瓶中,用0.1 mol/L的HCl稀释至刻度,摇匀,作为氨基酸贮备溶液,4 ℃冰箱储存。
1.2.7 供试品溶液制备 血浆样品在室温下解冻,精密吸取血浆200 μL,加入400 μL乙腈除蛋白,振摇涡旋后,以12000 r/min离心10 min,取上清液置于2 mL离心管,40 ℃水浴中氮气吹干,用100 μL水超声复过滤,取10 μL放入进样瓶进行衍生,涡旋,水浴15 min(55 ℃)。
1.2.8 测定 按1.2.6项下方法制备供试品溶液并适当稀释,定性依据是各组分保留时间,定量分析采用外标法。
1.3 数据处理
2 结果与分析
2.1 方法学考察
线性:以氨基酸峰面积为纵坐标,浓度为横坐标进行线性回归,线性相关系数(r)为0.9969~0.9998[13];精密度:取供试品溶液,连续进样6次,每次10 μL,各样本的相对峰面积的RSD均小于7%,满足分析要求;稳定性:取供试品溶液,在0、2、4、6、8、12 h进样,衍生后12 h内氨基酸峰面积RSD值在8%以内,说明衍生化后的样品至少在12 h内比较稳定;回收率:回收率由添加的高、中、低三个浓度,本法中氨基酸的回收率RSD值在88.5%~123.4%之间。
2.2 大鼠血清样品中氨基酸含量测定分析色谱图
氨基酸标准品分析色谱图如图1所示,中剂量驼乳组大鼠血清中氨基酸的色谱图如图2所示,均按1.2.5所述色谱条件下测定,氨基酸经衍生后,在30 min内得到有效分离,各氨基酸之间或血浆中内源性物质无相互干扰,说明方法专属性良好,且所对应的峰形近似于对称正态分布曲线。
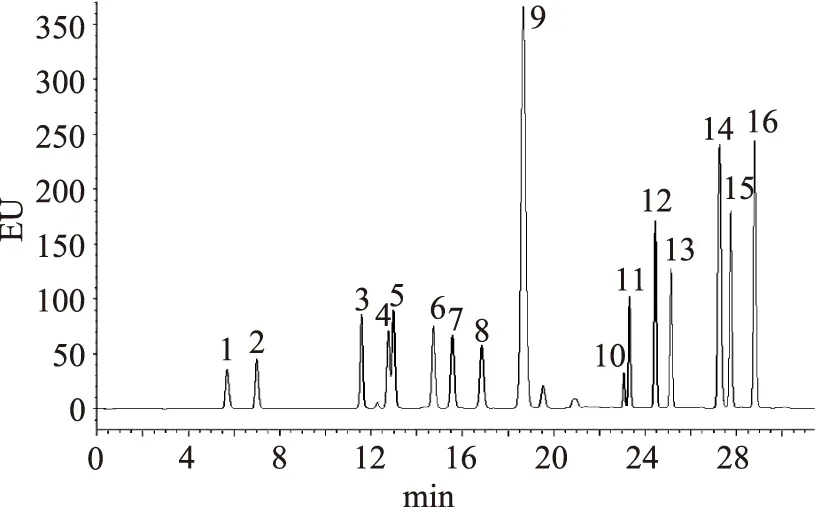
图1 17种混合性氨基酸标准品的色谱图Fig.1 17 kinds of mixed amino acids standard chromatogram注:1:天门冬氨酸;2:谷氨酸;3:丝氨酸;4:甘氨酸;5:组氨酸;6:精氨酸;7:苏氨酸;8:丙氨酸;9:脯氨酸;10:酪氨酸;11:缬氨酸;12:甲硫氨酸;13:胱氨酸;14:异亮氨酸;亮氨酸;15:苯丙氨酸;16:赖氨酸。

图2 中剂量驼乳组大鼠血清中氨基酸的色谱图Fig.2 Chromatogram of camel milk amino acid in serum of rats注:图2中1~16同图1所注。
2.3 HPLC法测定大鼠血清氨基酸
2.3.1 发酵驼乳对糖尿病大鼠血清中必需氨基酸含量影响 如表2所示,与正常组相较,模型组血清游离苯丙氨酸、苏氨酸含量有显著差异(p<0.01)。与模型组相较,中剂量组血清游离苯丙氨酸,西格列汀组亮氨酸和异亮氨酸含量有显著差异(p<0.05或p<0.01)。这与文献报道[4]的苯丙氨酸等能预测糖尿病相符,给予驼乳后能降低糖尿病鼠血清的苯丙氨酸含量,说明驼乳能够调节氨基酸代谢水平,对防治糖尿病有重要意义。
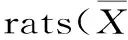
表2 发酵驼乳对糖尿病大鼠血清中必需氨基酸含量影响(均数±标准差)单位(μg/mL)
注:和正常组相较##p<0.01,和模型组相较*p<0.05,**p<0.01。
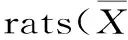
表3 发酵驼乳对糖尿病大鼠血清中非必需氨基酸含量影响(均数±标准差)单位(μg/mL)
注:和正常组相较##p<0.01,和模型组相较*p<0.05,**p<0.01。
2.3.2 发酵驼乳对糖尿病大鼠血清中非必需氨基酸含量影响 如表3所示,与正常组相较,模型组血清游离天冬氨酸含量显著升高。与模型组相较,中剂量组血清游离精氨酸、甘氨酸、天冬氨酸含量有显著差异(p<0.05或p<0.01)。高剂量组血清游离精氨酸含量显著升高(p<0.05)。西格列汀组血清游离甘氨酸、丙氨酸、精氨酸、天冬氨酸含量有显著差异(p<0.05或p<0.01)。在葡萄糖刺激胰岛素分泌的特异性缺乏的同时,精氨酸促胰岛素分泌作用也会显著降低,甘氨酸能够促进组织对葡萄糖的利用,有降血糖的潜能,而服用过发酵驼乳的糖尿病大鼠精氨酸和甘氨酸含量显著升高,近似于阳性药西格列汀,为驼乳用于防治糖尿病提供了依据。
2.3.3 发酵驼乳对糖尿病大鼠血清中半必需氨基酸含量影响 如表4所示,与正常组相较,模型组血清游离酪氨酸含量显著降低(p<0.01)。与模型组相较,其他组血清游离氨基酸含量变化没有统计学意义。

表4 发酵驼乳对糖尿病大鼠血清中半必需氨基酸含量影响(均数±标准差)单位(μg/mL)
注:##p<0.01。
3 结论
实验结果显示糖尿病大鼠血清氨基酸代谢发生了显著变化,而发酵驼乳对糖尿病大鼠血清氨基酸代谢紊乱有一定的调节作用。支链芳香族氨基酸(亮氨酸、缬氨酸、异亮氨酸、酪氨酸和苯丙氨酸),特别是三种支链氨基酸(酪氨酸、苯丙氨酸和异亮氨酸),确实与2型糖尿病的发生发展有着密不可分的联系,苯丙氨酸与酪氨酸能合成重要的神经递质与激素,这种合成物能够参与到机体的糖和脂肪代谢中。亮氨酸是是唯一可以在无葡萄糖和其他氨基酸存在的条件下直接促进胰岛素释放的氨基酸,异亮氨酸通过调节糖和能量的水平来促进骨骼肌细胞对葡萄糖的摄取与利用,达到降低血糖的目的。这些氨基酸的变化可能承载着糖尿病代谢途径变化的重要信息。有研究表明[14]诱导胰岛细胞一氧化氮合酶,抑制胰岛素分泌,是导致糖尿病病人胰腺β细胞的功能障碍和破坏的原因。精氨酸被认为是首选的β-cell功能评估指标[15],其能够明显抑制组织山梨醇的积累、ROS生成处理和PKC激活这三个关键的导致异常高血糖的生化指标。通过氨基的三羧酸循环,能够将氨基酸、葡萄糖和脂质代谢联系在一起。如果机体糖代谢紊乱必然会导致氨基酸的代谢紊乱,而氨基酸代谢紊乱同样会造成糖代谢的紊乱。服用新疆发酵驼乳能够调节氨基酸代谢紊乱,可能是其具有降糖作用的机制之一。
[1]杨宇峰,滕飞,徐娜,等.脾气虚证2型糖尿病大鼠血液代谢组学研究[J].中华中医药杂志,2014,8:74-76.
[2]邢秋玲.血浆部分氨基酸浓度与线粒体基因突变及糖尿病关系的探讨[D].天津:天津医科大学,2006.
[3]马晓丽.基于代谢组学技术的糖尿病特征代谢物及维医证型研究[D].新疆:新疆医科大学,2013.1-164.
[4]Samocha-Bonet D,Wong O,Synnott EL,et al. Glutamine reducespostprandial glycemia and augments the glucagon-like peptide-1response in type 2 diabetes patients[J]. Nutr,2011,141:1233-1238.
[5]Adeva MM,Calvino J,Souto G,et al. Insulin resistance and themetabolism of branched-chain amino acids in humans[J]. Amino Acids,2012,43:171-181.
[6]Garlick PJ. The role of leucine in the regulation of protein metabolism[J].Nutr,2005,135:1553S-1556S.
[7]Zhang Y,Guo K,LeBlanc RE,et al. Increasing dietary leucine intake reduces diet-induced obesity and improves glucose and cholesterol metabolism in mice via multimechanisms[J].
Diabetes,2007,56:1647-1654.
[8]Nairizi A,She P,Vary TC,et al. Leucine supplementation of drinking water does not alter susceptibility to diet-induced obesity in mice[J]. Nutr,2009,139:715-719.
[9]Fahien LA,MacDonald MJ,Kmiotek EH,et al. Regulation of insulin release by factors that also modify glutamate dehydrogenase[J].Biol Chem,1988,263:13610-13614.
[10]新华.那比,韩加,等.新疆传统发酵乳酪乳清制作中乳清的营养成分及抗氧化[J].营养学报,2008,30(2):157-160.
[11]马春燕,新华.那比,刘红梅.哈萨克族传统发酵乳酪中发酵菌的分离鉴定[J].中国乳品工业,2010,(4):7-9.
[12]叶雷,陈庆森,阎亚丽,等.流式细胞术快速检测直投式发酵剂菌体活力[J].食品科学,2014,10:163-168.
[13]何永静.老年糖尿病并发症的临床分析[J].当代医学,2012,31:59-61.
[14]Kato Y,Miura Y,Yamamoto N,et al.Suppressive effects of a selective inducible nitric oxide synthase(iNOS)inhibitor on pancreatic beta-celldysfunction[J].Diabetologia,2003,46(9):1228-33.
[15]Robertson RP,Raymond RH,Lee DS,et al.Arginine is preferred to glucagon for stimulation testing ofβ-cell function[J].Am J Physiol Endocrinol Metab.2014,307(8):E720-7.
Effect of Xinjiang fermented camel milk on serum amino acid metabolism in diabetic rats
LIU Jian-tong1,XIAO Xue-jun2,YU Lan2,Tabusi·Manaer2,Xinhua·Nabi2,*
(1.Xinjiang Medical University,Pharmacology department,Xinjiang Military Area Command Hospital,Urumqi 830011,China;2.Xinjiang Medical University,Pharmacology department,Urumqi 830011,China)
Objective:Using HPLC to study the serum metabolites of antidiabetic diabetes effect of Xinjiang fermented camel milk,and compared the change of the amino acid content of fresh and fermented camel milk. Methods:high sugar and high fat feed eight weeks and injected STZ with 30 mg·kg-1to establish the model of diabetic rats,then the rats were randomly divided into five groups,they were given fermented camel milk low,medium and high dose and Sitagliptin,normal group rats given fresh camel milk. After four weeks of treatment,HPLC to determinate the content of serum free amino acid. Results:Compared with the normal group,model group rats serum aspartic acid,increase the content of phenylalanine,threonine and tyrosine content reduced. Fermented camel milk in middle dose group can reduce the content of aspartic acid,phenylalanine,glycine,arginine content increased. Fermented camel milk in high dose group significantly increased serum levels of arginine. Sitagliptin group can reduce the serum aspartic acid content increased,glycine,arginine,leucine and isoleucine content.Conclusion:fermented camel milk middle and high dose group can decrease the content of diabetes rats serum aspartate and phenylalanine,increase the content of glycine and arginine,adjust the serum amino acid metabolic disorder of diabetes rats.
fermented camel milk;diabetes rat;HPLC;serum amino acid
2015-04-09
刘健彤(1987-),女,硕士,研究方向:心血管药理,E-mail:liujiantong0708@163.com。
*通讯作者:新华·那比(1967-),女,博士,教授,研究方向:心血管药理,E-mail:xinhua99@hotmail.com。
国家自然科学基金(81160344)。
TS201.4
A
1002-0306(2015)23-0339-05
10.13386/j.issn1002-0306.2015.23.062

