海洋细菌Pseudoalteromonasissachenkonii产胞外多糖EPS-PⅡ的发酵工艺优化
郝鲁江,范秋苹,张晓飞,卢晓平,许艳蕊
(齐鲁工业大学山东省微生物工程重点实验室,山东济南 250353)
海洋细菌Pseudoalteromonasissachenkonii产胞外多糖EPS-PⅡ的发酵工艺优化
郝鲁江,范秋苹,张晓飞,卢晓平,许艳蕊
(齐鲁工业大学山东省微生物工程重点实验室,山东济南 250353)
目的:本实验对一株产胞外多糖EPS-PⅡ的海洋细菌Pseudoalteromonasissachenkonii的发酵条件进行优化。方法:采用单因素实验,确定培养基组成,并采用Plackett-Burman联用Box-Behnken设计确定最佳发酵条件。结果:实验确定发酵培养基由葡萄糖,酵母浸膏和海盐组成,发酵条件为培养时间33.8 h,接种量8.8%,摇床转速170 r/min。结论:采用最优发酵条件得出EPS-PⅡ最高产量可达2.62 g/L,比优化前提高了116.5%。
海洋细菌,胞外多糖,单因素实验,Plackett-Burman法,Box-Behnken法
近年来,海洋细菌多糖由于其结构多样性和理化性质独特在海洋生态学、微生物学特别是药学领域受到广泛关注[1-2]。据报道,海洋细菌多糖不仅具有吸湿保湿和抗氧化性,多应用于食品和化妆品行业[3];而且在抗肿瘤、免疫调节和降血糖血脂等方面也显示出特有的生物活性,使其在医药领域具有巨大的应用潜力[4-5]。本实验菌株是由皱纹盘鲍采苗板上分离得到的高产多糖海洋菌株,经鉴定为Pseudoalteromonasissachenkonii(依氏假单胞菌),所产胞外多糖被命名为EPS-PⅡ,由Zobell 2216E培养基摇瓶发酵得其平均产量为1.21 g/L,经实验证明其在吸湿保湿,抗氧化性和吸附重金属离子等方面具有重要功能,本文采用单因素实验和Plackett-Burman联用Box-Behnken设计对海洋细菌产EPS-PⅡ的发酵培养基及发酵条件进行研究,为EPS-PⅡ的进一步扩大发酵和应用奠定基础。
1 材料与方法
1.1 材料与仪器
菌株 由皱纹盘鲍采苗板上分离得到的高产多糖海洋菌株,经鉴定为Pseudoalteromonasissachenkonii(依氏假单胞菌);固体培养基 Zobell 2216E培养基:蛋白胨5 g/L,酵母膏1 g/L,海盐35 g/L,琼脂20 g/L,蒸馏水1 L,调pH至7.6~7.8;种子培养基 Zobell 2216E培养基:蛋白胨5 g/L,酵母膏1 g/L,海盐35 g/L,蒸馏水1 L,调pH至7.6~7.8;浓硫酸、苯酚、葡萄糖、蔗糖、麦芽糖、尿素、硫酸铵、酵母浸粉、牛肉膏,95%乙醇 国产分析纯。
恒温震荡培养箱 上海智诚分析仪器制造有限公司;752型紫外可见分光光度计 上海菁华科技仪器有限公司。
1.2 实验方法
1.2.1 种子液培养 将生长良好的Pseudoalteromonasissachenkonii菌株斜面25 ℃静置活化24 h后接种于50 mL种子培养基中(250 mL三角瓶),30 ℃、100 r/min摇床震荡培养12 h。
1.2.2 摇瓶发酵培养 将上述种子液以10%接种量接入50 mL发酵培养基中(250 mL三角瓶),摇床震荡培养。进行单因素实验时的发酵条件为:30 ℃,150 r/min,48 h。
1.2.3 单因素实验方法 碳源:选取不同种类碳源进行单因素实验[6-8],碳源浓度为30 g/L,蛋白胨为5 g/L,海盐为35 g/L,得到最佳碳源后对其不同浓度添加量进行实验,得到最适碳源浓度;氮源:方法同上;海盐浓度:培养基中添加不同浓度的海盐,葡萄糖为30 g/L,蛋白胨为5 g/L。
1.2.4 Plackett-Burman设计 根据预实验结果,选取对EPS-PⅡ产量影响较大的因素,考察装液量、培养时间、pH、接种量、摇床转速、培养温度,还包括培养基成分碳源,氮源和海盐在内的共9个因素的重要性。每个因素采用高、低两个水平,筛选出影响EPS-P Ⅱ产量的显著因素[9],具体设计方法见表1。

表1 Plackett-Burman设计因素表
1.2.5 Box-Behnken实验设计 根据Plackett-Burman实验得到的显著因素,进一步用Box-Behnken实验设计,设计三个水平,采用Design-Expert 8.05b对数据进行整理分析并得到响应面图形[10-11],具体设计方法见表2。

表2 Box-Behnken实验设计因素表
1.2.6 多糖产量测定方法 苯酚-硫酸法[12]
1.2.7 苯酚硫酸法绘制葡萄糖标准曲线 准确称取标准葡萄糖20 mg定容至500 mL容量瓶中,加水定容。分别吸取0,0.4,0.6,0.8,1.0,1.2,1.4,1.6,1.8 mL葡萄糖溶液,各补水至2.0 mL,然后分别加入1 mL 6%苯酚及5 mL浓硫酸,静置10 min,摇匀,室温放置20 min,以490 nm处测吸光度,以2.0 mL水按同样显色操作做为空白,以葡萄糖质量为横坐标,吸光度为纵坐标绘制标准曲线[12]。
1.2.8 EPS-PⅡ多糖产量测定 发酵液离心去菌体(5000 r/min,20 min),收集上清液并加入4倍体积95%乙醇,充分震荡,4 ℃静置过夜,离心收集沉淀(5000 r/min,20 min)[13-14]。将沉淀用水稀释至适宜浓度,取1 mL,按1.2.6方法测定发酵液中总糖含量。
1.2.9 数据统计分析 采用Excel表格对单因素实验结果作图,得到发酵培养基最优组成,并采用Design-Expert 8.05b对Plackett-Burman和Box-Behnken实验数据进行整理分析,筛选出影响EPS-P Ⅱ产量的显著因素,并得到响应面图形[10-11]。
2 结果与分析
2.1 苯酚-硫酸法绘制得到葡萄糖标准曲线
根据1.2.6方法测得标准曲线,如图1,方程为:y=0.0050x-0.0013,R2=0.9912,拟合度良好。

图1 苯酚-硫酸法标准曲线Fig.1 Standard curve of Phenol sulfuric acid method
2.2 单因素实验确定培养基组成
2.2.1 碳源对EPS-P Ⅱ产量的影响 以多糖EPS-P Ⅱ的产量为标准依据,结果如图2和图3,表明该菌能利用多种碳源,在以葡萄糖为碳源时,EPS-PⅡ产量最高,并得到最适葡萄糖浓度为30 g/L。

图2 不同碳源对多糖产量的影响Fig.2 The influence of different carbon sources on polysaccharide yield

图3 葡萄糖浓度对多糖产量的影响Fig.3 The influence of Glucose levels on polysaccharide yield
2.2.2 氮源对EPS-PⅡ产量的影响 结果如图4和图5,表明该菌株均能利用无机和有机氮源,在以酵母浸膏为氮源时,EPS-PⅡ产量最高,且最适酵母浸膏浓度为4.5 g/L。

图4 不同氮源对多糖产量的影响Fig.4 The influence of different nitrogen sources on polysaccharide yield
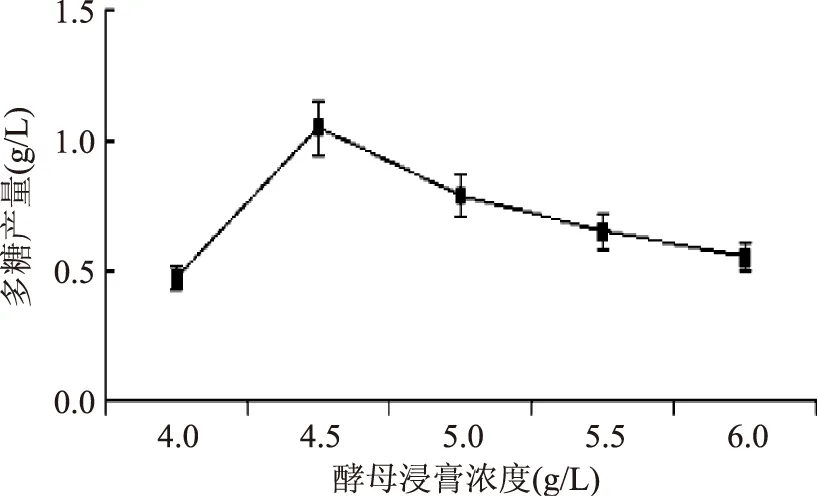
图5 酵母浸膏含量对多糖产量的影响Fig.5 The influence of Yeast extract levels on polysaccharide yield
2.2.3 海盐浓度对EPS-PⅡ产量的影响 结果如图6,发现海盐浓度为35 g/L时,EPS-PⅡ产量最高,海盐浓度升高EPS-PⅡ产量反而出现下降,可能由于海盐浓度升高抑制了菌体生长。
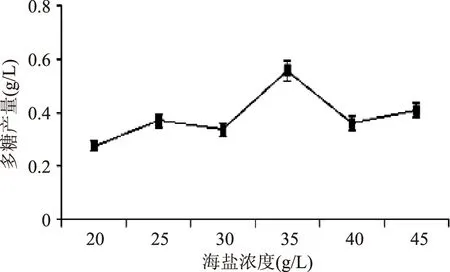
图6 海盐含量对多糖产量的影响Fig.6 The influence of Baysalt levels on polysaccharide yield
2.3 Plackett-Burman设计筛选影响EPS-PⅡ产量的显著因素
Plackett-Burman设计实验结果见表3。使用Design expert 8.05b软件对各因素进行显著性分析,见表4和表5,p<0.05表示差异有显著性。

表3 Plackett-Burman实验设计结果
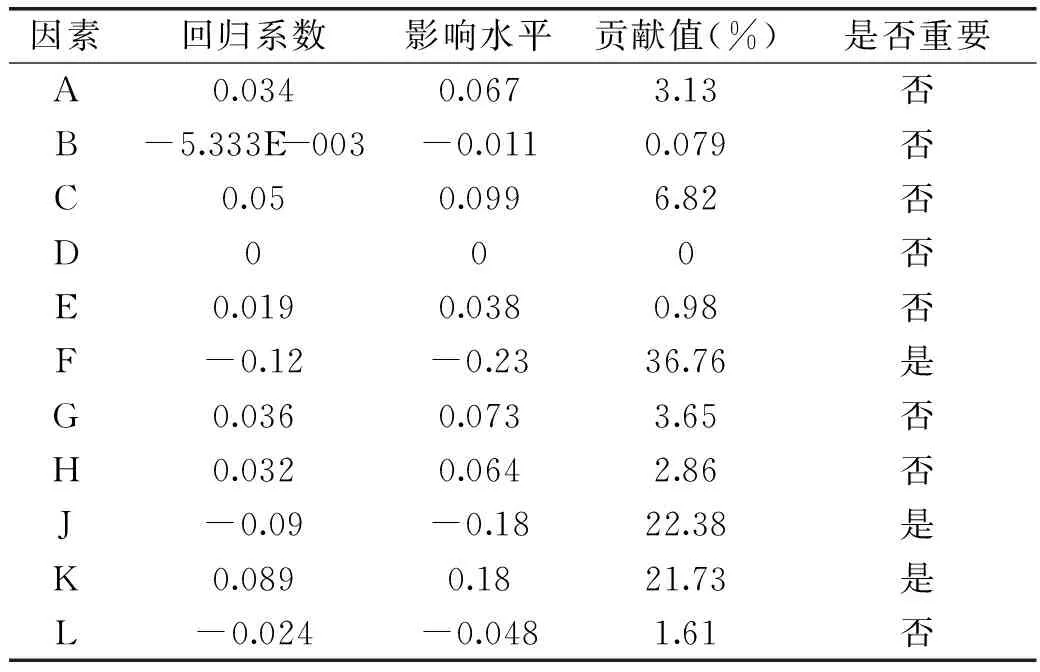
表4 显著性分析
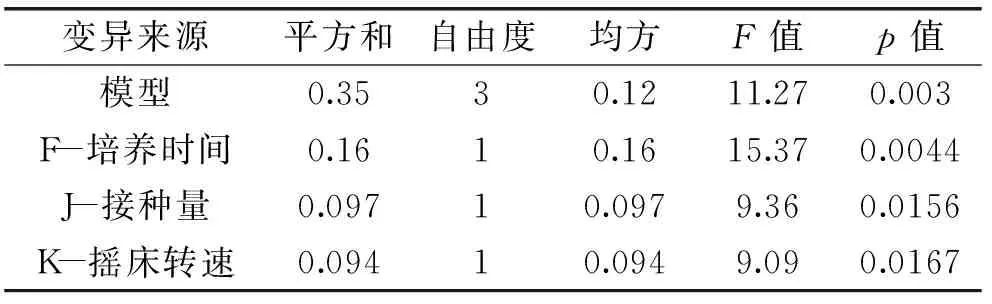
表5 显著性分析结果
由表4各因素对多糖产量的贡献值可以看出,各因素对多糖产量影响的大小顺序为: F>J>K>C>G>A>L>E>B,由表5可知,模型的p<0.05,F、J、K的p值均小于0.05,表明F、J、K对多糖影响显著,且影响顺序为:F(培养时间)>J(接种量)>K(摇床转速)。A、B、C、E、G、L对EPS-PⅡ产量未见显著影响,根据单因素试验和预实验得到的各因素最优水平,作为EPS-PⅡ发酵的最终培养基组成和培养条件,即葡萄糖30 g/L,酵母浸膏4.5 g/L,海盐35 g/L,装液量为40%,pH8,温度选择25 ℃。
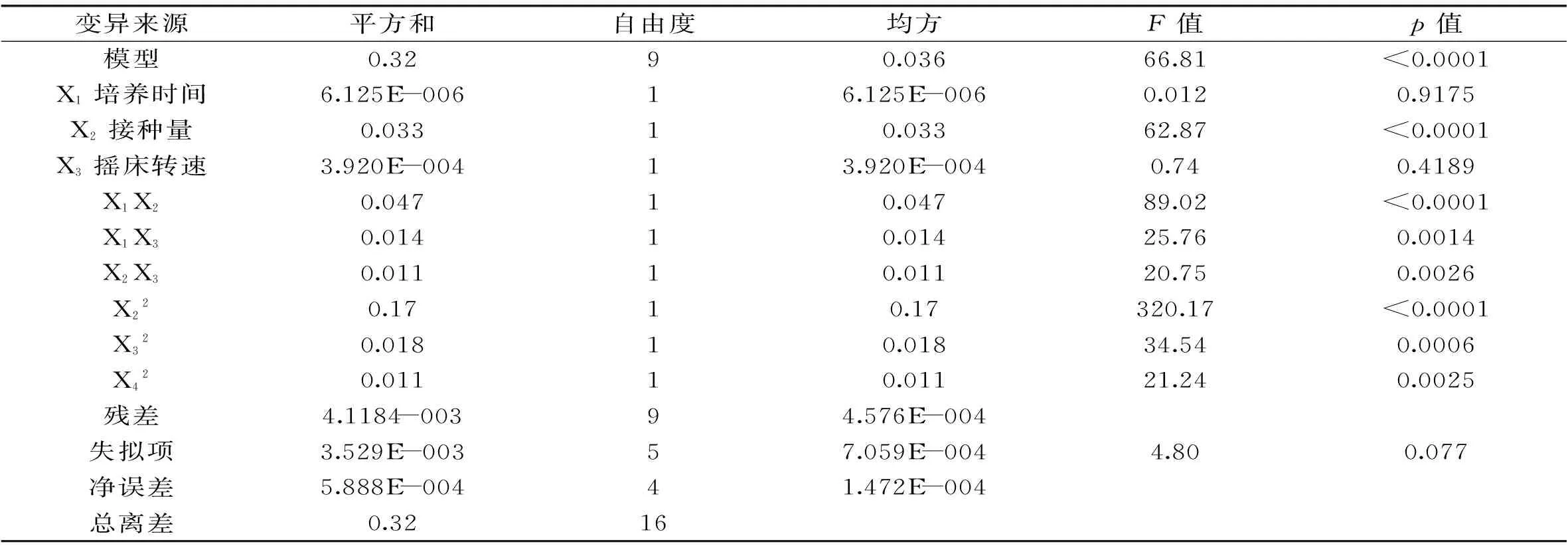
表7 响应面实验方差分析表
注:p<0.05时显著,p<0.001时极显著。
2.4 Box-Behnken实验设计确定最终发酵条件
根据Plackett-Burman实验得到的三个显著因素,进一步用Box-Behnken实验设计,确定各因素的最优水平,表6为实验结果,采用Design-Expert 8.05b对表6数据进行整理分析,得到响应面实验方差分析表,见表7。

表6 Box-Behnken实验设计结果
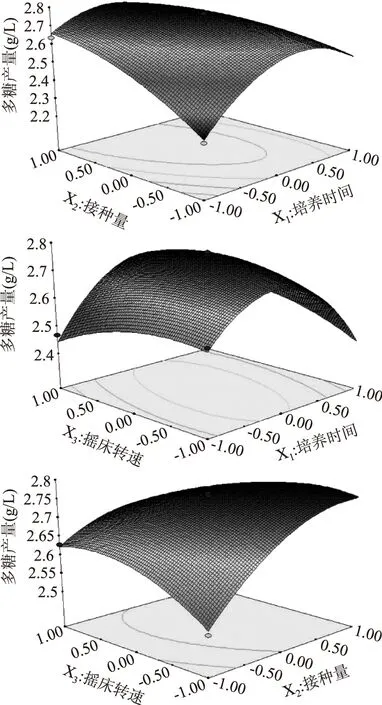
图7 两因素交互作用的响应面图Fig.7 Response surface plots showing the effects of any two factors on the yield of EPS-PⅡ
采用Design-Expert 8.05b对表6数据进行多元拟合,得到拟合方程:多糖产量=2.75+1.007E-003X1+0.065X2+7.058E-003X3-0.11X1X2+0.058X1X3-0.052X2X3-0.20X12-0.066X22-0.052X32。

根据多元回归方程结果,构建两因素交互作用的响应面图(图7),可以看出,X1X2、X1X3和X2X3交互影响极为显著,X2曲线最陡,说明X2对EPS-PⅡ产量的影响最显著,其次是X1和X3,这与表7的分析结果一致[16]。
由该软件分析得到最佳发酵条件为:培养时间33.78 h,接种量8.79%,摇床转速171 r/min,EPS-P Ⅱ最高产量预测值为2.7836 g/L。
2.5 验证实验
为了实验的可操作性,将发酵条件修改为培养时间33.8 h,接种量8.8%,摇床转速170 r/min,采用该条件进行三次平行实验,得到EPS-PⅡ产量平均值为2.62 g/L,预测值与真实值偏差为6.24%,两者具有良好拟合性。
3 结论
本实验采用单因素实验对胞外多糖EPS-PⅡ的发酵培养基进行了优化,获得培养基最佳配比为:30 g/L葡萄糖,4.5 g/L酵母浸膏,35 g/L海盐;并采用Plackett-Burman联用Box-Behnken设计确定了最佳发酵条件为:培养时间33.8 h,接种量8.8%,摇床转速170 r/min,装液量40%,pH8,温度25 ℃。经最优条件发酵后,EPS-PⅡ最高产量可达2.62 g/L,接近预测值,与优化前平均产量1.21 g/L相比,提高了116.5%,说明了该实验方法的有效性,为EPS-PⅡ的进一步扩大发酵和应用提供了一定的参考数据。
[1]孙海红,毛文君,钱叶苗.海洋微生物活性胞外多糖的研究进展[J].海洋科学,2011,35(11):134-138.
[2]张姗姗,王长云,魏晓蕾.海洋微生物胞外多糖结构与生物活性研究进展[J].微生物学通报,2007,34(1):153-156
[3]刘凤,叶淑红,王际辉.海洋假单胞菌pf-6胞外多糖吸湿保湿和抗氧化性研究[J].食品工业科技,2011,32(11):68-71.
[4]Maria Filomena de Jesus Raposo,Rui Manuel Santos Costa de Morais,Alcina Maria Miranda Bernardo de Morais.Bioactivity and Applications of Sulphated Polysaccharides from Marine Microalgae[J].Mar. Drugs,2013,11:233-252.
[5]崔艳红,黄现清.微生物胞外多糖研究进展[J].生物技术通报2006,2:25-29.
[6]王淑军,刘红飞,李华钟.海洋细菌Pseudoalteromonas sp.G23产低温淀粉酶发酵条件的研究[J].中国酿造,2008,23:9-12.
[7]李会,高金卉,窦文芳.大肠杆菌K5多糖生物合成条件的优化[J].南京工业大学学报(自然科学版),2012,34(6):69-73.
[8]刘天华,乔梦,李乐乐.海洋细菌0417产胞外多糖发酵条件的优化[J].中国酿造,2011,6:107-109.
[9]董满良,董小萍,李鸿翔.Plackett-Burman联用Box-Behnken效应面与正交实验优化棘茎楤木总皂苷提取工艺及其比较研究[J].中国药房,2013,24(3):227-230.
[10]冯美琴,邢家溧,张琦,等.植物乳杆菌胞外多糖发酵条件的优化[J].食品科学,2011,32(23):215-219.
[11]吴燕,盛尊来,高凌飞,等.响应面法优化丁香叶总酚酸提取工艺[J].食品工业科技,2015,36(02):286-290.
[12]张惟杰,糖复合物生化研究技术[M].杭州:浙江大学出版社,2006:11-12.
[13]张晓飞,郝鲁江.海洋细菌多糖EPS-1发酵培养基的正交优化及多糖发酵过程的研究[J].食品工业,2012,33(11):41-43.
[14]Stacy A Kimmel,Robert F Roberts,Gregory R Ziegler.Optimization of Exopolysaccharide Production by Lactobacillus delbrueckii subsp. bulgaricus RR Grown in a Semidefined Medium[J].Applied and Environmental Microbiology,1998,64(2):659-664.
[15]董红敏,牛小勇,沈丽雯,等.响应面设计优化川明参蛋白提取工艺[J].食品工业科技,2015,36(02):276-281.
[16]朱素英.基于响应曲面法优化天麻多酚的提取工艺[J].食品工业科技,2015,36(01):268-271.
Optimization of fermentation conditions for exopolysaccharide EPS-PⅡby marine bacteriumPseudoalteromonasissachenkonii
HAO Lu-jiang,FAN Qiu-ping,ZHANG Xiao-fei,LU Xiao-ping,XU Yan-rui
(Shandong Provincial Key Laboratory of Microbial Engineering,Qilu University of Technology,Jinan 250353,China)
Objective:To optimize the fermentation conditions of exopolysaccharide EPS-PⅡproduced byPseudoalteromonasissachenkonii.Method:The medium composition was determined by single factor experiment,Plackett-Burman combined with Box-Behnken was used to determine the optimum fermentation conditions.Results:The experiment showed that the fermentation medium was composed of glucose,yeast extract and baysalt,the fermentation conditions were 8.8% inoculum,170 r/min shaking speed and 33.8 h for fermentation.Conclusion:Under the optimum conditions,the yield of EPS-PⅡwas 2.62 g/L,which was increased by 116.5%.
marine bacterial;exopolysaccharide;single factor experiment;Plackett-Burman method;Box-Behnken method
2015-03-10
郝鲁江(1972-),男,博士研究生,副教授,研究方向:海洋细菌活性物质的筛选、发酵条件的优化及结构和功能,E-mail:lujiang_hao@163.com。
山东省自然科学基金(ZR2012CM019)。
TS201.1
B
1002-0306(2015)23-0256-05
10.13386/j.issn1002-0306.2015.23.044

