PDGF/ROCK通路介导的肌成纤维细胞分化在大鼠矽肺形成中的作用*
张丽娟 李倩 邓海静 张文丽 王小君 裴鑫 郝小惠 李治国杨方
在矽肺形成过程中,被激活的内皮细胞、吞噬二氧化硅的肺泡巨噬细胞等可释放大量的细胞因子(包括转化生长因子-β、血小板源性生长因子等)。转化生长因子-β,血小板源性生长因子(platelet-derived growth factor,PDGF)在矽肺病患者血清中的含量明显升高[1]。肌成纤维细胞是一种超微结构和生理功能介于平滑肌细胞和成纤维细胞之间的高度分化型细胞,特异性表达α-平滑肌肌动蛋白(α-SMA),具有很强的分泌细胞外基质及收缩的功能[2-3]。那么,PDGF能否通过诱导肌成纤维细胞的分化而发挥促矽肺纤维化作用,尚未见文献报道。这将是本研究将要探讨的内容之一。研究表明,PDGF受体-β(PDGFR-β)与配体PDGF结合后,可促使肌动蛋白重排,发挥促有丝分裂、趋化等生理作用,但其具体作用机制仍有待进一步研究[4-5]。已有研究发现,Rho相关卷曲螺旋形成蛋白激酶(Rho-associated coiled-coil-forming protien kinase,ROCK)可通过控制细胞骨架肌动蛋白的排列和细胞收缩调节细胞的黏附、迁徙、增殖和凋亡,在器官纤维化的发生和发展过程中发挥着重要作用[6-7]。以上研究结果提示ROCK通路可能在PDGF促进矽肺纤维化过程中发挥着重要作用。因此本研究又进一步探讨了ROCK通路是否参与了PDGF诱导肌成纤维细胞的分化过程从而在矽肺纤维化发生发展过程中发挥着重要作用。
1 材料与方法
1.1 实验动物 SPF级健康成年雄性 Wistar大鼠40只,体重(180±10)g(北京维通利华动物技术有限公司),于河北联合大学实验动物中心屏障实验室饲养(温度20~26 ℃,湿度50%~70%,昼夜交替,自由饮食进水)。
1.2 材料与试剂 标准α石英粉尘(中国疾病预防控制中心);兔抗大鼠α-SMA、ROCK、phospho-PDGFR-β多克隆抗体(美国Epitomics公司);小鼠抗大鼠Ⅰ型、Ⅲ型胶原单克隆抗体(美国 Sigma公司);兔抗大鼠GAPDH多克隆抗体(美国Santa Cruz公司);羊抗小鼠二抗、羊抗兔二抗、DAB显色试剂盒、BCIP/NBT显色试剂盒(武汉博士德生物有限公司)。
1.3 方法
1.3.1 矽肺动物模型建立 将动物随机分为四组,每组10只,乙醚麻醉后采用非暴露式气管插管,按照实验分组支气管内一次性灌注生理盐水或浓度为50 g/L的生理盐水SiO2混悬液。(1)模型对照4周组:支气管内灌注灭菌生理盐水1.0 mL/只,腹腔内埋入注入生理盐水的微量药物释放泵,4周后处死;(2)模型对照8周组:同模型对照4周组处理后于8周后处死;(3)矽肺模型4周组:支气管内灌注SiO2混悬液1.0 mL/只,腹腔内埋入注入生理盐水的微量药物释放泵,4周后处死;(4)矽肺模型8周组:同矽肺模型4周组处理后于8周后处死。各组动物腹主动脉采血后处死取肺组织并进行形态学观察,右下叶肺组织经多聚甲醛固定后常规石蜡包埋以备免疫组织化学染色,其余肺组织迅速冻于液氮中保存以备Western blot检测[8]。
1.3.2 Western blot法检测大鼠肺组织内α-SMA、phospho-PDGFR-β、ROCK以及Ⅰ型、Ⅲ型胶原蛋白的表达 按照文献[9]的方法提取并测定蛋白浓度后,90 μg/孔上样,SDSPAGE电泳并转膜。采用5%的牛血清白蛋白37 ℃封闭1 h,一抗(phospho-PDGFR-β抗体、Ⅰ型、Ⅲ型胶原抗体1∶1 000稀释;α-SMA抗体、ROCK抗体、GAPDH抗体1∶500稀释),4 ℃孵育过夜;二抗(1:3 000稀释)37 ℃孵育1 h;碱性磷酸酶显色。用图像扫描后以Image J软件对蛋白表达条带进行吸光度(A)值的定量分析,目的蛋白条带A值经内参平衡后,以各组与模型对照4周组的比值作为蛋白相对表达水平。
1.4 统计学处理 数据使用SPSS 13.0软件进行统计分析,计数资料均以(±s)形式描述,进行完全随机设计的单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 肉眼观 模型对照组双肺表面光滑,呈粉红色,弹性良好。矽肺模型组双肺颜色苍白,质地变硬,双肺表面可见散在灰白色结节,分布较均匀。矽肺模型4周组与模型对照组相比,双肺体积增大。而矽肺模型8周组与矽肺模型对照4周组相比,双肺体积缩小。见图1。

图1 各组大鼠肺组织注:A:模型对照4周组;B:模型对照8周组;C:矽肺模型4周组;D:矽肺模型8周组
2.2 phospho-PDGFR-β、ROCK、α-SMA蛋白在肺组织中表达的变化 与模型对照组比较,矽肺模型组phospho-PDGFR-β、ROCK、α-SMA蛋白表达增强,其中矽肺模型4周组phospho-PDGFR-β、ROCK、α-SMA蛋白表达分别为模型对照4周组的3.89倍、2.46倍和1.53倍,矽肺模型8周组phospho-PDGFR-β、ROCK蛋白表达强度分别为模型对照8周组的3.81倍、2.07倍和1.48倍,比较差异均有统计学意义(P<0.05)。见表1、图2。
2.3 肺组织内Ⅰ型与Ⅲ型胶原蛋白表达 与模型对照组比较,矽肺模型组的Ⅰ型与Ⅲ型胶原蛋白表达增强,其中矽肺模型4周组Ⅰ型与Ⅲ型胶原蛋白表达灰度值(OD值)为分别为模型对照4周组的1.73倍1.99倍,矽肺模型8周组Ⅰ型与Ⅲ型胶原蛋白表达强度分别为模型对照8周组的1.97倍和2.02 倍。见表1、图2。

表1 大鼠肺组织内phospho-PDGFR-β、Rock、α-SMA、Ⅰ型与Ⅲ型胶原蛋白的表达(x-±s)
3 讨论
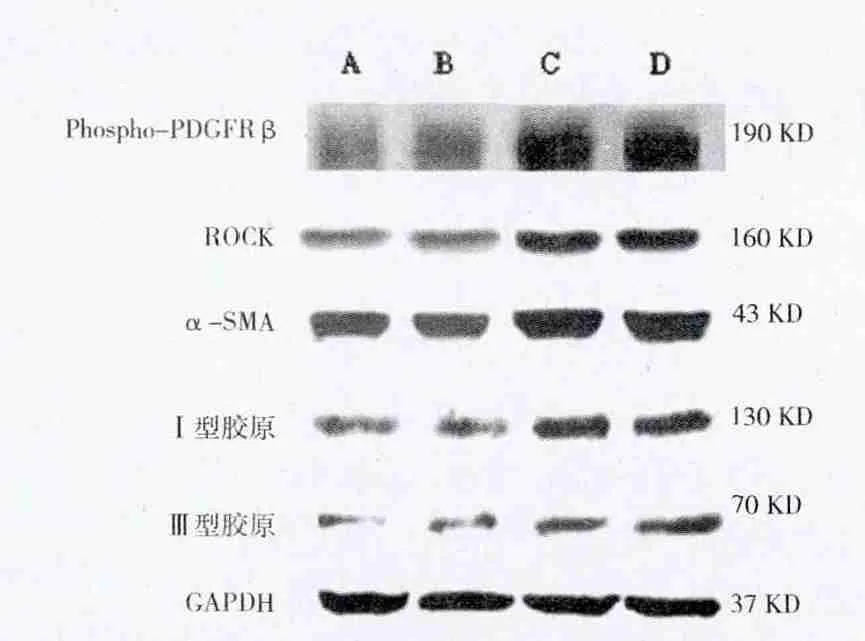
图2 大鼠肺组织内phospho-PDGFR-β、ROCK、α-SMA以及Ⅰ型、Ⅲ型胶原蛋白的表达
目前尘肺病是我国最严重的职业病,2013年尘肺病报告病例数占职业病报告总例数的87.72%,给国家、社会和群众健康带来了极大的危害[10-12]。然而,在尘肺病的治疗方面,目前尚无特效方法。因此,探索尘肺病发病的分子机制以延缓或阻断肺纤维化的发展进程,仍具有重要的实际意义。在矽肺形成过程中,吞噬二氧化硅的肺泡巨噬细胞可释放大量细胞因子(包括TGF-β,PDGF等),其中TGF-β/Smad促进肌成纤维细胞(myofibroblast)转化构成了器官纤维化发病过程中一个较为明确的机制[13-15]。
本研究中,笔者对肺纤维化过程中另一重要的促纤维化因子-PDGF在矽肺纤维化中的中的作用及其机制进行了进一步的探讨。研究中,笔者采用非暴露式气管二氧化硅混悬液灌注法制备大鼠矽肺模型,结果发现矽肺模型组大鼠双肺颜色苍白,质地变硬,双肺表面可见散在灰白色结节。矽肺模4周组与模型对照组相比,双肺体积增大。而矽肺模型8周组与矽肺模型对照4周组相比,双肺体积缩小。表明灌注SiO2粉尘4周后,矽肺模型大鼠肺内已经形成明显的硅结节伴有弥漫性间质纤维化,染尘后8周,模型大鼠肺纤维化程度进一步加重,这符合矽肺的发生、发展特征,表明大鼠矽肺模型制备成功。研究中笔者还进一步观察了phospho-PDGFR-β、ROCK、α-SMA以及Ⅰ型、Ⅲ型胶原蛋白在矽肺模型大鼠肺组织中的表达。结果发现,与相应模型对照组比较,矽肺模型组phospho-PDGFR-β、ROCK蛋白表达增强的同时,α-SMA蛋白表达增强,而肌成纤维细胞特异性表达α-SMA,提示PDGF/ROCK信号通路在肌成纤维细胞分化过程中可能发挥了重要作用。此外,与相应模型对照组比较,矽肺模型组Ⅰ型、Ⅲ型胶原蛋白表达也明显增强,而Ⅰ型、Ⅲ型胶原是构成细胞外基质的主要成分之一,因此Ⅰ型、Ⅲ型胶原蛋白表达的增加也是肺纤维化的重要病理特征—细胞外基质过度沉积的重要表现。以上研究结果提示,PDGF可能通过激活ROCK信号转导通路促进大鼠肌成纤维细胞转化,进而促进矽肺大鼠肺组织内胶原的合成,从而在肺纤维化形成过程中发挥了重要作用。
肺纤维化是一个复杂的病理生理过程的结局,是复杂的细胞因子网络相互作用导致细胞外基质合成与降解的动态平衡被打破的结果,因此,对于PDGF/ROCK通路是否在促进胶原合成的同时也影响了胶原的降解,以及不同的细胞因子在矽肺纤维化形成过程中的相互作用仍将需进一步研究探讨。
[1]姚武,冯斐斐,焦洁,等.TGF-B1、PDGF、CTGF在尘肺病患者血清中的表达水平变化及意义[J].四川大学学报(医学版),2006,30(5):754-756.
[2]Fausther M,Dranoff J A.Integrins myofibroblasts,and organ fibrosis[J].Hepatology,2014,60(2):756-758.
[3]孙艳,刘君,邓爱军.1-磷酸鞘氨醇对体外培养的人视网膜色素上皮细胞α-SMA表达的影响[J].中国医学创新,2010,7(20):6-7.
[4]李代洪,艾俊涛,谢欣,等.血小板衍生生长因子受体 (PDGFR)抑制剂的研究进展[J].肿瘤药学,2013,3(1):2-6.
[5]Singh V,Jaini R,Torricelli A A,et al.TGFβ and PDGF-B signaling blockade inhibits myofibroblast development from both bone marrowderived and keratocyte-derived precursor cells in vivo[J].Exp Eye Res,2014,121:35-40.
[6]柳飞,付平.RhoA/Rho相关卷曲螺旋形成的蛋白激酶信号通路与慢性肾脏疾病[J].华西医学,2011,26(5):781-783.
[7]Hu Y B,Li X,Liang G N,et al.Roles of Rho/Rock signaling pathway in silica-induced epithelial-mesenchymal transition in human bronchial epithelial cells[J].Biomed Environ Sci,2013,26(7):571-576.
[8]闫静波,张丽娟,李倩,等.N-乙酰基-丝氨酰-天门冬酰-赖氨酰-脯氨酸抗大鼠矽肺纤维化的实验研究[J].中华劳动卫生职业病杂志,2008,26(7):401-405.
[9]杨方,吉子言,李丹丹,等.TGF-β1介导 Smad通路调节在大鼠矽肺纤维化形成中的作用[J].现代预防医学,2011,38(23):4930-4932.
[10]中国疾病预防控制中心.2013年全国职业病报告情况报告 .http://www.chinacdc.cn/mtdx/cn/mtdx/wdwsdxgbd/201407/t20140701_98951.htm.2014-07-01.
[11]林玲,王晶,段晓静.104例矽肺合并症的临床分析[J].中国医学创新,2012,9(24):133-134.
[12]李永斌.50例高龄矽肺患者肺通气功能及病情分析[J].中外医学研究,2011,9(26):40-41.
[13]Park I H,Park S J,Cho J S,et al.Effect of simvastatin on transforming growth factor beta-1-induced myofibroblast differentiation and collagen production in nasal polyp-derived fibroblasts[J].Am J Rhinol Allergy,2012,26(1):7-11.
[14]于天水,官大威,马勇,等.肌成纤维细胞在纤维化疾病中的研究进展[J].中国组织化学与细胞化学杂志,2013,2(2):167-171.
[15]Manickam N,Patel M,Griendling K K,et al.RhoA/Rho kinase mediates TGF-β1-induced kidney myofibroblast activation through Poldip2/Nox4-derived reactive oxygen species[J].Am J Physiol Renal Physiol,2014,307(2):159-171.

