流感泰得在小鼠体内抗H1N1型FM1株流感病毒活性研究
李庆军,张波,夏燕平,王升启,杨静
1.河南中医学院 药学院,河南 郑州 450008;2.军事医学科学院 放射与辐射医学研究所,北京 100850;
3.北京协和医院 药剂科,北京 100730
流行性感冒(流感)是由流感病毒引起的急性呼吸道传染病,可借助空气迅速传播,在世界范围多次暴发流行,严重威胁人类健康。甲型流感病毒根据其血凝素(HA)和神经氨酸酶(NA)的不同,可分为16个HA亚型和9个NA亚型,它们可以通过抗原漂移或抗原转换形成新的亚型,从而引起流感大流行,例如2009年的甲型H1N1流感病毒及2013年的H7N9流感病毒,都是重组的新型流感病毒[1-3]。流感病毒抗原不断变化导致疫苗的预防效果大大降低;同时,常用的抗流感病毒药物均出现不同程度的耐药[4-6],使得寻找新的抗流感病毒药物尤为迫切。反义寡核苷酸药物因其独特的作用机制,为病毒感染性疾病、肿瘤、心血管疾病等传统药物难以应对的疾病带来了新的希望。自1998年首个反义核酸类药物福米韦生上市以来,目前已有3个反义核酸药物上市,多个核酸药物进入临床阶段[7]。流感泰得(Flutide,FT)是本实验室以流感病毒vRNA 5'端具有调控作用的保守序列为靶点设计筛选得到的一条硫代反义寡核苷酸,在体内外对多个亚型流感病毒有抑制作用[8-10],但对于H1N1型流感病毒FM1株的体内抗病毒活性尚没有文献报道。本实验旨在通过流感病毒感染的小鼠模型综合评价流感泰得体内抗H1N1型FM1株流感病毒活性。
1 材料与方法
1.1 材料
BALB/c雄性小鼠,17~19 g,购自北京市维通利华实验动物有限公司,动物许可证号SCXK(京)2012-0001,适应性饲养3 d后进行相关实验;流感病毒鼠肺适应株A/FM/1/47(H1N1)为本实验室保存,接种于9日龄SPF级鸡胚,48 h后收取鸡胚尿囊液,6000 r/min离心15 min,收集上清分装,于-70˚C保存;流感泰得(碱基序列:5'-CCTTGTTTCTACT-3',全硫代修饰,批号:20100707-4,HPLC 纯度为95.9%)为本实验制备;阳性对照药磷酸奥司他韦来自购自豪夫迈·罗氏有限公司(批号:0709001),临用前配置成10 mg/ml浓度;戊巴比妥钠购自Sigma-Al⁃drich公司(批号:090205);病毒RNA提取试剂盒(DP315)和Quant One Step qRT-PCR(Probe)Kit检测试剂盒(KR113)购自北京天根有限公司;1348-2型生物安全柜购自Thermo Forma Sciencefic公司;3-18K型低温高速离心机购自Sigma公司;CFX960型荧光定量PCR仪购自Bio-Rad公司。
1.2 流感泰得对流感病毒小鼠的保护实验
实验动物随机分为正常对照组、病毒对照组、磷酸奥司他韦10 mg/kg组,及流感泰得2.5、5、10 mg/kg组,戊巴比妥钠完全麻醉5 min后滴鼻给药,24 h后再次麻醉并给药。流感病毒于冰上解冻后,用4℃冷藏的生理盐水稀释为每20 μL含5倍LD50的稀释液。第二次给药1 h后滴鼻造模。给药或给毒时动作应轻缓,避免小鼠喷出病毒液或药液。攻毒后连续观察14 d,观察小鼠存活状况,统计小鼠死亡情况和体重变化,计算平均存活天数。
1.3 肺指数的测定和肺脏病毒RNA拷贝数的测定
按上述方法分组后给药和攻毒,于攻毒后第5 d每组随机取出3只称重并麻醉,取肺脏,清除残余血液,用滤纸吸去多余的生理盐水并称重,按下式计算肺指数,将肺组织置于-70℃保存,用于病毒滴度检测。
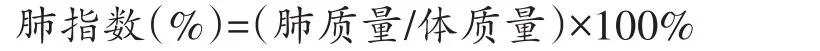
用病毒RNA试剂盒提取小鼠肺组织中的流感病毒RNA,通过荧光定量PCR检测病毒RNA拷贝数。目标片段为M1基因,其上游引物为5'-GACC AATCCTGTCACCTCTGAC-3',下游引物为5'-AGG GCATTATGGACAAAGCGTCTA-3'),探 针 为 5'-FAM-TGCAGTCCTCGCTCACTGGGCACG-BHQ1-3',为本实验室合成。反应条件:50℃ 30 min,92℃2 min,然后以92℃ 15 s、55℃ 20 s、68℃ 30 s进行40个循环。
2 结果
2.1 流感泰得对流感病毒感染小鼠的保护作用
结果见表1。病毒对照组小鼠14 d存活率为0,流感泰得 2.5、5、10 mg/kg 组小鼠存活率分别为50%、90%和66.7%,阳性药组存活率为77.8%,流感泰得各组均显著提高了模型小鼠的存活率。同时,流感泰得各剂量组和阳性药组均不同程度地减缓了病毒感染引起的小鼠体重下降,延长了小鼠存活天数(图1、2)。病毒对照组小鼠平均存活天数为6.70 d,流感泰得 2.5、5、10 mg/kg 组小鼠存活天数为10.30、13.30和11.56 d,阳性药组小鼠平均存活天数为12.44 d,与病毒对照组比,均具有显著性差异(P<0.01)。
2.2 流感泰得对流感病毒感染小鼠肺指数和肺脏病毒滴度的影响
流感病毒感染可引起小鼠病毒性肺炎,从而导致肺指数升高,通常以肺指数的大小表示肺脏炎症的严重程度。结果显示(表2),与正常组相比,病毒对照组肺指数显著升高(P<0.01);与病毒组相比,阳性药组显著降低了小鼠肺指数(P<0.01)和肺脏病毒滴度(P<0.001),流感泰得2.5、5、10 mg/kg组均显著降低了流感病毒感染小鼠的肺指数和肺脏病毒滴度(P<0.05,P<0.01,P<0.001)。

表1 流感泰得对流感病毒感染小鼠的死亡保护作用

图1 流感泰得对流感病毒感染小鼠体重变化的影响

图2 流感泰得对流感病毒感染小鼠存活率的影响

表2 流感泰得对肺指数和肺脏病毒滴度的影响
3 讨论
流感是全球公共卫生的重大威胁,近年来流感频繁暴发。据世界卫生组织统计,每年北半球约1亿人感染流感,造成的经济损失超过100亿美元[11]。我国由于人口密度高、人群流动性大,也成为历次流感暴发的重灾区。所以,研制新型有效的抗流感病毒药物具有重大的社会效益和经济效益。前期实验结果表明,流感泰得对A/京防/86-1(H1N1)、A/沪防/93-9(H3N2)等多个流感病毒毒株具有抑制作用。同时,滴鼻给药可将药物直接送达肺部,药代动力学结果表明滴鼻给药时流感泰得在肺组织中的浓度比静脉给药更高,半衰期更长,绝对生物利用度也有很大提高[12]。
通过动物实验探讨流感泰得的抗流感病毒作用,可以从整体水平反映其抗病毒活性。本实验中,我们用流感病毒感染的小鼠肺炎模型,以存活率、体重变化、平均存活天数、肺指数、肺脏病毒滴度为指标,研究流感泰得体内抗H1N1型FM1株流感病毒的活性。结果显示,与模型组相比,流感泰得各组显著提高了小鼠存活率,对流感病毒引起的小鼠的体重下降和肺指数升高也有明显改善;与病毒对照组相比,给药各组肺脏病毒滴度显著降低。这些结果显示流感泰得具有较好的体内抗H1N1型FM1株流感病毒活性。
[1] 王大燕,高荣保,李晓丹,等.甲型H1N1流感病毒快速核酸检测技术的建立[J].病毒学报,2009,25(增刊):1-3.
[2] 谢剑锋,沈晓娜,王美爱,等.福建省甲型H1N1流感病毒分离及首例分离株全基因组序列分析[J].中国人兽共患病学报,2009,25(8):745-748.
[3] Liu D,Shi W,Shi Y,et al.Origin and diversity of novel avi⁃an influenza A H7N9 viruses causing human infection:phyloge⁃netic,structural,and coalescent analyses[J].Lancet,2013,381(9881):1926-1932.
[4] Bright R A,Shay D K,Shu B,et al.Adamantane re-sis⁃tance among influenza A viruses isolated early dur-ing the 2005-2006 influenza season in the United States[J].JAMA,2006,295(8):891-894.
[5] Ujike M,Shimabukuro K,Mochizuki K,et al.Oseltamivir-re⁃sistant influenza A(H1N1)viruses during 2007-2009 influenza⁃seasons,Japan[J].Emerg Infect Dis,2010,16(6):926-935.
[6] Rowe T,Banner D,Farooqui A,et al.In vivo ribavirin activi⁃tyagainstseverepandemicH1N1 influenzaA/Mexico/4108/2009[J].J Gen Virol,2010,91(12):2898-2906.
[7]CrookeS T,Vitravene-another piece in the mosaic[J].Anti⁃sense Nucleic Acid Drug Dev,1998,8:7-8.
[8] Duan M,Zhou Z,Lin R X,et al.In vitro and in vivo protec⁃tion against the highly pathogenic H5N1 influenza virus by an antisense phosphorothioate oligonucleotide[J].Antiviral Ther,2008,13(1):109-114.
[9]陈忠斌,王升启,孙志贤,等.反义寡核苷酸体外抗流感病毒活性[J].微生物学报,2000,40(5):482-487.
[10]陈忠斌,王升启,朱宝珍,等.硫代反义寡核苷酸在细胞培养内抗甲型流感病毒活性[J].病毒学报,1998,14(3):193-198.
[11]徐颂,贺星,田红,等.抗流感病毒药物研究进展[J].现代药物与临床,2009,24(2):65-70.
[12]鲁丹丹.硫代反义寡核苷酸药物的临床前药代动力学研究[D].北京:军事医学科学院,2007:49-61.

