STR试剂盒在快速数据库建设中的应用
刘亚举,张俊涛,金海英
·法医学·
STR试剂盒在快速数据库建设中的应用
Application of Direct and Rapid PCR Amplification Kit of STR in DNA Database
刘亚举1,张俊涛2,金海英3
目的 评价STRtyper-21G Plus试剂盒在DNA数据库建设中的应用。方法 针对各种纸质血样本特性,优化扩增体系和引物量、样本的取样量及循环次数,缩短PCR扩增时间,以建立适合批量样本直接快速扩增检验的方法,将其应用于2 000份数据库样本的检验中,并与PowerPlex®21试剂盒进行比较。结果 采用10 μL扩增体系时,得到了STRtyper-21G Plus试剂盒批量样本检验的最适取样量和扩增循环次数,建立了快速扩增反应程序,2 000份样本的直接快速扩增检验成功率为98.7%,批量检验92份样本(1个96孔板) 从取样到电泳结束只需5 h;PowerPlex®21试剂盒分别为98.1%和6 h。结论 STRtyper-21G Plus试剂盒的应用,省去样本DNA提取过程,操作方法简单、快速,获得信息量大,适用于DNA数据库建设的需要。
法医物证学;直接快速扩增法;STRtyper-21G Plus试剂盒;DNA数据库
在众多STR基因座中,以突变率低、多态性较好、易于标准化等优点的基因座在法医DNA分析中被优先采用,其中遗传多态性要满足DP>0.9、H>0.7[1]。作者对河南汉族50余个STR基因座遗传多态性进行了调查[2-4],在衔接法庭科学DNA数据库发展的基础上,筛选了适合DNA数据库建设应用的STR基因座。本文主要探讨这些STR基因座所建立的直接复合扩增体系在快速数据库建设中的应用。
1 材料与方法
1.1 样本 本实验室建库血样2 000份。其中FTA卡样本500份、普通滤纸样本500份、公安部物证鉴定中心研制的采集卡样本500份、武汉骥腾公司研制的采集卡样本500份。
1.2 主要试剂与仪器 BSD-QP型打孔机(BSD公司,澳大利亚);Hamilton STAR-LET自动化工作站(AusBio公司,瑞士);9700型PCR扩增仪和3500XL型遗传分析仪、ID-X分析软件(AB公司,美国);GeneMarker®HID分析软件(SoftGenetics公司,美国);IDproof分析软件(Qiagen公司,德国)。STRtyper-21G Plus试剂盒(宁波海尔施基因科技有限公司)和PowerPlex®21试剂盒(Promega公司,美国)。
1.3 优化PCR扩增条件 扩增体系和引物量:采用5、10、25 μL扩增体系和2×、4×、10×引物量对1 ng 9947A标准品分别进行检验并重复1次。不同纸质载体的取样量及循环次数:随机抽取FTA血卡、血滤纸、公安血液采集卡、武汉血液采集卡样本各100份,各样本按直径0.5 mm和1.0 mm分别取样。采用10 μL PCR反应体系,其中Master Mix(包含TritonX-100、Mg2+、dNTP、Betaine、Tween20和HS-Taq聚合酶)5.0 μL,Primer Set 2.5 μL,纯水2.5 μL。PCR反应程序为:95℃ 10 min;94℃ 20 s,61℃ 1 min,70℃ 1 min;60℃ 30 min;4℃保温;循环次数设置为24、26、28、30、32 次。快速扩增体系及程序:优化Master Mix配制,按照上述体系用量配比PCR反应液,同时改变变性、退火、延伸时间,PCR扩增反应程序见表1。
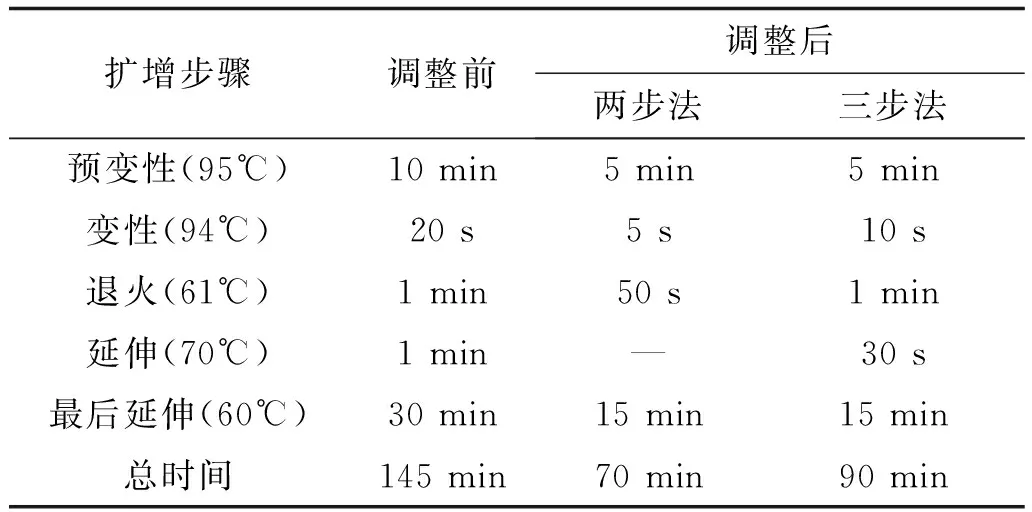
表1 快速PCR扩增反应程序
1.4 批量样本的取样与快速扩增 2 000份样本,按照前述方法取样,96孔板样品孔中待测样本92份,设置阴性和阳性,H6、F12孔空置( 用于电泳时加Ladder),按照表1程序进行PCR扩增。2 000份样本,按照PowerPlex®21试剂盒说明书打取血样和进行PCR扩增。
1.5 电泳检测与分型分析 取1.0 μL上述PCR扩增产物与0.5 μL内标和8.5 μL去离子甲酰胺混合;H6和F12孔内加入Ladder 1.0 μL。置3500XL型遗传分析仪上全自动毛细管电泳,结果用GeneMarker®HID或IDproof分析软件进行等位基因分型,并采用GeneMapperID-X分析软件复核分析。全部基因座检出STR分型界定为成功。
2 结果
2.1 方法验证结果
2.1.1 扩增体系 应用不同体系进行扩增,分型结果一致,未出现等位基因丢失和非特异峰等情况,部分基因座出现的stutter峰均在主峰的10%以下,空白对照样本正常。随着扩增体积减小,峰值(rfu) 有增强的趋势,5 μL体系在2 000~20 000之间,10 μL体系在2 500~10 000之间;25 μL体系在700~6 000之间(图1)。比较显示,在标准体系(10 μL)下,获得的图谱均衡性最好。
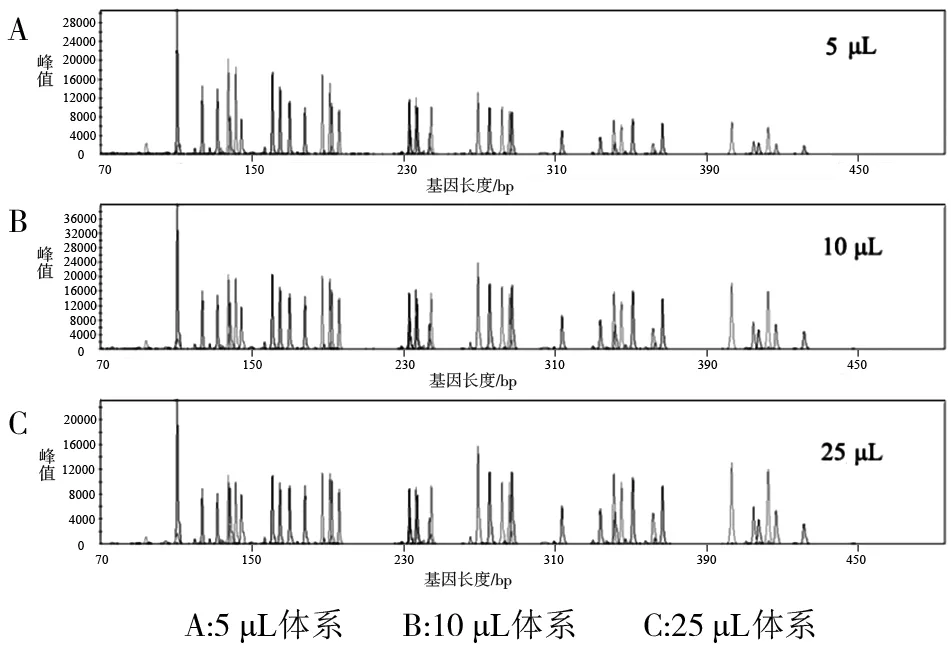
图1 不同扩增体系检测结果
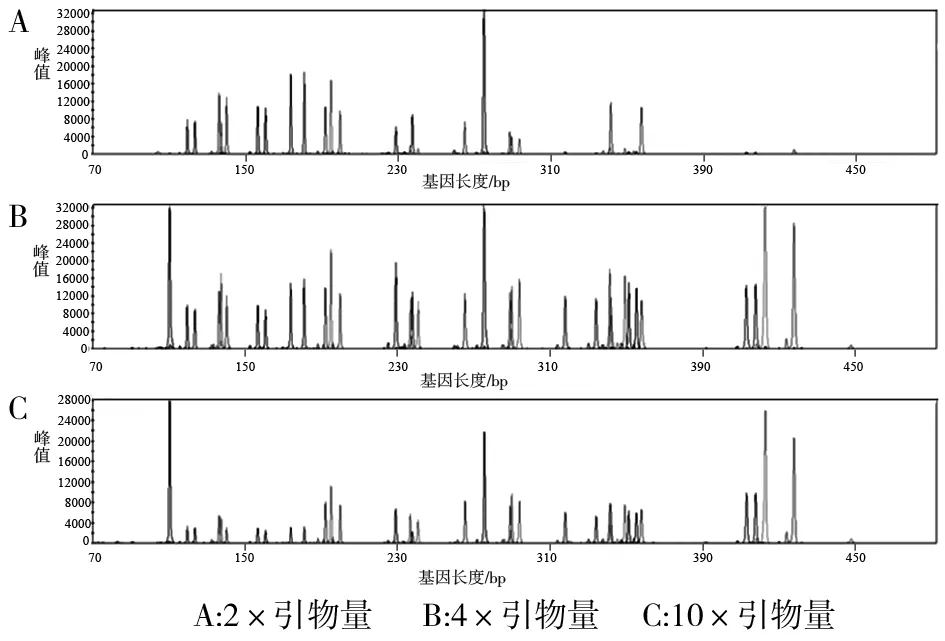
图2 不同引物量检测结果
2.1.2 引物量 应用不同引物量进行扩增,分型结果一致,未出现等位基因丢失的现象。峰值(rfu)范围,2×引物量在200~3 000之间,4×引物用量在600~10 000之间,10×引物用量在1 0000~3 0000之间。分型图谱均未出现非特异峰,部分基因座出现的stutter峰均在主峰的10%以下(图2)。比较显示,4×引物量条件下,平均峰值最高。
2.2 PCR扩增条件优化后的结果
2.2.1 取样量 FTA血卡取样直径为1.0 mm时,出现大片段丢失等情况,获得完整分型的成功率较低;取样直径为0.5 mm时,检出(全部基因型)成功率为98.2%。血滤纸、公安血液采集卡和武汉血液采集卡取样直径为1.0 mm时,检出(全部基因型)成功率为99.6%;取样直径为0.5 mm时,大部分样本出现等位基因丢失现象。因此,使用10 μL扩增体系时,FTA血卡取样直径应为0.5 mm,而血滤纸、公安血液采集卡和武汉血液采集卡取样直径应为1.0 mm。
2.2.2 循环次数 随扩增循环次数的递增,荧光检测信号逐渐增强。循环24、26次,荧光信号检测均值较低,部分基因座在100 rfu以下,且部分基因座扩增不完全;循环28、30、32次,扩增均得到分型一致的结果,未出现等位基因丢失的情况,峰值(rfu)分别为700~5 000、1 000~12 000、3 000~30 000,部分基因座出现的stutter峰均在主峰的10% 以下(图3) 。由于循环30次以上时产物量较大,容易产生渗透峰,最终确定样本质量较好时,采用27或28次循环,样本质量较差时,可增加循环参数至29或30 次。
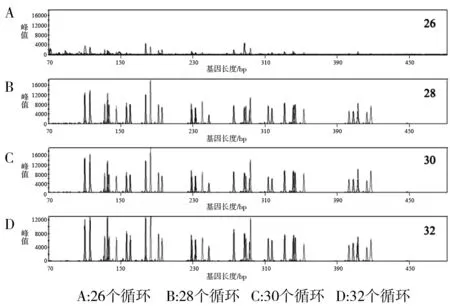
图3 不同循环次数检测结果
2.2.3 快速扩增检验 应用快速扩增反应获得的STR分型结果,峰值(rfu)均值在800~10 000之间,各基因座扩增结果均衡性较好,无明显非特异性扩增(图4)。两步法和三步法快速扩增反应,循环29次其峰值(rfu)均值在1 000~20 000之间(图5)。
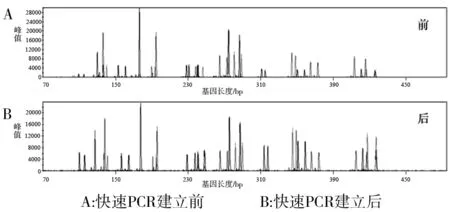
图4 快速扩增反应程序建立前后的电泳图谱
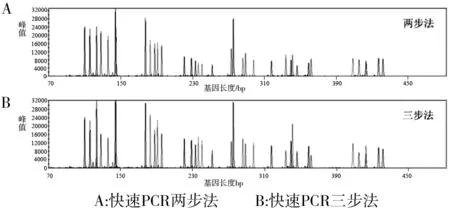
图5 快速扩增反应程序两步法和三步法的电泳图谱
2.3 批量样本检验结果 使用STRtyper-21G Plus试剂盒,采用本文优化方法进行快速扩增反应,结果均获得了良好的分型结果,并与PowerPlex®21试剂盒分型一致,其一次检出成功率为98.7%,批量检验92份样本(1个96孔板) 从取样到电泳结束只需5 h;而PowerPlex®21试剂盒分别为98.1%和6 h。由于allelic ladder以外的等位基因都必须进行人工识别,表2为两个试剂盒基因座allelic ladder及bin的数量。STRtyper-21G Plus试剂盒在有些基因座会标注为off-ladder(OL),而PowerPlex®21试剂盒自动标注等位基因(图6)。

表2 两个试剂盒allelic ladder及bin数量

图6 D21S11基因座在两个试剂盒中的标注
3 讨论
STRtyper-21G Plus试剂盒和PowerPlex®21试剂盒一样,包含21个基因座(20个STR基因座和1个Amelogenin性别基因),20个STR基因座[2-3]累积个体识别率(CDP)为1-7.6841×10-25,二联体累积非父排除率(CPEduo)为1-4.2719×10-6,三联体累积非父排除率(CPEtrio)为1~2.1079×10-9,与GlobalFiler试剂盒全部21个STR基因座的遗传学参数相当[3],满足法医DNA检验要求。同时,STRtyper-21G Plus试剂盒可直接扩增各种纸质载体样本,不仅省去DNA提取环节,而且可以有效防止污染,使操作更为简单。可直接扩增检验与以下因素有关:①Buffer中包含的TritonX-100等细胞裂解剂成分,能够起到裂解细胞释放DNA 的作用[5-7];②反应缓冲液中加入了Betaine、Tween20等PCR增强剂,可以抵抗血色素等的抑制作用[6-7];③特效的HS-Taq聚合酶对血红素、腐殖酸等抑制物的耐受性更强。
采用直接扩增方法,取样直径和PCR循环次数等主观因素对检测结果影响较大。本文结果显示,在成功STR分型的前提下,应尽量减少取样量和循环次数,以减少体系中PCR抑制物的含量和降低高浓度产物所产生的渗透峰对判型的影响。对于FTA卡等纸质较厚的采血卡,选择0.5 mm和27/28次循环;对于较薄的采血卡,则选择1.0 mm和27/28 次循环为宜;如果样本质量较差或保存时间较长,可适当增加取样量和循环次数(29/30次)。为了达到快速检验,本文通过优化程序使PCR反应时间为70 min(两步法)和90 min(三步法),在同等取样直径和PCR循环次数的情况下,两步法和三步法的检验结果无差别,批量检验92份样本(1个96孔板) 的时间在5 h内(取样30 min、PCR扩增70~90 min、电泳160 min、其他20 min),满足DNA数据库大规模样本快速检测的要求。
STRtyper-21G Plus与PowerPlex®21试剂盒包含的21个基因座一样,但PowerPlex®21试剂盒的allelic ladder优于STRtyper-21G Plus。而Bin是通过分析同一个基因座在人群中所有等位基因的片段大小,输入标准数据并由软件生成类似于allelic ladder的虚拟分型标准物,因此bin在没有allelic ladder时可作为分型的标准。更多的allelic ladder及bin可以为基因分型分析提供更全面的参照。如图6所示,当基因座D21S11分型存在微变异时,由于PowerPlex®21存在30.3的虚拟bin,软件分析后自动标注为30.3,而STRtyper-21G Plus只能标注为off-ladder,需要后期人工识别。因此,在国产化的试剂盒中,STR基因座要设计符合中国人群的allelic ladder和bin,如Penta E基因座在欧洲人群检测的等位基因数量明显少于亚洲人群[8],所以STRtyper-21G Plus与PowerPlex®21试剂盒的allelic ladder均为5~24,但STRtyper-21G Plus试剂盒的bin为4~28,而PowerPlex®21试剂盒为4~25。为提高allelic ladder分型的正确率,不要将其采用同一个毛细管电泳(即放在1个96孔板的不同位置,如6H和12F);同时为了防止引物设计不同而使分析软件错误分型[9-10],一般先用一种软件(如GeneMarker®HID或IDproof)分析,再用另外一种软件(如GeneMapperID-X)复核分析,无误后再输入DNA数据库。总之,使用国产STR试剂盒进行DNA检验,一定要确定off-ladder的位置(ladder之内、ladder之外size之内或是size之外),切不可盲目标记。
综上,STRtyper-21G Plus试剂盒分型结果准确,提高了系统检测效能,采用本文优化方法用于纸质血样的批量检验,不仅减少了操作流程和污染机会,而且具有较高的成功率和较好的稳定性、均一性,适合于DNA数据库纸质血样的快速批量检验。
[1] Gill P.A new method of STR interpretation using inferential logic development of a criminal intelligence database[J].Int J Legal Med,1996,109(1):14-22.
[2] 刘亚举,郭利红,史绍杏,等.河南汉族人群39个STR基因座遗传多态性[J].法医学杂志,2014,30(3):217-220.
[3] 刘亚举,史绍杏,郭利红,等.河南汉族人群21个STR基因座遗传多态性[J].中国法医学杂志,2014,29(4):367-369.
[4] 刘亚举,孙现锋,薛小琦,等.河南汉族人群7个STR基因座遗传多态性[J].中国法医学杂志,2014,29(3):262-263.
[5] Wang De Y, Chang C W, Lagacé R E, et al.Developmental validation of the AmpFLSTR®Identifiler®Plus PCR amplification kit[J].J Forensic Sci,2012,57(2):453-465.
[6] 赵兴春,姜伯玮,季安全,等.荧光STR直接复合扩增试剂缓冲体系的研制[J].中国法医学杂志,2012,27(5):359-363.
[7] 刘琳,项林平,胡志敏,等.FTA卡血样快速直接PCR扩增方法比较初探[J].中国法医学杂志,2014,29(3):191-193.
[8] John W P,Thomas M R,Christopher M K,et al.Distribution of Penta B, Penta C, and Penta E alleles in Asian, Black, Caucasian, and Hispanic populations[J].J Forensic Sci, 2005, 50(4):1-3.
[9] 苑美青,凃政,李万水,等.光谱校准异常导致STR分型误判1例[J].刑事技术,2009,34(5):49-51.
[10]王琴,王东京.STR图谱分析中的问题及对策[J].刑事技术,2013,38(6):59-60.
2015-01-23
1.许昌市公安局刑事科学技术研究所,河南许昌 461000 2.襄城县公安局刑侦大队,河南襄城 461700 3.宁波海尔施基因科技有限公司,浙江宁波315000
刘亚举(1978-),男,河南襄城人,副主任法医师,从事DNA检验及法医遗传学统计工作。
DF795.2
B
1672-688X(2015)02-0142-04

