栀子中有效成分对A549细胞XOD活性及其mRNA表达的影响研究※
● 朱继孝 李雪溦 曾金祥 罗光明 朱玉野 王晓云
栀子中有效成分对A549细胞XOD活性及其mRNA表达的影响研究※
● 朱继孝*李雪溦 曾金祥 罗光明 朱玉野 王晓云
目的:研究栀子中有效成分对A549细胞黄嘌呤氧化酶(XOD)活性及其mRNA表达的影响。方法:选择栀子中5个化合物(栀子苷、西红花苷-I、西红花苷-II、山栀苷甲酯和去乙酰车前草酸甲酯),研究其对A549细胞体内XOD活性的抑制作用,并采用RT-PCR检测别嘌呤醇、栀子苷和西红花苷-I对XOD mRNA表达的影响。结果:栀子苷、西红花苷-I和山栀苷甲酯50、100μmol·L-1处理组细胞XOD活性与空白对照组有极显著差异(P<0.01),其中栀子苷和西红花苷-I对XOD抑制作用较强,西红花苷-II和去乙酰车前草酸甲酯 对A549细胞XOD活性的抑制较弱,与空白对照组无显著差异(P>0.05)。别嘌呤醇、栀子苷和西红花苷-I各剂量处理组的XOD mRNA水平与空白对照组相比均没有显著差异(P>0.05)。结论:栀子苷和西红花苷-I对XOD活性抑制作用可能是栀子降尿酸作用机制之一。
栀子 痛风 黄嘌呤氧化酶
痛风是一种嘌呤代射紊乱所致的疾病,其临床表现主要是反复发作的关节炎、痛风性肾病、痛风凝结物沉积、尿酸性泌尿系统凝结物生成,关节红、肿、热、痛反复发作,尤以第一跖趾关节最为常见,关节周围有痛风石单钠尿酸盐(monosodium urate,MSU)沉积[1]。血尿酸升高是痛风的重要生化基础[2]。近年来,痛风的发病率呈上升趋势,其发病机制及药物治疗和新药研发已越来越引起人们的重视。XOD是体内催化黄嘌呤、次黄嘌呤氧化生成尿酸的酶。本课题组前期研究表明栀子提取物及不同部位能显著降低高尿酸血症小鼠血清尿酸水平,抑制XOD活性是其降低高尿酸血症小鼠血清尿酸水平的机制之一[3-4]。本研究选择栀子中的5个化合物,研究其对人肺癌细胞A549 XOD活性的影响,进一步研究栀子降尿酸可能作用机制。
1 材料
1.1 仪器 UV2100紫外可见分光光度仪(北京瑞利分析仪器公司);电热恒温水温箱(上海博迅实业有限公司);高速冷冻离心机(美国 Beckman-Coulter公司);YXQ-LS-50A全自动高压灭菌器(上海博迅实业有限公司);二氧化碳培养箱(美国Thermo Scientfic公司);MJ-PTC200 PCR仪(美国Bio-Rad公司);DYY-III-5稳压稳流电泳仪(北京市六一仪器厂)。
1.2 试剂 栀子苷(批号:110749-201214)购自中国药品生物制品检定所;西红花苷-I(批号:1275-120709)、西红花苷-ΙΙ(批号:1276-120709)、山栀苷甲酯(批号:1335-130411)、去乙酰车前草酸甲酯(批号:1338-130411)均购自江西中医药大学中药固体制剂制造技术国家工程研究中心;新生牛血清(杭州四季青公司);DMEM干粉、Penicilin-Streptomycin、胰酶(Gibco公司);Trizol Reagent (美国Invitrogen公司);M-mLV反转录酶(美国Promega公司);其它试剂均为国产分析纯。人肺癌细胞A549由江西中医药大学现代中药制剂教育部重点实验室惠赠。XOD引物:上游: 5’-TCGTCCAGGGTCTTGGTCTC-3’,下游:5’- GGCGTTACTGTCTCCGTGCT-3’,扩增片段长度为275bp;GAPDH内参引物:上游:5’-TGAGGCCGGTGCTGAGTATGT-3’,下游:5’-CAGTCTTCTGGGTGGCAGTGAT-3’,扩增片段长度为299 bp;均由上海生工生物技术服务有限公司合成。
2 方法
2.1 细胞培养 人肺癌细胞A549培养于含10%的胎牛血清DMEM培养液中,该培养液含100IU·mL-1的青霉素和卡那霉素,于37℃下5%CO2孵箱内培养,每2~3天稀释传代培养。实验时取处于对数生长期的细胞,接种于24孔培养板,加入1mL DMEM培养液。
2.2 栀子苷、西红花苷-I、西红花苷-II、山栀苷甲酯和去乙酰车前草酸甲酯对A549细胞体内XOD活性的影响
2.2.1 分组与给药 实验分为14组,每组6孔,包括对照组和实验组。对照组为空白对照组和DMSO对照组,空白对照组单纯用含10%新生牛血清的DMEM培养液继续培养,DMSO对照组加入终浓度为1%的DMSO,实验组别嘌呤醇、栀子苷、西红花苷-I、西红花苷-II、山栀苷甲酯、去乙酰车前草酸甲酯用DMSO溶解,处理终浓度分别为50μmol·L-1和100μmol·L-1。
2.2.2 细胞内XOD的提取 细胞经药物处理后,再置于CO2孵箱内培养3h,取出,倾去培养液,用pbs缓冲液(pH7.5,200mM)洗涤1次,加入少量胰酶消化2~3min,加入1mL培养液终止消化,吸出细胞悬液置于离心管中,1000rpm·min-1离心5min(4℃),弃去上清液,沉淀加入0.5mL pbs缓冲液(pH7.5,200mM),超声15min破碎细胞,12000rpm·min-1离心10min(4℃),取上清液,用于XOD活性测定。
2.2.3 XOD活性的测定 取细胞离心上清液0.35mL,加到pH8.0磷酸钾盐缓冲液200mM(含有1mM的EDTA-Na)中,置于37℃水浴中,再加入底物黄嘌呤溶液(终浓度为100μM)开始反应,反应30min后加入0.25mL HCl(0.58M)终止反应。空白对照液中不加入细胞离心上清液,预先加入0.25mL HCl(0.58M)终止反应。在290nm处测定吸收度。细胞离心上清液总蛋白质的测定用Lowry法测定,以小牛血清蛋白做标准蛋白。
2.3 RT-PCR检测别嘌呤醇、栀子苷和西红花苷-I对XOD 基因表达的影响
2.3.1 分组与给药 实验分为24组,每组4孔,包括对照组和实验组。其中8组经药物处理12h后检测XOD mRNA含量,对照组为空白对照组和DMSO对照组,实验组别嘌呤醇、栀子苷、西红花苷-I根据抑制曲线分别选择对XOD活性抑制50%和70%的处理终浓度,其中别嘌呤醇处理终浓度分别为11μmol·L-1和26μmol·L-1,栀子苷处理终浓度分别为45μmol·L-1和200μmol·L-1,西红花苷-I处理终浓度分别为41μmol·L-1和200μmol·L-1;另外8组经药物处理24h后检测XOD mRNA含量,实验分组同12h处理;最后8组经药物处理48h后检测XOD mRNA含量,实验分组同12h给药处理。
3 结果
3.1 栀子苷、西红花苷-I、西红花苷-II、山栀苷甲酯和去乙酰车前草酸甲酯对A549细胞体内XOD活性的影响 药物处理3h,DMSO对照组与空白对照组无显著差异,别嘌呤醇50、100μmol·L-1处理组A549细胞XOD活性与空白对照组有极显著差异(P<0.01),对A549细胞XOD活性的抑制率分别为72.25%和74.34%,栀子苷、西红花苷-I和山栀苷甲酯50、100μmol·L-1处理组细胞XOD活性与空白对照组也有极显著差异(P<0.01),其中栀子苷和西红花苷-I对XOD抑制作用较强,西红花苷-II和去乙酰车前草酸甲酯对A549细胞XOD活性的抑制较弱,仅有西红花苷-II 100μmol·L-1处理组的细胞XOD活性与空白对照组有显著差异(P<0.05)。除去乙酰车前草酸甲酯组,各化合物高剂量组对细胞XOD活性的抑制率均大于该化合物低剂量组(P<0.05)。栀子苷、西红花苷-I、西红花苷-II、山栀苷甲酯、去乙酰车前草酸甲酯对细胞XOD活性的抑制均弱于相同剂量的别嘌呤醇。见表1。
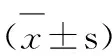
表1 栀子苷、西红花苷-I、西红花苷-II、山栀苷甲酯、去乙酰车前草酸甲酯和别嘌呤醇处理
注:与空白组比较,*P<0.05,**P<0.01;与低剂量组比较,▲P<0.05。
3.2 RT-PCR检测别嘌呤醇、桅子苷和西红花苷-1对XOD基因表达的影响 药物处理12h、24h、48h,琼脂糖凝胶电泳显示PCR扩增条带清晰,DMSO对照组与空白对照组XOD mRNA水平接近,别嘌呤醇、栀子苷和西红花苷-I各剂量处理组的XOD表达与空白对照组相比均没有显著差异。见图1。

图1 RT-PCR检测A549细胞中XOD基因转录产物结果
4 讨论
随着人们生活水平的不断提高、饮食结构的改变,痛风患病率逐年升高,人们对痛风的发病和治疗也越来越重视。西药治疗痛风起效快,疗效好,药物作用的机理研究较为深入,对于痛风的急性治疗和慢性治疗均有相应的有效药物,但西药治疗痛风不良反应较大,秋水仙碱有效剂量和中毒剂量相近,具有肾毒性[5],非甾体类抗炎药具有胃肠道毒性[6],肾上腺皮质激素与促肾上腺皮质激素停药后往往出现“反跳”现象[7],促尿酸排泄药会引起尿酸盐晶体在尿路的沉积,引发肾绞痛和肾功能损害[8],而目前临床应用广泛的抑制尿酸生成药别嘌呤醇虽然价格便宜,抑制XOD效果好,但副作用也多,包括过敏性皮疹、史蒂文斯-约翰逊综合症、肾毒性[9-10]等。西药的不良反应限制了其在痛风治疗过程中的使用。中医药治疗痛风毒性小,许多学者作了临床研究,取得了一定的治疗效果。中草药来源的XOD抑制剂,毒性低且来源广泛,在有效阻止和延缓痛风、高尿酸血症等疾病方面显示了良好的应用前景。
从多种细胞株中可以富集得到XOD,如人肺癌细胞A549[11]、人慢性髓性白血病细胞系K562[12]等,有报道测定了人肺癌细胞A549中的嘌呤代谢过程多个酶的活性,包括黄嘌呤氧化酶(XOD)、腺苷脱氨酶(ADA)、嘌呤核苷磷酸化酶(PNP)、次黄嘌呤鸟嘌呤磷酸核糖转移酶(HGPRT)、腺嘌呤磷酸核糖转移酶(APRT)、鸟嘌呤酶(Guanase),XOD抑制剂只抑制A549细胞中的XOD活性,而对其它酶没有抑制作用[13]。因此,本实验选择人肺癌细胞A549,开展栀子有效成分的体外实验,测定其对A549细胞XOD活性及其mRNA表达的影响。
本实验在小鼠体内实验的基础上,选择栀子中所含有的5个化合物,研究其对人肺癌细胞A549 XOD活性的影响。研究发现栀子苷和西红花苷-I对于细胞XOD活性的抑制效果强于山栀苷甲酯、西红花苷-II、去乙酰车前草酸甲酯。栀子苷和西红花苷-I呈现一定的量效关系,与体内实验的结果基本相符,进一步佐证栀子苷和西红花苷-I对XOD活性抑制作用可能是其降尿酸作用机制之一。细胞经栀子苷和西红花苷-I处理后,RT-PCR结果显示XOD mRNA表达没有显著变化,表明栀子苷和西红花苷-I抑制XOD活性与XOD mRNA表达可能没有直接关系,有待进一步研究。
[1]Okamoto K. Inhibitors of xanthine oxidoreductase[J]. Japanese Journal of Clinical Medicine,2008,66(4):748-753.
[2]徐 娇,易立涛,翁连进,等. 月腺大戟乙醇提取物的抗痛风活性研究[J]. 中药材,2014,37(2):320-323.
[3]朱继孝,朱玉野,罗光明,等. 栀子提取物降低小鼠急性高尿酸血症血尿酸水平及机理研究[J]. 安徽农业科学,2011,39(36):22317-22318.
[4]朱继孝,曾金祥,罗光明,等. 栀子降尿酸有效部位研究[J]. 中国实验方剂学杂志,2012,18(14):140-143.
[5]陈雪梅,柳 军,宋金萍,等. 秋水仙碱对大鼠肾细胞NRK体外毒性机制初步探讨[J]. 中国临床药理学与治疗学,2011,16(5):496-500.
[6]Hochberg,MC. COX-2 selective inhibitors in the treatment of arthritis:a rheumatologist perspective[J]. Curr Top Med Chem,2005,5(5):443-448.
[7]常 明,楚文南,谢惠民. 肾上腺皮质激素的合理应用[J]. 中国医刊,2008,43(7):7-12.
[8]刘二刚. 抗痛风性关节炎中药的研究[D]. 浙江大学,2012.
[9]杨 媛,李 静,甄健存,等. 抗痛风药别嘌呤醇、苯溴马隆及秋水仙碱不良反应报告分析[J]. 中国医院药学杂志,2013,33(15):1297-1298.
[10]Okamoto K.Inhibitors of xanthine oxidoreductase[J]. Japanese Journal of Clinical Medicine. 2008,66(4):748-753.
[11]Papi A1,Contoli M,Gasparini P. Role of xanthine oxidase activation and reduced glutathione depletion in rhinovirus induction of inflammation in respiratory epithelial cells[J]. J Biol Chem. 2008,283(42):28595-606.
[12]Abdelwahed A,Bouhlel I,Skandrani I,et al. Study of antimutagenic and antioxidant activities of Gallic acid and 1,2,3,4,6-pentagalloylglucose from Pistacia lentiscus Confirmation by microarray expression profiling[J]. Chem Biol Interact,2007,165(1):1-13.
[13]Tetsuya Y,Moriwaki Y J,Yoshihiro F,et al. Effect of TEL-6720,a xanthine oxidase inhibitor,on the nucleoside transport in the lung cancer cell line A549[J]. Pharmacology,2000,60:34-40.
江西省卫生厅中医药科研计划(No.2012A163)
朱继孝,男,副教授,理学博士。主要从事中药成分与作用机理研究工作。E-mail: zhujx81@sina.com
江西中医药大学中药资源与民族药研究中心(330004)

