超声波辅助乙醇-氨水提取茶皂素的工艺研究*
何自强, 张惠玲, 张新欢
(武汉生物工程学院 化学与环境工程系,湖北 武汉 430415)
超声波辅助乙醇-氨水提取茶皂素的工艺研究*
何自强*, 张惠玲, 张新欢
(武汉生物工程学院 化学与环境工程系,湖北 武汉 430415)
以茶籽粉为原料,采用超声波辅助乙醇-氨水法提取茶皂素,探讨了料液比、乙醇浓度、氨水浓度、超声浸提温度、超声浸提时间等单因素对茶皂素得率的影响,再经正交试验,得到茶皂素提取的最佳工艺:料液比为1∶10,乙醇浓度为75%,氨水浓度为0.5%,超声浸提温度为80 ℃,超声浸提时间为55 min.此条件下茶皂素含量为93.68%,得率19.50%.该方法操作简单,缩短了茶皂素的提取时间,提高了茶皂素的得率,且纯度较高.
茶籽粉;茶皂素;超声波;乙醇;氨水;提取
茶皂素,又称茶皂苷,是从山茶科山茶属植物中提取得到的五环三萜类糖苷化合物[1]。在茶籽、茶叶、茶树茎及根系中均有分布,尤以茶籽中含量最多[2]。纯品茶皂素是无色微细柱状结晶,分子式为C57H90O28,熔点为220~224 ℃[1],易溶于热水、含水甲醇、含水乙醇和正丁醇中,不溶于乙醚、丙酮及苯等溶剂[3]。茶皂素是一种性能优良的天然非离子型表面活性剂,具有良好的乳化、分散、发泡、润湿等功能,并且有消炎、镇痛、抗渗透等药理作用,广泛应用于洗涤、毛纺、针织、医药、日用化工等领域[4]。
目前,提取茶皂素的方法主要有:水提法、有机溶剂浸提法、混合溶剂浸提法、超声波辅助提取法、微波辅助提取法、超临界萃取法等[5]。这些方法各有优缺点,但相较而言,超声波法提取茶皂素的得率较高[5]。
超声波作用于料液时产生空化效应,强大的压力瞬间破坏茶籽细胞壁,同时超声波产生的振动加强了其细胞内物质(如茶皂素、单宁等)的释放、扩散及溶解,且生物活性保持不变[6],已广泛应用于植物中活性成分的提取[7],且有研究证实氨水可增加茶皂素的溶解度[8]。
目前,超声波法提取茶皂素的研究较多,但提取后的纯度不高[9,10],纯化和后处理繁琐,且纯化后损失较大,使其工业化生产受到一定限制。
本文以脱脂茶籽粉为原料,以茶皂素得率为评价指标,采用超声波辅助乙醇-氨水法提取茶皂素,探讨了各工艺参数对茶皂素得率的影响,确定提取茶皂素的最佳工艺条件,旨在提高茶皂素得率的同时,提高纯度.
1 材料与方法
1.1 材料与试剂
茶籽粉(120目):湖南长沙洁然天成;茶皂素标准品(HPLC≥98%):西安一禾生物技术有限公司;无水乙醇、氨水(25%)、香草醛、浓硫酸均为分析纯.
1.2 仪器与设备
AUY120电子天平:日本岛津公司;SK1200H 超声波清洗仪(50 W,53 kHz):上海科导超声仪器有限公司;TU-1810 紫外可见分光光度计:北京普析通用仪器有限责任公司;TG16-WS台式高速离心机:长沙湘智离心机仪器有限公司;RE-52 AAA旋转蒸发器:上海嘉鹏科技有限公司;DHG-9053A型电热恒温鼓风干燥箱:上海一恒科技有限公司;XT-4双目显微熔点测定仪:北京泰克仪器有限公司.
1.3 实验方法
1.3.1 茶皂素的提取工艺 称取10 g脱脂茶籽粉,以一定体积分数的乙醇为提取剂,在不同的料液比、氨水浓度、超声浸提温度、超声浸提时间下进行提取。提取过程如下:

1.3.2 茶皂素最大吸收波长的确定[1]准确称取茶皂素标准品0.102 9 g,用50%乙醇溶解,置于100 mL容量瓶中定容,配成质量浓度为1 mg/mL的茶皂素标准溶液,摇匀备用.
采用浓硫酸-香草醛显色法测定吸光度(A).
取茶皂素标准溶液0.1 mL,加入0.4 mL 50%的乙醇,再加入80 g/L香草醛溶液0.5 mL,于冰水浴中加入4 mL 77%(质量分数)的硫酸,摇匀,于60 ℃水浴加热15 min,然后置于冰水浴中冷却10 min,取出恢复至室温,以试剂空白为参比,测定茶皂素的吸光度,得到最大吸收波长515 nm(见图1).


1.3.3 茶皂素标准曲线的绘制[1]取茶皂素标准溶液0.0、0.1、0.2、0.3、0.4、0.5 mL于10 mL容量瓶中,再分别加入0.5、0.4、0.3、0.2、0.1、0.0 mL50%的乙醇,其他按1.3.2的步骤操作,在515 nm波长下测吸光度.以质量浓度C(mg/mL)为横坐标,吸光度(A)为纵坐标,绘制标准曲线(见图2),得到该标准曲线的回归方程为:A=3.351 4C-0.007 6,R2=0.993 1.
1.3.4 茶皂素含量的测定 称取50 mg左右的茶皂素产品,用50%乙醇溶液溶解定容至10 mL容量瓶中,其他按1.3.2的步骤操作,在515 nm波长下测其吸光度,根据标准回归方程计算茶皂素含量,再求出茶皂素产品得率.
茶皂素含量和得率的计算公式如下:
(1) 茶皂素的含量X=CVn/m1×100%
(2) 茶皂素的得率Y=Xm2/m0×100%
其中:X为茶皂素的含量;Y为茶皂素的得率;C为由标准曲线回归方程计算出的样品溶液的浓度(mg/mL);V为测量液的体积(mL);n为样品的稀释倍数;m1为测吸光度所用的茶皂素粗品的质量(mg);m2为茶皂素粗品的质量(mg);m0为茶籽粉质量(mg).
2 结果与讨论
2.1 料液比对茶皂素得率的影响
称取10 g茶籽粉(120目),乙醇浓度为40%,氨水浓度为1.5%,超声浸提温度为60 ℃,超声浸提时间为40 min,料液比分别为1∶5、1∶7、1∶9、1∶11、1∶13.按1.3.4的方法测定提取物含量,计算茶皂素得率,考察料液比对茶皂素得率的影响.结果如图3所示.

由图3可知,料液比在1∶5至1∶11之间时,茶皂素得率逐渐增大,因为料液比大,有利于增加茶籽粉与有机溶剂的接触面积.料液比达到1∶11时,茶皂素得率最大,说明在此料液比下,大部分茶皂素已被浸提出来.而继续增大料液比,茶皂素得率反而缓慢下降,可能是蛋白质、糖类等杂质分子溶出,且料液比过大,消耗的溶剂量增多,浓缩、干燥能耗增加,生产成本增大.综合考虑各因素,确定最佳料液比为1∶11.
2.2 乙醇浓度对茶皂素得率的影响
称取10 g茶籽粉(120目),料液比为1∶11,氨水浓度为1.5%,超声浸提温度为60 ℃,超声浸提时间为40 min,乙醇浓度分别为0%、20%、40%、60%、80%、100%.按1.3.4的方法测定提取物含量,计算茶皂素得率,考察乙醇浓度对茶皂素得率的影响.结果如图4所示.
由图4可知,乙醇浓度为80%时,茶皂素得率达到最大值19.17%,继续增加乙醇浓度,茶皂素得率又会明显降低.因茶皂素易溶于含水乙醇,难溶于无水乙醇,且乙醇浓度过大,加快了蛋白质、淀粉、可溶性多糖等杂质的凝固,抑制了茶皂素的释放,使得茶皂素得率降低.综合考虑各因素,确定最佳乙醇浓度为80%.
2.3 氨水浓度对茶皂素得率的影响
称取10 g茶籽粉(120目),料液比为1∶11,乙醇浓度为80%,超声浸提温度为60 ℃,超声浸提时间为40 min,氨水浓度分别为0.5%、1.0%、1.5%、2.0%、2.5%.按1.3.4的方法测定提取物含量,计算茶皂素得率,考察氨水浓度对茶皂素得率的影响.结果如图5所示.

由图5可知,随着氨水浓度增大,茶皂素得率呈下降趋势,氨水浓度为0.5%时,茶皂素得率最大.结果表明,弱碱条件有利于茶皂素的提取,但溶液pH过高,部分碱溶性杂质也会溶出,会吸附结合部分茶皂素,导致茶皂素得率降低.综合考虑各因素,确定最佳氨水浓度为0.5%.
2.4 超声浸提温度对茶皂素得率的影响
称取10 g茶籽粉(120目),料液比为1∶11,乙醇浓度为80%,氨水浓度为0.5%,超声浸提时间为40 min,超声浸提温度分别为40、50、60、70、80、90 ℃.按1.3.4的方法测定提取物含量,计算茶皂素得率,考察超声浸提温度对茶皂素得率的影响.结果如图6所示.
由图6可知,随着浸提温度的升高,茶皂素得率出现增大和减小交替现象,80 ℃时茶皂素得率达到最大值17.91%.说明在80 ℃时,茶皂素在溶液中的溶解度最大.而温度高于80 ℃,会造成部分茶皂素的分解,同时蛋白质等杂质的不可逆变性凝固加剧,导致少量茶皂素被吸附结合,茶皂素得率下降.综合考虑各因素,确定最佳超声浸提温度为80 ℃.
2.5 超声浸提时间对茶皂素得率的影响
称取10 g茶籽粉(120目),料液比为1∶11,乙醇浓度为80%,氨水浓度为0.5%,超声浸提温度为80 ℃,超声浸提时间分别为20、40、60、80、100 min.按1.3.4的方法测定提取物含量,计算茶皂素得率,考察超声浸提时间对茶皂素得率的影响.结果如图7所示.
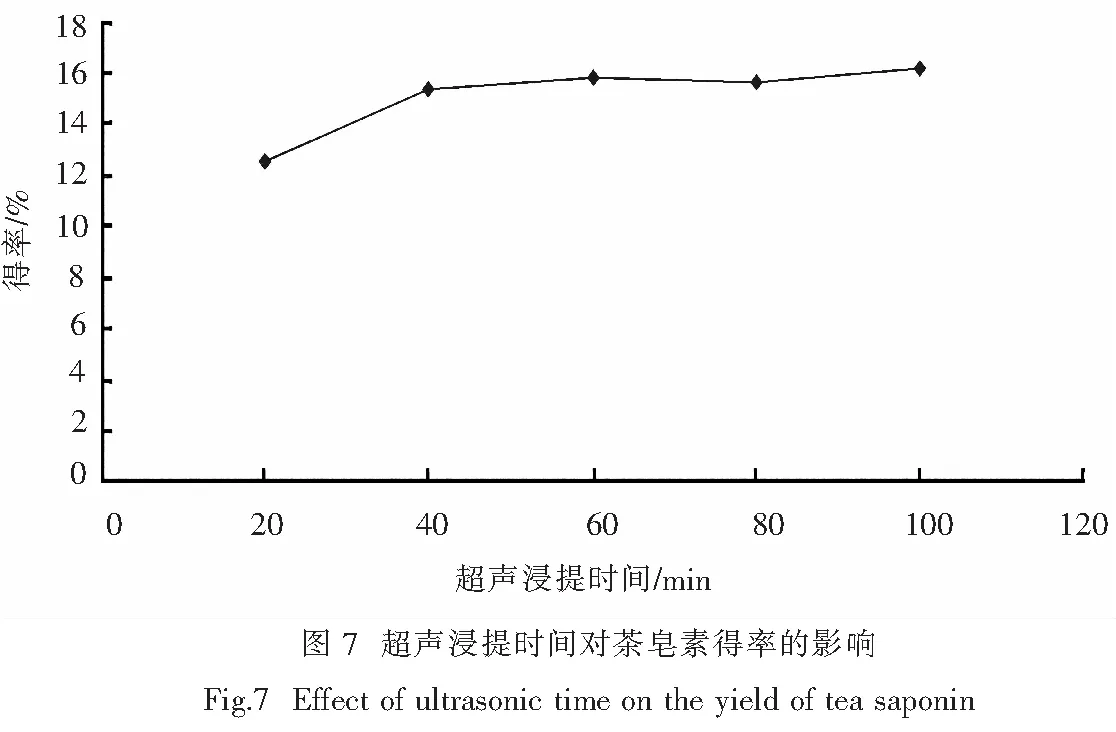
由图7可知,茶皂素得率随超声浸提时间的增加而增大,但超过60 min后,增加较平缓.可能随着超声时间的增加,茶籽粉中的多糖、蛋白质等水溶性杂质溶出,将茶皂素分子包裹起来,阻止了茶皂素向溶液中扩散,导致茶皂素得率的增大趋势减慢.而且超声浸提时间过长,将增加能源消耗.综合考虑各因素,确定最佳超声浸提时间为60 min.
2.6 最佳工艺条件的选择
从单因素实验来看,氨水浓度对茶皂素得率的影响较显著.因此,固定氨水浓度为0.5%,选取料液比(A)、乙醇浓度(B)、超声浸提温度(C)、超声浸提时间(D)作为参考因素,设计3水平,以茶皂素得率为考察指标设计L9(34)正交试验,确定茶皂素提取的最佳工艺,因素水平表见表1,正交试验结果见表2.

表1 正交因素水平表

表2 正交试验设计L9(34)及结果
根据正交试验结果可知,影响茶皂素得率的因素按影响程度由大到小排列为RB>RC>RD>RA,并得到最佳提取工艺为A1B1C2D1,即料液比1∶10,乙醇浓度75%,氨水浓度0.5%,超声浸提温度80 ℃,超声浸提时间55 min.
2.7 茶皂素提取工艺验证实验
以茶皂素提取的最佳工艺进行3次平行实验,验证其提取工艺的稳定性,即称取茶籽粉10 g,料液比1∶10,乙醇浓度75%,氨水浓度0.5%,超声浸提温度80 ℃,超声浸提时间55 min,按上述工艺提取茶皂素,结果见表3.

表3 茶皂素提取工艺验证实验
由表3可知,在料液比1∶10、乙醇浓度75%、超声浸提温度80 ℃、超声浸提时间55 min、氨水浓度0.5%的提取条件下,茶皂素得率稳定.
3 结 论
以乙醇为溶剂,茶籽粉为原料,采用超声波辅助乙醇-氨水法提取茶皂素,考察了料液比、乙醇浓度、氨水浓度、超声浸提温度、超声浸提时间对茶皂素得率的影响,再经正交试验得出茶皂素提取的最佳工艺为料液比1∶10,乙醇浓度75%,氨水浓度0.5%,超声浸提温度80 ℃,超声浸提时间55 min,此条件下得率最高达到19.50%.
该工艺条件下,测其熔点为219~222 ℃,接近理论值[1],因此提取后的茶皂素纯度较高。可用于大规模工业化生产,且后处理简单,也可直接用于后续研究.
[1] 李祥,曹江绒,曹万新,等.响应面法优化茶皂素的超声波辅助提取工艺[J].中国油脂,2013,38(12):72-75.
[2] 孟维,李湘洲,吴志平,等.AB-8型大孔吸附树脂分离纯化茶皂素工艺[J].食品科技,2013,38(1):213-217.
[3] 高凯翔,李秋庭,陆顺忠,等.茶皂素的提取工艺研究[J].粮油食品科技,2010,18(5):22-25.
[4] 刘昌盛、黄凤洪、夏伏建,等.超声波法提取茶皂素的工艺研究[J].中国油料作物学报,2006,28(2):203-206.
[5] 史高峰,汪虎.茶皂素提取纯化工艺和含量测定研究进展[J].油脂加工,2010(9):37-41.
[6] 戚晓阳,张颂培.超声-水浸提茶皂素及茶皂素水溶液应用研究[J].食品科学技术学报,2014,32(1):59-64.
[7] 张喜才,彭春雷,严佑君.茶枯中提取茶皂素工艺探索[J].荆楚理工学院学报,2013,28(4):17-20.
[8] 史高峰,汪虎.乙醇-氨水浸提法提取油茶饼粕中茶皂素的工艺研究[J].现代化工,2011,31(4):37-40.
[9] 李祥,王兰,曹万新,等.超声波辅助乙醇提取茶皂素工艺优化[J].中国油脂,2011,36(11):64-67.
[10] 李静,李燕,党培育.茶皂素的提取及纯化研究[J].食品科学,2008,29(11):154-156.
责任编辑:朱美香
Research on Extracting Technology of Tea Saponin by Ultrasonic Assisting Alcohol-Ammonia Water
HEZi-qiang*,ZHANGHui-ling,ZHANGXin-huan
(Department of Chemical and Environmental Engineering,Wuhan Bioengineering Institute,Wuhan 430415 China)
Tea saponin was extracted by ultrasonic assisting alcohol-ammonia water from camellia seed powder as raw material.Influences of ratio of material to liquid, concentration of alcohol, concentration of ammonia water,ultrasonic temperature and ultrasonic time were studied.By orthogonal experiment,the optimal extraction conditions were determined as below: ratio of material to liquid 1∶10, concentration of alcohol 75%, concentration of ammonia water 0.5%, ultrasonic temperature 80 ℃ and ultrasonic time 55 min. The content of tea saponin was 93.68% and the yield was 19.50% under these conditions.The method was simple and easily operated.It shortened the time of extraction of tea saponin and improved the yield of tea saponin,meanwhile the purity was higher.
camellia seed powder;tea saponin;ultrasonic; alcohol;ammonia water;extraction
2015-01-20
何自强(1976— ),男,湖北 随州人,讲师.E-mail:1049461766@qq.com
O658,TQ041
A
1000-5900(2015)02-0080-06

