夜来香SAMT基因的分离与原核表达
杨华丽 吕恃衡 蔡韡韡 郑鸿昌 潘东明 李子真 陈桂信


摘 要 为探究夜来香(Cestrum nocturnum)花香基因SAMT在花香代谢中的调控作用,以花瓣为材料,采用RT-PCR和RACE技术相结合,克隆夜来香SAMT基因的全长cDNA。结果表明:该cDNA的序列长度为1 493 bp,编码365个氨基酸,其中包含1 098 bp ORF、130 bp 5′UTR和265 bp 3′UTR,将其命名为CnSAMT;生物信息学分析结果表明:该基因所编码的氨基酸序列与烟草、番茄的同源性分别为98%和98%,属于甲基转移酶-7家族;原核表达结果表明:CnSAMT的蛋白表达产物约为42 ku,与软件预测的结果大致相同。采用染色体步移技术,克隆夜来香CnSAMT的5′端调控序列,结果表明:该序列长度为993 bp,且该序列除了含有TATA-box、CAAT-box等启动子核心元件外,还含有光、生长素、脱落酸、热胁迫、缺氧胁迫等外界环境条件响应的顺式作用元件。
关键词 夜来香;SAMT基因;原核表达;5′端调控序列
中图分类号 Q949.777.7 文献标识码 A
Isolation and Prokaryotic Expression of SAMT
Gene from Cestrum nocturnum
YANG Huali1, Lü Shiheng1*, CAI Weiwei1, ZHENG Hongchang2,
PAN Dongming1**, LI Zizhen3, CHEN Guixin1**
1 Institute of Storage Science and Technology of Horticultural Products, Fujian
Agriculture and Forestry University, Fuzhou, Fujian 350002, China
2 Agriculture Bureau of Yong'an City, Yong'an, Fujian 366000, China
3 College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
Abstract A full-length cDNA encoding SAMT named CnSAMT with length 1 493 bp, encoding 365 amino acids, including 130 bp 5′UTR, 1 098 bp ORF, 265 bp 3′UTR, was cloned by the combination of RT-PCR and RACE from Cestrum nocturnum petals, to explore the mechanism of the formation of fragrance in C. nocturnum. Bioinformatics analysis showed that the amino acid sequence was 98% homology with Nicotiana tabacum and 98% identity with Solanum lycopersicum, belonging to Methyltransf-7 superfamily. The product of prokaryotic expression of CnSAMT gene was about 42 ku. The molecular weight was consistent with the predicted by software. A regulatory sequence of the 5′ terminal in CnSAMT with 993 bp in length was cloned by genomic walking technology and the result of sequence analysis showed that the regulatory sequence contained core elements such as TATA-box, etc. and other cis-acting elements responding for environmental conditions such as light, auxins, ABA, heat stress and anaerobic tress, and so on.
Key words Cestrum nocturnum;SAMT gene;Prokaryotic expression;Regulatory sequence of the 5′ terminal
doi 10.3969/j.issn.1000-2561.2015.10.018
夜来香(Cestrum nocturnum)为茄科(Solanaceae)夜香树属(Cestrum)植物,又名夜香树,原产于南美洲,在中国福建、广西、广东、云南等地皆有栽培[1],其呈现独特的开花习性,白天花瓣闭合,夜间花瓣开放,花香浓郁。自仙女扇(Clarkia breweri)芳樟醇合成酶基因(LIS基因)被成功克隆后,越来越多的花香相关基因陆续被克隆,也开始了花香基因工程研究[2-4]。水杨酸羧甲基转移酶(salicylic acid carboxyl methyltransferase, SAMT)以水杨酸(salicylic acid, SA)为受体催化供体S-腺苷-L-甲硫氨酸(S-adenosyl -L-methionine, SAM)上的甲基转移到水杨酸的羧基上,形成水杨酸甲酯(methyl salicylate,MeSA)的反应[5],参与花香物质合成途径的调控[2]。目前,对于SAMT的研究集中在花香挥发性成分合成机制、植物防御系统、酶学特性研究等方面。Ross等[5]从仙女扇花瓣中分离纯化得到一个约40 ku的推测SAMT蛋白,并由此蛋白的序列设计探针,从仙女扇花瓣cDNA文库中分离出cDNA的全长,该基因在大肠杆菌中的原核表达产物为一个约40.3 ku的蛋白,该蛋白与天然纯化SAMT蛋白具有相同的特性,能催化SA和SAM形成MeSA,由此证明该基因的表达产物为SAMT。此后,非洲茉莉(Stephanotis floribunda)[6]、薇甘菊(Mikania micrantha)[7]、 腊梅(Chimonanthus praecox)[8]、 中国水仙(Narcissus tazetta var. chinensis)[9]等植物的SAMT基因相继被克隆, SAMT的活性也在非洲茉莉、 花烟草(Nicotiana alata)、 林烟草(Nicotiana sylvestris)、 球兰(Hoya carnosa)等植物中得到进一步检测和验证[6,10]。Martins等[11]从夜来香的叶片中获得了SAMT基因片段。
本研究采用RT-PCR和RACE技术相结合,分离夜来香花瓣SAMT基因的全长cDNA,采用染色体步移技术分离该基因的5′端调控序列,对该序列的顺式作用元件进行分析,并对该基因进行原核表达研究,以期从分子水平上阐明SAMT基因在夜来香花香代谢中的调控机制,为夜来香花香的改良提供依据。
1 材料与方法
1.1 材料
供试植株夜来香种植在福建农林大学校内,于2012 年7月下旬采集正常生长花瓣(分时间段)、成熟叶片,装入铝箔袋并标记,放入液氮罐带回实验室,立即贮藏于-80 ℃冰箱备用。
RNAiso Plus试剂、Ex Taq、dNTPs、pMD18-T载体、DL2000 Maker购自宝生物工程(大连)有限公司;TransTaq HiFi DNA Polymerase、pEASY-E1载体购自北京全式金生物技术有限公司;DH5α感受态细胞、质粒小提试剂盒、DNA纯化回收试剂盒购自天根生化科技(北京)有限公司; APAgeneTM Gold Walking kit购自加拿大Bio S&T Inc公司;大肠杆菌BL21感受态细胞为所在研究所制备与保存。
1.2 方法
1.2.1 夜来香SAMT基因全长cDNA的克隆 夜来香花瓣总RNA的提取采用RNAiso Plus试剂对夜来香不同时间段的花瓣混合样进行总RNA的提取,采用超微量分光光度计、1%琼脂糖凝胶电泳对总RNA纯度、含量进行检测。参照郑鸿昌[12]改良的方法进行RT-PCR合成双链cDNA。根据GenBank登录号为AY741483.1的夜来香SAMT基因部分编码序列,利用Primer Premier 5软件设计3′RACE、5′RACE引物(见表1),3′RACE、5′ RACE特异接头引物参照郑鸿昌[12]改良的方法设计。引物合成与测序由上海博尚生物技术有限公司完成。
以夜来香双链cDNA为模板进行PCR扩增,反应体系为:总体积为25 μL,包括Ex Taq(5 U/μL)0.25 μL,10×Ex Taq Buffer 2.5 μL,dNTPs(10 mmol/L)1 μL,cDNA模板 1 μL,上下游引物(10 μmol/L)各0.5 μL,最后用ddH2O补加至25 μL;反应条件为:95 ℃预变性5 min;95 ℃变性30 s,按不同条件(3′RACE:55 ℃;5′RACE:第一轮56 ℃,第二轮56 ℃,第一轮PCR产物做模板且模板稀释100倍使用)退火1 min,72 ℃延伸1 min,35个循环;72 ℃延伸10 min;4 ℃结束。电泳检测PCR扩增产物并回收目的条带,连接到pMD18-T载体上,化学转化DH5α感受态细胞,筛选阳性克隆,菌液PCR鉴定,测序。利用NCBI网站、DNAMAN软件对测序序列进行分析。
根据所获得的3′端序列、5′端序列和已报道的SAMT基因部分编码序列进行SAMT基因cDNA全长的拼接,并将所获序列命名为CnSAMT。
1.2.2 夜来香SAMT基因全长cDNA的生物信息学分析 对所获得的夜来香SAMT基因cDNA全长进行生物信息学分析:利用BLAST(http://blast. ncbi.nlm.nih.gov/Blast.cgi)进行氨基酸序列同源性分析;利用MEGA5.2软件构建系统进化树;利用ProtParam tool(http://web.expasy.org/protparam/)、ProtScale(http://web.expasy.org/protscale/)进行蛋白质基本理化性质预测;利用PSORT Prediction(http://psort.hgc.jp/form. html)、TargetP 1.1 Server(http://www.cbs.dtu.dk/services/TargetP/)进行蛋白质亚细胞定位预测;利用NetPhos 2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/)进行蛋白质磷酸化位点预测。
1.2.3 夜来香SAMT基因原核表达质粒的构建与表达 根据拼接的夜来香SAMT基因全长序列,利用软件Primer Premier 5设计开放阅读框(ORF)的上下游引物(见表1)。扩增SAMT基因的ORF:其反应体系的总体积为25 μL,其中包括HiFi DNA Polymerase(5 U/μL) 0.25 μL,10×HiFi buffer Ⅱ 2.5 μL,dNTPs(10 mmol/L)1 μL,cDNA模板 1 μL,上下游引物(10 μmol/L)各0.5 μL,最后用ddH2O加至25 μL。反应条件为:95 ℃预变性5 min;95 ℃变性30 s,57 ℃退火1 min,72 ℃延伸2 min,35 个循环;72 ℃延伸10 min;4 ℃结束。电泳检测确定PCR扩增产物为SAMT基因的ORF后,PCR产物参照pEASY-E1载体说明书进行连接,化学转化DH5α感受态细胞,接着进行菌液PCR鉴定、测序及序列分析。阳性菌液以1 ∶ 50比例接种于5 mL LB(Ampr)液体培养基中,于37 ℃培养过夜,使用质粒小提试剂盒进行菌液质粒的提取,获得重组表达质粒pEASY-E1-CnSAMT。
将重组质粒pEASY-E1-CnSAMT转化BL21感受态细胞,加入400 μL LB液体培养基,37 ℃,200 r/min振荡培养1 h,全部转接入5 mL LB(Ampr)液体培养基,37 ℃,200 r/min继续振荡培养过夜。将上述培养物按1 ∶ 50比例转接到各含有4 mL的LB(Ampr)液体培养基的2个试管中,37 ℃,200 r/min振荡培养至OD600约0.6,将2个分为处理组和对照组,向处理组试管中加入终浓度为0.1 mmol/L IPTG,37 ℃诱导培养,于培养0、4、6、8 h分别收集处理组和对照组各500 μL菌液于1.5 mL离心管中,13 000 r/min离心1 min,弃上清液。向菌体沉淀中加入50 μL 1×SDS上样缓冲液(50 mmol/L Tris-HCl pH6.8,2% SDS,0.1%溴酚蓝,10%甘油,0.1 mol/L二硫苏糖醇),悬浮沉淀,100 ℃沸水浴5~10 min,立即冰浴冷却。12 000 r/min离心2 min,取5 μL上清液进行SDS-PAGE分析。
1.2.4 夜来香SAMT基因5′端调控序列的克隆 采用CTAB法对夜来香成熟叶片基因组DNA进行提取,根据所获夜来香SAMT基因全长序列设计3条巢式引物(见表2)。参照APAgeneTM Gold Walking kit试剂盒说明书,以夜来香基因组DNA为模板,进行SAMT基因5′端调控序列的PCR扩增,然后对PCR扩增产物进行电泳检测、目的条带回收、连接、转化、测序,最后利用PlantCARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对测序序列进行启动子作用元件分析。
2 结果与分析
2.1 夜来香SAMT基因全长cDNA序列的获得与分析
从图1可看出,夜来香花瓣总RNA质量较好,条带清晰完整,无DNA和其他物质污染。分光光度计检测结果显示,总RNA浓度约为1 μg/μL,OD260/280处在1.8~2.0,此结果说明所提取的总RNA纯度、含量均较高。对所获得3′端序列、5′端序列(图2)和已报道的SAMT基因部分编码序列进行拼接,获得了夜来香SAMT基因的cDNA全长,并将所获序列命名为CnSAMT(图3)。CnSAMT全长为1 493 bp,编码365个氨基酸,包含130 bp 5′非编码区(UTR)、1 098 bp开放阅读框(ORF,131~1 228)、265 bp 3′非编码区(UTR)。
2.2 夜来香SAMT基因的生物信息学分析
2.2.1 夜来香SAMT基因的氨基酸序列同源性和进化分析 将CnSAMT的氨基酸序列在GenBank数据库中进行BLAST比对,结果发现该氨基酸序列为甲基转移酶-7家族(methyltransf-7 superfamily),与毛茎夜香树(Cestrum elegans)SAMT氨基酸序列的相似度为90%,与花烟草(Nicotiana alata)、烟草(Nicotiana tabacum)、番茄(Solanum lycopersicum)的相似度均为98%,这说明克隆的基因为夜来香SAMT基因。
选取13种植物的SAMT氨基酸序列与CnSAMT氨基酸序列构建NJ系统进化树(图4)。不同科属类植物之间SAMT氨基酸序列呈现明显差异,该系统进化树基本表明了各植物种类间的亲缘关系。茄科类植物的SAMT氨基酸序列与其他科类植物有明显差异,以100%的bootstrap支持度形成一个分支。在此分支下,不同属植物种类分别形成一个分类群,CnSAMT氨基酸序列与毛茎夜香树SAMT氨基酸序列又以100%的bootstrap支持度形成一个分类群。CnSAMT氨基酸序列树枝长度大于毛茎夜香树SAMT氨基酸序列,这表明该拷贝蛋白质序列发生了变化。
2.2.2 夜来香SAMT蛋白质基本理化性质的预测与分析 推测CnSAMT基因编码365个氨基酸,分子量为41 592.3 u,分子式为C1873H2879N473O562S18,等电点为5.14,蛋白不稳定,总平均亲水性(GRAVY)为-0.238。CnSAMT含有20种氨基酸,其中成分较多的为谷氨酸(Glu,9.9%)、丝氨酸(Ser,9.6%)、亮氨酸(Leu,8.8%)等。带负电荷残基数(酸性氨基酸:天冬氨酸和谷氨酸)为48个,带正电荷残基数(碱性氨基酸:精氨酸和赖氨酸)为34个。亲水性域比疏水性域所占比例大,推测该蛋白为亲水性蛋白。
2.2.3 夜来香SAMT蛋白亚细胞定位、磷酸化位点的预测与分析 CnSAMT定位于细胞质的可能性最大为45%,叶绿体转运肽(chloroplast transit peptide, cTP)值为0.028, 线粒体靶向肽(mitochondrial targeting peptide, mTP)值为0.078,分泌通路信号肽(secretory pathway signal peptide, SP)值为0.339, 结果推测该蛋白无信号肽,属于非分泌型蛋白,最有可能定位于细胞质中。该蛋白可能发生磷酸化的位点有14 个,包括8 个丝氨酸(Ser)位点、3 个苏氨酸(Thr)位点、3 个酪氨酸(Try)位点。各自分别在肽链第26、65、92、186、207、225、230、260 位,第56、182、267 位,第22、266、275 位。
2.3 夜来香SAMT基因的原核表达分析
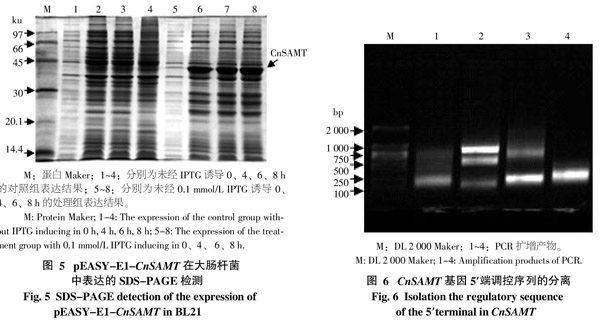
利用SDS-PAGE检测pEASY-E1-CnSAMT表达蛋白的结果见图5,处理组在37 ℃、0.1 mmol/L IPTG诱导条件下,pEASY-E1-CnSAMT在大肠杆菌中诱导4、6、8 h皆有大量蛋白表达,蛋白条带约为42 ku,且诱导6、8 h与4 h的蛋白表达量相同,即在4 h蛋白表达量达最大;而对照组在37 ℃、未经IPTG诱导条件下,pEASY-E1-CnSAMT在大肠杆菌中培养4、6、8 h皆没有大量蛋白表达。综上所述,表达蛋白与所预测的CnSAMT(约41.59 ku)的大小大致相同。
2.4 夜来香SAMT基因5′端调控序列的克隆与序列分析
从图6可看出,采用Walking试剂盒中的第2种DRT(Degenerate random tag)随机引物进行PCR扩增,结果获得约1 000 bp的目的条带并回收纯化;测序结果显示,分离得到一条1 045 bp CnSAMT 5′端调控序列,与CnSAMT序列进行比对,确定分离得到了CnSAMT 的993 bp 5′端调控序列。由图7可知,在起始密码子上游-60 pb和-69 pb之间推测存在有TATA-box,在-89 pb和-92 pb之间存在CAAT-box,该序列还存在许多光响应相关元件,如ATCT-motif、Box4、BoxI、Sp1、GT1-motif、G-box等。同时,该序列上还存在着其他与植物开花和防御相关的元件,如生长素响应元件TGA-element,热胁迫响应顺式作用元件HSE,缺氧诱导响应顺式作用元件ARE等。该序列中大量的光响应相关元件和植物生长发育相关元件的存在可能暗示CnSAMT的表达受光反应和逆境的调控。
3 讨论与结论
调控花香物质主要合成途径中有3个最重要的基因家族,分别为氧位甲基转移酶基因家族、酰基转移酶基因家族、萜类合成酶基因家族。而根据蛋白序列同源关系可将氧位甲基转移酶基因家族分为3个类群,SAMT位于第三类群SABATH甲基转移酶(SABATHMTs)中[13-14]。本研究从夜来香的花瓣中分离得到CnSAMT,编码365个氨基酸,属于甲基转移酶-7家族,为SABATHMTs,这将为进一步开展夜来香花香代谢途径调控机制的研究奠定基础。
在植物中SAMT参与花香物质水杨酸甲酯合成的调控,ROSS等[5]研究证实了在仙女扇中,SAMT可以腺苷甲硫氨酸或苯甲酸为底物,催化形成水杨酸甲酯和少量的苯甲酸甲酯。非洲茉莉同样也释放了这2种香气物质[6,15]。番茄SISAMT对于水杨酸甲酯的合成也至关重要[16]。此外,对CnSAMT氨基酸序列同源性和系统进化树分析结果显示,夜来香与茄科类其他植物SAMT序列有较高的相似度,如CnSAMT与番茄、烟草SAMT序列相似度均为98%,在系统进化树分析中,茄科类植物也以100% bootstrap支持度同在一个分支中,CnSAMT与烟草SAMT、番茄SAMT的亲缘关系较近,但与中国水仙、拟南芥等不同科的植株SAMT的亲缘关系较远。初步推测,茄科类植物SAMT蛋白功能相似具有较大的可能性,CnSAMT在夜来香花香代谢中有可能发挥着合成水杨酸甲酯或苯甲酸甲酯的重要作用。但要证实CnSAMT在夜来香花香代谢中的具体功能,必须在蛋白质水平上进行深入研究。本研究对CnSAMT氨基酸序列的蛋白质基本理化性质、蛋白亚细胞定位、磷酸化位点的预测与分析显示,CnSAMT可能为亲水性蛋白,无信号肽,非分泌型蛋白,最有可能定位于细胞质中;同属SABATHMTs的BAMT被证实在金鱼草花瓣细胞质中大量表达[17],因此推测CnSAMT有可能为胞浆蛋白。预测CnSAMT可能发生磷酸化的位点为14 个,即CnSAMT可能通过蛋白磷酸化对蛋白进行修饰达到调控蛋白结构、功能的作用。另外,对CnSAMT进行原核表达分析,CnSAMT在大肠杆菌中成功表达,为研究CnSAMT蛋白纯化、酶学特性奠定了基础。
同时,本研究首次从夜来香上分离得到993 bp CnSAMT 5′端调控序列。非洲茉莉MeSA每日波动有可能涉及SAMT mRNA的积累和SAMT活动导致的挥发性物质合成[6]。体外喷洒SA能诱导激活MmSAMT,其表达量升高[7]。启动子上响应水杨酸信号可能诱导SAMT表达,合成MeSA。但在CnSAMT 5′端调控序列推测分析中并未发现与水杨酸信号相关响应元件,为寻找CnSAMT 5′端调控序列中响应水杨酸核心元件,需进一步鉴定5′端调控序列的功能。
参考文献
[1] 中国科学院“中国植物志”编辑委员会. 中国植物志[M]. 北京:科学出版社, 1978, 67(1): 149.
[2] 孔 滢, 孙 明, 潘会堂,等. 花香代谢与调控研究进展[J]. 北京林业大学学报, 2012, 34(2): 146-154.
[3] Pichersky E, Dudareva N. Scent engineering:toward the goal of controlling how flowers smell[J]. Trends Biotechnol, 2007, 25(3): 105-110.
[4] 戴思兰, 黄 河, 付建新, 等. 观赏植物分子育种研究进展[J]. 植物学报, 2013, 48(6): 589-607.
[5] Ross J R, Nam K H, DAuria J C, et al. S-Adenosyl-L-methionine:salicylic acid carboxyl methyltransferase,an enzyme involved in floral scent production and plant defense,represents a new class of plant methyltransferases[J]. Arch Biochem Biophys, 1999, 367(1): 9-16.
[6] Pott M B, Pichersky E, Piechulla B. Evening specific oscillations of scent emission, SAMT enzyme activity, and SAMT mRNA in flowers of Stephanotis floribunda[J]. Journal of Plant Physiology, 2002, 159(8): 925-934.
[7] 王文天, 彭少麟, 李冬梅,等. 薇甘菊水杨酸羧甲基转移酶基因的分离鉴定及表达分析[J]. 热带亚热带植物学报, 2009, 17(5): 445-450.
[8] Ma L, Li H F, Peng C C, et al. Cloning of SAMT gene cDNA from Chimonanthus praecox and its expression in Escherichia coli[J]. Agricultural Science & Technology, 2012, 13(1): 82-87.
[9] 林江波, 王伟英, 邹 晖,等. 中国水仙水杨酸甲酯合成酶基因克隆与表达分析[J]. 热带亚热带植物学报, 2013, 21(2):141-146.
[10] Huang R, Hippauf F, Rohrbeck D, et al. Enzyme functional evolution through improved catalysis of ancestrally nonpreferred substrates[J]. Proc Natl Acad Sci USA, 2012, 109(8): 2 966 -2 971.
[11] Martins T R, Barkman T J. Reconstruction of solanaceae phylogeny using the nuclear gene SAMT[J]. Systematic Botany,2005, 30(2): 435-447.
[12] 郑鸿昌. 夜来香均一化全长cDNA文库的构建与花香相关基因的遗传转化[D]. 福州: 福建农林大学, 2012.
[13] 李旭东. 梅花花香相关基因PmOMT功能与进化的生物信息分析[D]. 北京: 北京林业大学, 2013.
[14] 黄铭坤, 何杰玲, 范燕萍. 植物SABATH甲基转移酶研究进展[J]. 植物生理学报, 2011, 47(9): 840-846.
[15] Pott M B, Hippauf F, Saschenbrecker S, et al. Biochemical and structural characterization of benzenoid carboxyl methyltransferases involved in floral scent production in Stephanotis floribunda and Nicotiana suaveolens[J]. Plant Physiol, 2004, 135(4): 1 946-1 955.
[16] Tieman D, Zeigler M, Schmelz E, et al. Functional analysis of a tomato salicylic acid methyl transferase and its role in synthesis of the flavor volatile methyl salicylate[J]. The Plant Journal, 2010, 62(1): 113-123.
[17] Kolosova N, Sherman D, Karlson D, et al. Cellular and subcellular localization of S-adenosyl-L-methionine: benzoic acid carboxyl methyltransferase,the enzyme responsible for biosynthesis of the volatile ester methylbenzoate in snapdragon flowers[J]. Plant Physiol, 2001, 126(3): 956-964.

