黄花美冠兰花芽分化过程中假鳞茎的代谢特征研究
王存等

摘 要 采用生化测定的方法对黄花美冠兰[Eulophia flava(Lindley) Hooker f.]花芽分化过程中假鳞茎内可溶性糖、可溶性蛋白质和总核酸含量的变化进行研究。结果表明:整个花芽分化过程中可溶性糖和可溶性蛋白含量均呈先下降后大幅上升的变化趋势,C/N呈先大幅降低后缓慢升高,总核酸含量的变化呈先降低后升高再降低,且波动幅度较大。表明假鳞茎中可溶性糖、可溶性蛋白质和总核酸的代谢与黄花美冠兰花芽分化紧密相关。
关键词 黄花美冠兰;花芽分化;糖;蛋白质;核酸
中图分类号 S682.31 文献标识码 A
Abstract Changes of soluble sugar, soluble protein and nucleic acid contents in pseudobulbs of E. flava were studied by biochemical measurements during the flower bud differentiation. The results demonstrated: during the flower bud differentiation, soluble sugar and soluble protein contents in pseudobulbs reduced slightly at first and then increased rapidly. Changes of C/N value of pseudobulbs showed a sharp decline initially and followed by a slow rise. Changes of nucleic acid contents in pseudobulbs showed high-low-high-low and the fluctuation was obvious. The results indicated that metabolism of soluble sugar, soluble protein and nucleic acid closely related to flower differentiation.
Key words Eulophia flava;Floral bud differentiation;Sugar;Protein;Nucleic acids
doi 10.3969/j.issn.1000-2561.2015.03.017
黄花美冠兰[Eulophia flava(Lindley) Hooker f.]属于兰科(Orchidaceae)美冠兰属(Eulophia)植物。黄花美冠兰系地生兰,在野外常生于低海拔丘陵地疏林灌丛中,性喜高温、干爽、光照充足的气候环境,喜酸性土壤,耐干旱,耐瘠薄,不耐荫蔽,忌涝,畏寒冷,生长适温为25~30 ℃。假鳞茎生于地下,近圆柱状,有数节,疏生数条根。叶生于假鳞茎顶端,通常2枚,纸质,披针形,长20~40 cm,宽4~7 cm。花叶同萌,花葶侧生,常从假鳞茎上部节上发出,粗壮,高可达1 m;总状花序直立,长35~40 cm,疏生10余朵花;花型美观,花朵大,直径可达4 cm,柠檬黄色,开放热烈;花期4~6月;单花期约2周,是极具开发价值的切花资源。20世纪80年代末,中国热带农业科学院在“海南岛花卉种质资源考察”中就已将其列为重点推荐的野生兰种类[1-3]。
目前,国内对于黄花美冠兰已开展了一些研究,内容涉及黄花美冠兰的原生境调查及生长发育规律[4]、主要营养元素含量变化[5]、施肥配方[6]、核型分析[7]、组织培养[8-9]、内生真菌[10]及切花保鲜[11]等。黄花美冠兰的花期在4~6月,时值花卉销售淡季,市场需求量不大。如果将花期调控至春节,则能提高其销售量及价格,从而推动黄花美冠兰的产业化发展。花芽分化的相关研究是花期调控研究的基础,目前对于黄花美冠兰的花芽分化研究仅限于花芽分化过程的组织学观察[12],更为深入的研究尚未见报道。碳水化合物和蛋白质作为能量物质和结构物质在花芽分化过程中起着重要的作用[13],而花芽分化与遗传物质核酸有关[14],因此笔者从花芽分化过程中可溶性糖、可溶性蛋白质及核酸含量的变化分析假鳞茎的代谢特征,以期为黄花美冠兰的花期调控提供理论基础。
1 材料与方法
1.1 材料
黄花美冠兰为当年生假鳞茎,采自中国热带农业科学院热带作物品种资源研究所花卉试验基地,横径大于4.5 cm,大小一致,无损伤无病虫害。
1.2 方法
1.2.1 前处理方法 时间:2009年9月17日~2010年3月28日。在2009年9月17日、11月4日、12月22日及2010年2月8日、3月28日分别取样,每次取当年生假鳞茎3个,剥去叶(鞘)片,称取鳞茎约5 g,液氮速冻后立即置于-80 ℃的冰箱中固定保存,用于可溶性糖、可溶性蛋白质和核酸含量的测定。
1.2.2 可溶性糖含量的测定 采用蒽酮法[15]。提取液的制备:称取1.0 g样品,置于研钵中,加入少量蒸馏水,研磨成匀浆,然后转入20 mL刻度试管中,用10 mL蒸馏水分次洗涤研钵,洗液一并转入刻度试管中。置沸水浴中加盖煮沸10 min,冷却后过滤,滤液收集于100 mL容量瓶中,用蒸馏水定容至刻度,摇匀备用。
可溶性糖含量的测定:准确吸取提取液1 mL,置于20 mL具塞刻度试管中,加1 mL水和0.5 mL蒽酮试剂。再缓慢加入5 mL浓H2SO4,必须将试管置冰水浴中,并沿管壁缓缓加入,待全部试管加完试剂后,同时摇匀,放入沸水浴中,加热10 min,取出后在自来水中冷却。在620 nm波长下测定其吸光度值,在标准曲线上查得可溶性糖含量。
可溶性糖含量/(mg/g FW)=[C×VT×D/(W×VS×106)]×1 000
式中:C表示由标准曲线查得可溶性糖的含量(μg);VT表示提取液的体积(mL);VS表示测定时用液量(mL);D为稀释倍数;W表示样品鲜重(g)。
1.2.3 可溶性蛋白质含量的测定 采用考马斯亮蓝G-250染色法[16]。提取液的制备:称取假鳞茎鲜样0.5 g于研钵中,加5 mL蒸馏水,冰浴中研磨成匀浆,4 000 r/min离心10 min,上清液转移至10 mL容量瓶中。再向渣中加入2 mL蒸馏水,悬浮,4 000 r/min离心10 min,合并上清液,定容至刻度。
可溶性蛋白质含量的测定:取一支具塞试管,准确加0.l mL样品提取液,加0.9 mL蒸馏水,加5 mL考马斯亮蓝G-250试剂,盖上塞子,摇匀。放置3 min,在595 nm波长下测定其吸光度值,在标准曲线上查得可溶性蛋白质含量。
可溶性蛋白质含量/(mg/g FW)=[C×VT×D/(W×VS×106)]×1 000
式中:C表示由标准曲线查得可溶性蛋白质的含量(μg);VT表示提取液的体积(mL);VS表示测定时用液量(mL);D为稀释倍数;W表示样品鲜重(g)。
1.2.4 核酸含量的测定 取样品0.5 g,加8 mL 80%乙醇研磨(分3次加),离心(4 000 r/min,20 min)去除上清液;取沉淀加80%乙醇8 mL混合均匀,离心(4 000 r/min,20 min)去除上清液;取沉淀加乙醇‥乙醚‥三氯甲烷(2‥2‥l,V乙醇/V乙醚/V三氯甲烷)混合液8 mL混合均匀,离心(4 000r/min,20 min)去除上清液,重复1次;取沉淀加4 mL 0.5 mol/L高氯酸90 ℃水解10 min(4 000 r/min,20 min)离心, 取上清液(约1.5 mL),再将沉淀加2 mL 0.5 mol/L高氯酸于90 ℃水解10 min(4 000 r/min,20 min)离心,取上清液1.5 mL,将2次上清液合并,共3 mL,将其混合均匀。取l mL上清液加3 mL高氯酸,混合均匀,蒸馏水为对照,用紫外可见分光光度计测定OD260和OD280。
核酸含量/(μg/g FW)=[(0.629OD260-0.036OD280)×稀释倍数(μg/mL)]/样重。
1.3 数据处理
数据采用Excel软件进行分析处理。
2 结果与分析
2.1 花芽分化期假鳞茎内可溶性糖含量的变化
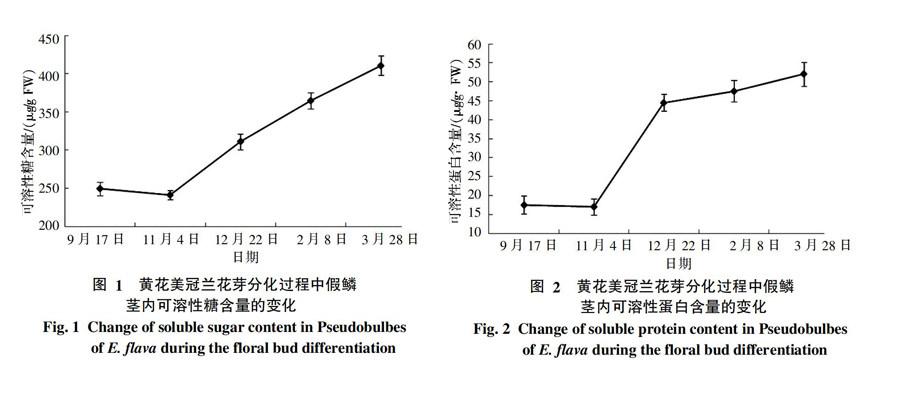
由图1可知,假鳞茎中可溶性糖含量变化呈先下降后上升的趋势。9月17日可溶性糖含量为259.88 μg/g FW,9月17日到11月4日,可溶性糖的含量略有下降,下降约3.3%。11月4日~翌年3月28日,假鳞茎内可溶性糖的含量几乎呈直线上升,3月28日可溶性糖的含量达到410.72 μg/g FW,是9月17日的1.65倍、11月4日的1.7倍。表明可溶性糖含量在黄花美冠兰花芽分化过程中代谢旺盛,为花芽分化提供大量能量及结构物质。
2.2 黄花美冠兰花芽分化过程中假鳞茎内可溶性蛋白含量的变化
由图2可知,假鳞茎中可溶性蛋白的含量总体呈上升趋势。9月17日可溶性蛋白含量为17.53 μg/g FW,9月17日~11月4日含量略有下降,下降仅2.8%,11月4日~12月22日可溶性蛋白含量急剧上升,12月22日含量高达44.53 μg/g FW,上升了161.5%,12月22日~翌年3月28日呈缓慢上升趋势,翌年3月28日可溶性蛋白质含量为52.03 μg/g FW,仅比12月22日上升了16.8%。可溶性蛋白在12月22日以后代谢趋缓,表明此时花芽分化结构物质的合成与组配趋于动态平衡。
2.3 花芽分化过程中假鳞茎内C/N的变化
由图3可知,9月17日~11月4日,黄花美冠兰假鳞茎内C/N略有下降,但维持在较高水平,9月17日和11月4日C/N分别为14.23和14.15,11月4日~12月22日C/N急剧下降,12月22日C/N仅6.98,较9月17日下降约51.4%,12月22日~翌年3月28日C/N缓慢上升,至翌年3月28日C/N为7.89,较12月22日上升约13.1%。
2.4 花芽分化期假鳞茎内核酸含量的变化
由图4可知,假鳞茎内总核酸含量呈先降低后升高再降低的变化趋势,且波动幅度较大;9月17日假鳞茎内核酸含量为0.091 μg/g FW,11月4日为0.042 μg/g FW,下降约53.8%,11月4日~翌年2月8日核酸含量迅速上升,2月28日核酸含量高达0.108 μg/g FW,较11月4日上升约157.1%,2月8日至3月28日核酸含量急剧下降,3月28日核酸含量仅0.030 μg/g FW,较2月8日下降约72.2%。
3 讨论与结论
大量的实验证明,碳水化合物在植物开花中具有重要的作用。Bodson等[17]研究发现在几种长日和短日植物中,蔗糖和可溶性糖的含量在花芽分化阶段均呈逐渐升高的趋势。郑焕娣等[18]研究发现香荚兰[Vanilla fragrans(Salisbury) Ames]花芽分化期至花芽萌发期需要相对较高的可溶性糖总量。罗充等[19]研究表明草莓的花芽分化会大量消耗碳水化合物,在花芽分化初期可溶性糖、还原糖和淀粉含量下降。本试验中黄花美冠兰假鳞茎内可溶性糖含量变化与前人试验结果相似,可溶性糖含量先缓慢下降,可能与假鳞茎内与花芽分化的相关代谢活动启动有关,之后可溶性糖含量迅速上升,可能与淀粉等能量贮藏物质分解有关,为花芽分化提供足够的能量供应。
假鳞茎是黄花美冠兰初期生长的主要营养供应器官,在花芽分化之前已经积累大量的营养物质。花芽分化的初期要消耗大量的蛋白质进行结构物质的重组,因此,表现出初期可溶性蛋白质含量下降的趋势。花芽分化开始后,大量结构蛋白质不断转化,使得可溶性蛋白质含量迅速上升。而花芽分化中后期,可溶性蛋白含量上升趋势变缓,但仍维持在相对较高的水平,表明在花芽分化后期仍需要大量的蛋白质。孙乃波等[20]在对草莓品种‘北辉的研究中发现在花芽分化过程中叶片中可溶性蛋白的含量呈先下降后上升的变化趋势,与黄花美冠兰的变化相似,不同之处在于黄花美冠兰假鳞茎内可溶性蛋白含量上升更为迅速。
碳氮比假说认为,C/N高促使植物进行花芽分化,本试验中9月17日~11月4日黄花美冠兰假鳞茎内C/N维持在较高水平,说明黄花美冠兰花芽分化的启动需要较高的C/N,随后C/N迅速下降,到12月22日降到最低,可能是大量结构物质合成消耗糖类同时可溶性蛋白质增加所致,12月22日~翌年3月28日,C/N平缓上升,但维持在相对较低的水平,表明假鳞茎内维持一定C/N对黄花美冠兰的成花过程有利。
核酸是生物最基本的遗传物质,贮存了细胞所有的遗传信息,并控制蛋白质的生物合成,因此,核酸是代谢和发育方向的主导者。在果树研究中,花芽分化与核酸代谢有关[14]。从本试验结果中可以发现在整个花芽分化过程中假鳞茎内总核酸含量呈高-低-高-低的变化趋势。起初核酸含量高可能是生理分化时期细胞内核酸代谢活跃所致,而后因生长锥体积增大而使核酸含量大幅下降,之后又大幅上升,多半与花芽各部形态建成使核酸代谢再度活跃有关,此后核酸含量又开始下降,可能与形态分化进入尾声所致,有研究表明,花芽分化期核酸含量的变化主要体现在RNA上[21],当形态分化进入尾声时,先前合成的大量RNA分解,从而导致核酸含量下降,但由于本试验未测定DNA和RNA含量变化,因此具体变化特征尚需进一步研究。
参考文献
[1] 广东省植物研究所. 海南植物志(第四卷)[M]. 北京: 科学出版社, 1977: 244.
[2] 丁慎言, 尹俊梅. 海南岛野生兰花图鉴[M]. 北京: 中国农业出版社, 2005: 79.
[3] 华南热带作物学院/中国农业科学院作物品种资源研究所. 海南岛作物(植物)种质资源考察文集[M]. 北京: 农业出版社,1992: 171-179.
[4] 吕君展, 尹俊梅,杨光穗. 海南黄花美冠兰原生境调查及其生长发育规律初步研究[J]. 热带农业科学, 2006, 26(1): 15-17, 68.
[5] 张 欢, 尹俊梅,杨光穗. 黄花美冠兰生长发育规律及主要营养元素含量变化的研究[J]. 热带作物学报, 2010, 31(9): 1 535-1 541.
[6] 程潇筱,杨光穗. 不同肥料对黄花美冠兰生长发育影响的数学模型研究[J]. 热带农业科学, 2008, 28(6): 34-38.
[7] 邓小果, 莫 饶, 罗远华, 等. 黄花美冠兰的核型分析[J]. 福建林业技, 2009, 36(4): 80-83.
[8] 郑 玉, 李志英,徐 立. 黄花美冠兰的组织培养和快速繁殖[J]. 植物生理学讯, 2004, 40(6): 574.
[9] 陈春满, 叶一枝, 凌绪柏. 黄花美冠兰的离体繁殖[C]//第二届全国植物组织培养、脱毒快繁及工厂化生产学术研讨会论文集, 2004: 316-321.
[10] 朱艳秋, 张荣意, 孟 锐, 等.黄花美冠兰根部内生真菌研究[J]. 西南农业学报, 2009, 22(3): 675-680.
[11] 王 存, 尹俊梅, 杨光穗,等. 不同保鲜液对黄花美冠兰切花生理及瓶插寿命的影响[J]. 热带作物学报, 2010, 31(8): 1 351-1 355.
[12] 尹俊梅, 杨光穗, 吕君展,等. 黄花美冠兰花芽分化过程的显微观察[J]. 热带作物学报, 2010, 31(12): 2 224-2 227.
[13] 郭金丽, 张玉兰. 苹果梨花芽分化期蛋白质、淀粉代谢的研究[J]. 内蒙古农牧学院学报, 1999, 20(2): 80-82.
[14] 吕柳新, 林顺权. 果树生殖学导论[M]. 北京: 中国农业出版社, 1995: 25-31.
[15] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[16] 陈建勋, 王晓峰. 植物生理学实验指导(第二版)[M]. 广州: 华南理工大学出版社, 2006.
[17] Bodson M, Outlaw WH. Elevation in the sucrose content of the shoot apical meristem of Sinapis alba at floral evocation[J]. Plant Physiology, 1985, 79: 420-424.
[18] 郑焕娣, 陈善娜, 田育天,等. 香荚兰花芽分化期与萌发期可溶性糖和蔗糖的变化[J]. 云南大学学报(自然科学版), 2001, 23: 93-95.
[19] 罗 充, 彭抒昂, 马湘涛, 等. 草莓成花过程中Ca2+、 CaM及成花物质含量变化[J]. 山地农业生物学报, 2000, 19(4): 266-271.
[20] 孙乃波, 张志宏. 草莓花芽分化过程中叶片碳水化合物和蛋白质含量的变化[J]. 安徽农业科学, 2006, 34(11): 2 328-2 329.
[21] 郭金丽,张玉兰. 苹果梨花芽分化期核酸代谢规律的研究[J]. 内蒙古农业大学学报, 2002, 23(1): 49-52.

