葡萄糖氧化酶在水溶性CdTe量子点上的直接电化学研究
余 祎,喻玖宏
(武汉轻工大学 化学与环境工程学院,湖北 武汉 430023)
葡萄糖氧化酶在水溶性CdTe量子点上的直接电化学研究
余 祎,喻玖宏*
(武汉轻工大学 化学与环境工程学院,湖北 武汉 430023)
利用合成的CdTe量子点(QDs)作修饰材料,将葡萄糖氧化酶(GOD)固定在水溶性CdTe量子点表面,制备了葡萄糖氧化酶CdTe量子点修饰碳糊电极(GOD/CdTe/CPE),实现了GOD在电极表面的直接电化学。CdTe QDs能有效地加速葡萄糖氧化酶(GOD)与电极表面的直接电子转移,电子传递效率比无QDs CdTe存在时提高约8倍;电子转移速率常数(K)为0.14 s-1,传递系数(α)为0.60,GOD在GOD/CdTe/CPE表面的平均覆盖量(Γ)为7.9×10-8mol/cm2。GOD/CdTe/CPE电极作为第三代葡萄糖电化学生物传感器,成功应用于葡萄糖浓度的检测,其线性范围为0.050~0.32 mmol/L,检出限为0.020 mmol/L。GOD/CdTe/CPE的制备方法简单,稳定性强,具有优良的选择性和重现性,且响应速度快。
CdTe量子点;葡萄糖氧化酶;电化学生物传感器;循环伏安;直接电化学
近年来,在生物电化学领域,对蛋白质的电化学性质研究引起了广泛的兴趣和重视[1-2]。蛋白质的直接电化学研究,对于理解和认识其在生命体内的电子转移机制和生理作用具有重要意义。对电极表面进行化学修饰,可以改善电极与蛋白质分子电活性中心之间的相互作用,从而实现蛋白质分子在电极表面的直接电子传递。
葡萄糖氧化酶(β-D-吡喃型葡萄糖脱氢酶,GOD)是食品工业和医疗诊断中常用的一种酶,同时在传感器的研制方面也有许多相关报道[3-4]。高先娟等[5]采用壳聚糖-谷胱甘肽复合膜固定葡萄糖氧化酶构建电流型葡萄糖生物传感器,发现壳聚糖-谷胱甘肽复合膜可以辅助电子传递,有效提高电极的电流响应。黄小梅等[6]制备了核-壳结构的TiO2@Pt复合纳米颗粒,并成功修饰于恒电位沉积的普鲁士蓝-壳聚糖(PB-CS)杂化膜表面,得到的传感器对葡萄糖有良好的催化作用。量子点是一种特殊的纳米微粒,因其独特的物化性质而得到广泛应用。自Alivisatos小组和Nie小组[7-8]初步解决量子点(QDs)的水溶性以及生物相容性问题后,量子点在DNA及蛋白质标记、活体细胞染色和生物芯片等领域获得广泛应用[9-10]。将量子点应用于氧化还原蛋白直接电化学的研究也是当前研究热点之一[8]。Wang等[11]将CdTe量子点(QD CdTe)固定在血清蛋白修饰玻碳电极上,结果显示QD CdTe能够促进电极与血清蛋白之间的直接电子传递。Lu等[12]将血红蛋白(Hb)滴涂在用水溶性CdSe/ZnS量子点复合物薄膜修饰的玻碳电极表面,量子点膜上的Hb不仅能很好地保持其生物活性,而且在CdSe/ZnS的作用下,Hb能够在电极表面发生直接电子传递。
本文将GOD固定在水溶性CdTe量子点表面,制成碳糊修饰电极,基于纳米CdTe量子点对蛋白质的高固载率、高催化活性,研究了GOD在电极表面的直接电化学行为。并在此基础上,制备了一种CdTe量子点纳米复合物葡萄糖电化学生物传感器,进行葡萄糖的电化学测定。
1 实验部分
1.1 试剂与仪器
葡萄糖氧化酶(GOD,5 500 U/g,Amresco公司);石墨粉(光谱纯);磷酸盐缓冲溶液(PBS)由0.20 mol/L NaH2PO4和0.20 mol/L Na2HPO4按一定比例混合而成,并用NaOH或H3PO4调节至所需的pH值;其它试剂均为分析纯。实验用水为三重石英蒸馏水。
CHI 600C电化学工作站(上海辰华仪器公司),修饰电极为工作电极,铂丝作对电极,Ag/AgCl(饱和KCl溶液)电极作参比电极。除特别说明外,所有测试底液均为室温下0.20 mol/L pH 7.0的磷酸盐缓冲溶液。
红外光谱为水平衰减全反射红外光谱,将GOD溶液和GOD/CdTe混和溶液滴涂到载玻片上,自然晾干分别制成GOD膜和GOD/CdTe膜,用干净的载玻片作为空白,用Vertex 70傅立叶变换红外光谱仪(Bruker,德国)检测水平衰减全反射红外光谱。将GOD溶液和GOD/CdTe混合溶液分装在样品管中,并使用Shimadzu UV-2500紫外-可见分光光度计(Tokyo,Japan)分别检测其紫外-可见吸收光谱。
1.2 实验部分
1.2.1 CdTe量子点的制备 参考文献[13-14],将0.47 g Te粉和0.50 g NaHB4加入密闭反应器中,通N210 min排除其中的空气,于40 ℃水浴中搅拌条件下缓慢滴加乙醇水溶液,于N2气氛下反应至Te粉完全消失。反应结束后,冰水浴10 min,将8.0 mL 0.50 mol/L H2SO4快速注入上述反应液中,通N2将反应器中产生的H2Te气体导入另一反应器,用0.050 mol/L NaOH溶液吸收H2Te,即制得澄清NaHTe溶液;调节含有巯基乙酸(TGA)的CdCl2溶液(Cd-SR)至pH 11.2,在N2保护下剧烈搅拌,并加入新制的NaHTe溶液,摩尔比n(Cd2+)∶n(Te)∶n(TGA)= 1∶0.5∶2.4,搅拌反应20 min,浓度以HTe-计为276 mmol/L。将体系加热至100 ℃并回流4 h,得水溶性CdTe量子点。待体系冷却后,于4 ℃贮存备用。
1.2.2 空白碳糊电极的制备 将石墨粉在700 ℃下灼烧4 min,备用。将5.0 μL液体石蜡加入20 mg石墨粉中,充分研磨混合均匀,所得碳糊填入内径2 mm的塑料管一端并抛光成镜面,另一端用铜线引出,即制成空白碳糊电极(CPE),于4 ℃贮存备用。
1.2.3 GOD/CdTe/CPE的制备 将GOD溶于水中配成0.050 mg/μL的储备液备用,用微量移液器取120 μL GOD储备液,与300 μL QDs CdTe溶液混合,得到GOD/CdTe混合溶液,向其中加入20 mg石墨粉,并超声使其分散均匀,待水分完全蒸发后加入5.0 μL液体石蜡,经碾磨混合均匀,得内含GOD和QDs CdTe的修饰碳糊;将修饰碳糊填入内径为2 mm的塑料管中,按照制备CPE的方法,制成GOD/CdTe/CPE,于4 ℃贮存备用。
1.2.4 GOD/CPE与CdTe/CPE的制备 参照GOD/CdTe/CPE的制备方法,制备GOD修饰碳糊电极(GOD/CPE)、QDs CdTe修饰碳糊电极(CdTe/CPE),但在制备过程中不加QDs CdTe或GOD,于4 ℃贮存备用。
1.2.5 电化学检测 以上述制备的电极作为工作电极,铂丝作对电极,Ag/AgCl(饱和KCl溶液)电极作参比电极,在0.20 mol/L pH 7.0 PBS中,于-0.90~-0.20 V电位区间扫描获得CV图。
2 结果与讨论
2.1 GOD在QDs CdTe上的直接电化学
图1中a~d分别为CPE,CdTe/CPE,GOD/CPE,GOD/CdTe/CPE在0.20 mol/L PBS中的CV曲线。从图中可看出,CPE和CdTe/CPE的CV图(曲线a,b)上未出现氧化还原峰,只反映出很低的背景电流,说明在此电位范围内,空白碳糊(CP)和QDs CdTe均不存在电化学活性,而GOD/CdTe/CPE(曲线d)CV曲线分别在-0.42 V和-0.60 V呈现1对氧化还原峰。由此证明,GOD/CdTe/CPE的CV曲线上的氧化还原峰是由GOD在电极上的直接电化学过程所产生,反应如下:
GOD(FAD) +2e+2H+⟺ GOD(FADH2)
根据两峰电位可以得到葡萄糖氧化酶的式量电位:
E0’=(Epa+Epc)/2 =-0.51 V

图1 不同电极在0.20 mol/L pH 7.0 PBS中的CV图
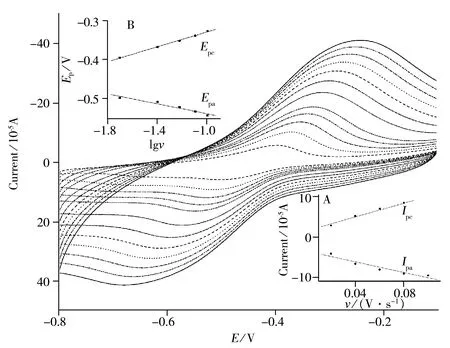
图2 GOD/CdTe/CPE在0.20 mol/L pH 7.0 PBS 中不同扫速下的CV图
氧化峰和还原峰电位之差ΔEp=180 mV,两峰电流的比值接近于1,表明GOD在CdTe/CPE上的直接电化学行为是一个准可逆过程。
碳糊电极中不存在CdTe量子点时,GOD/CPE也有1对氧化还原峰(曲线c),但相比较而言,其峰电流的大小不及GOD/CdTe/CPE循环伏安峰的1/8,这充分表明,由于CdTe量子点存在,GOD与电极之间的直接电子传递被显著加速,进一步说明CdTe量子点对GOD的直接电化学过程具有良好的催化作用;同时CdTe量子点具有大的比表面积,可以提高GOD的固载量且有助于GOD分子获得更好的空间取向以利于与电极表面进行直接电子传递。
2.2 GOD/CdTe/CPE的循环伏安特性
GOD/CdTe/CPE在0.20 mol/L pH 7.0的PBS中以不同扫描速率(v)进行循环伏安扫描(见图2),结果表明,随着v的增加,峰电流逐渐增大,氧化、还原峰电位分别向正电位和负电位方向移动,且峰电位差ΔEp也随之增大,其式电位为-0.44 V,接近于25 ℃下pH 7.0 PBS溶液中GOD的式电位-0.46 V[15],表明经CdTe修饰后大部分GOD分子保持其原有的结构。当v在0.02 ~ 0.10 V/s范围内时,峰电流与v呈良好的线性关系(图2插图A),相关系数(r)为0.991 1,因此该电化学反应是一表面控制过程或者薄膜电化学行为,GOD的表面覆盖量(Γ)和电子传递数(n)的关系可用Lavrion’s方程[16]表示:Ip=n2F2vAΓ/(4RT)=nFQv/(4RT),式中Q为电化学反应的电量;A为电极面积;
Ip为氧化还原峰电流,F为法拉第常数,R为理想气体常数,T为温度。
由图2(插图A)可算出Q为1.0×10-4C,根据其斜率8.6×10-4A·V-1.s,可得n为1.9,说明电极表面进行的是双电子反应。因此可求得GOD在电极表面的平均覆盖量(Γ)为7.9×10-8mol/cm2,说明CdTe量子点对葡萄糖氧化酶的固定化有较好的效果。当v从0.15 V/s变化到0.50 V/s时,峰电流与v1/2呈良好的线性关系,线性系数(r)为0.986 3,说明在此扫速范围内,该电化学反应为一扩散控制过程。当扫描速率低于0.10 V/s时,峰电位与lgv呈一定线性关系(图2插图B),对于氧化还原单分子膜修饰的电极[17],峰电位存在如下关系:
可算出电子传递系数α=0.6,由以上公式可得:

进一步根据E~lgv的斜率可计算出电子传递速率常数(K)为0.14 s-1,说明葡萄糖氧化酶在电极表面上的电子传递速度较快,也进一步证明该电化学反应为一扩散控制过程。

图3 GOD溶液(a)和GOD/CdTe复合 物溶液(b)的紫外-可见吸收光谱
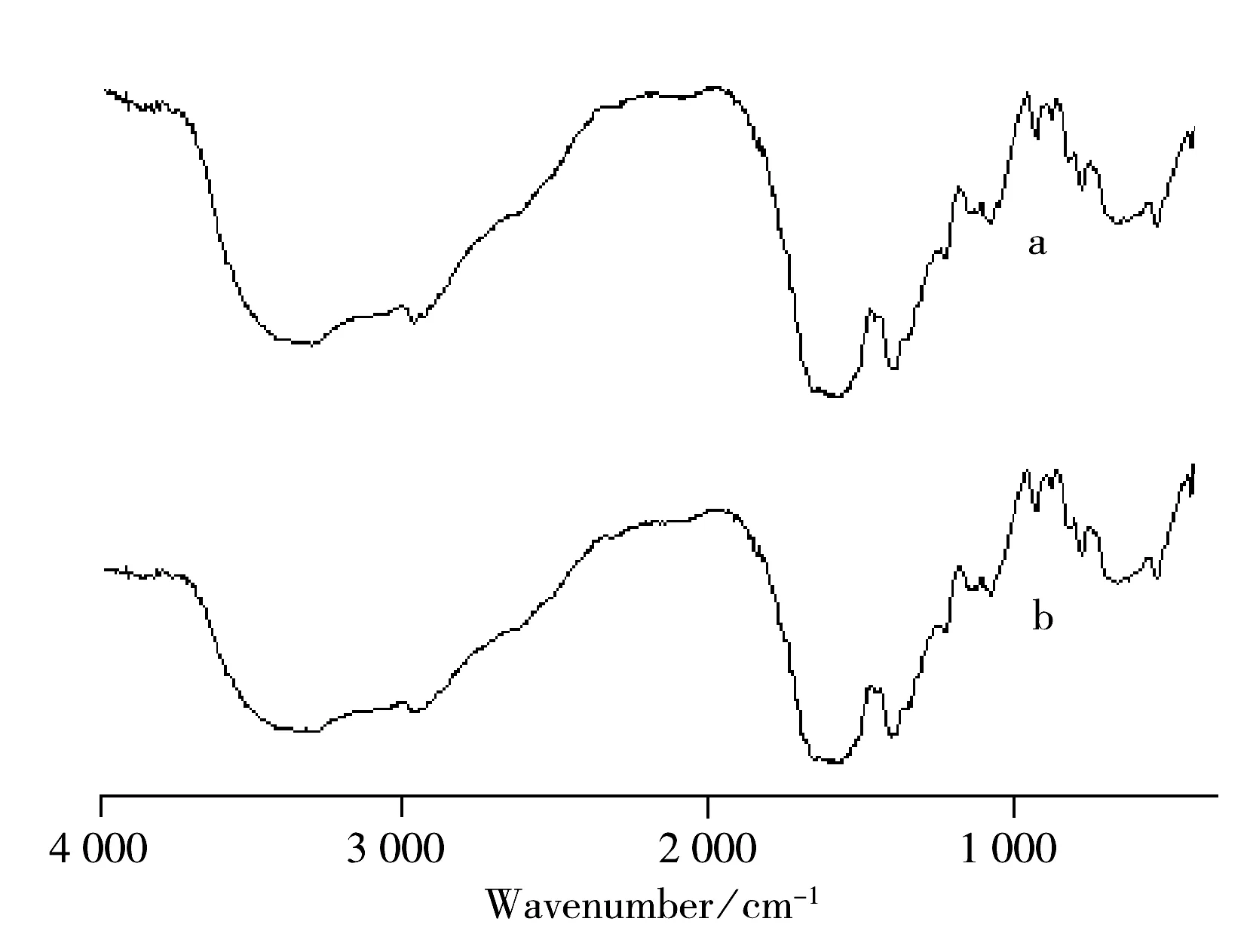
图4 GOD(a)和GOD/CdTe复合物(b)的红外光谱
2.3 修饰膜的光谱表征
GOD溶液和GOD/CdTe复合物溶液的紫外-可见吸收光谱如图3所示。GOD/CdTe复合物溶液的吸收带(曲线b)位于450 nm,与GOD溶液的吸收带(曲线a)十分相似,吸收带轮廓基本保持不变。说明GOD/CdTe复合物中的GOD结构未发生明显变化,能保持GOD自身的性质。
粉末状GOD和GOD/CdTe复合物的红外吸收光谱如图4所示。GOD的FTIR光谱中吸收带位置分别在1 576 cm-1和1 398 cm-1(曲线a),GOD/CdTe复合物的特征吸收带分别出现在1 577 cm-1和1 401 cm-1(曲线b),两FTIR光谱图的轮廓基本相同,这表明复合物GOD并未发生变性。
2.4 GOD/CdTe/CPE对葡萄糖的响应
2.4.1 GOD/CdTe/CPE对葡萄糖的CV响应 应用GOD/CdTe/CPE中GOD与电极之间的直接电子传递,通过检测葡萄糖在GOD/CdTe/CPE上还原电流的变化可达到检测葡萄糖的目的。图5是GOD/CdTe/CPE在0.20 mol/L空气饱和的PBS(pH 7.0)中,对不同浓度葡萄糖的CV响应图。图5(曲线c~h)结果显示,随着葡萄糖的浓度增大,还原峰电流依次减小,氧化峰电流几乎不变。响应机理如下[18-19]:
GOD(FAD)+2e+2H+⟺ GOD(FADH2)
GOD(FADH2)+O2→ GOD(FAD)+H2O2
Glucose+GOD(FAD) → Gluconolactone+GOD(FADH2)
图5中曲线a,b分别为GOD/CdTe/CPE在空气饱和与通N220 min除氧状态下PBS中的CV曲线。对比两曲线可见,除氧后还原峰电流明显减小。
2.4.2 GOD/CdTe/CPE对葡萄糖的安培响应 图6为0.20 mol/L PBS(pH 7.0)中葡萄糖在GOD/CdTe/CPE上的计时电流响应曲线。图中曲线a为未添加葡萄糖时的计时电流响应曲线,随着葡萄糖浓度的增加,还原电流逐渐减小(图6 b~d)。催化电流与葡萄糖浓度在0.050~0.32 mmol/L范围内呈线性关系,相关系数(r)为0.995 0(见插图),按3倍信噪比计算得其检出限为0.020 mmol/L。图中还可明显观察到,3 s时计时电流的响应曲线已基本趋于平行,3 s后还原电流几乎不变,表明此GOD修饰的CdTe量子点碳糊电极生物传感器响应速度快。

图5 不同葡萄糖浓度时GOD/CdTe/CPE在0.20 mol/L pH 7.0 PBS中的CV图

图6 不同葡萄糖浓度时GOD/CdTe/CPE在0.20 mol/L pH 7.0 PBS中的安培曲线
2.5 GOD/CdTe/CPE的重现性与稳定性
在含0.16 mmol/L葡萄糖的测试溶液中,用同一支GOD/CdTe/CPE连续测量10次后发现,10次测定结果的相对标准偏差为3.0%,表明电极对葡萄糖具有很好的响应重复性。在该测试溶液中,用同一批次制备的5支不同GOD/CdTe/CPE进行测量,结果发现,5支修饰电极对同一浓度葡萄糖的电流响应相对标准偏差为4.1%,说明这种采用碳糊复合物修饰的电极具有很好的重现性。
进一步将GOD/CdTe/CPE在4 ℃条件下放置1周后,检测其对葡萄糖的响应电流。结果表明,葡萄糖浓度为0.32 mmol/L时,1周后GOD/CdTe/CPE的响应电流仍保持在90%以上,表明GOD/CdTe/CPE有良好的稳定性。
3 结 论
CdTe量子点具备良好的电催化活性,为研究蛋白质的直接电化学提供了一类新的材料,它能有效地加速GOD与电极表面的直接电子转移,电子传递效率比无CdTe量子点存在时提高约8倍。电子转移速率常数(K)为0.14 s-1,传递系数(α)为0.60,GOD在GOD/CdTe/CPE表面的平均覆盖量(Γ)为7.9×10-8mol/cm2。以GOD在CdTe量子点上的直接电化学过程为基础,制作了一种GOD/CdTe纳米复合物碳糊修饰电极,并成功用于葡萄糖浓度的检测,其线性范围为0.050~0.32 mmol/L,检出限为0.020 mmol/L。GOD/CdTe/CPE的制备方法简单,稳定性强,具备优良的选择性和重现性,且响应速度快。这种修饰电极的制备也为第三代电化学生物传感器的研制提供了一种新方法。
[1] Li L.Prog.Biochem.Biophys.(李林.生物化学与生物物理进展),2000,27(3):227-231.
[2] Zhu Y C,Cheng G J,Dong S J.Biophys.Chem.,2000,87(2/3):103-110.
[3] Reed D E,Hawridge F M.Anal.Chem.,1987,59(19):2334-2339.
[4] Liu C,Yuan J G,Wang Y X,Li F,Gao Y H,Han X.FoodandDrug(刘超,袁建国,王元秀,李峰,高艳华,韩省.食品与药品),2010,12(7):285-288.
[5] Gao X J,Wang H S,Cai Q Y.J.Instrum.Anal.(高先娟,王怀生,蔡青云.分析测试学报),2013,32(7):872-876.
[6] Huang X M,Deng X,Wu D,Tang J.J.Instrum.Anal.(黄小梅,邓祥,吴狄,唐婧.分析测试学报),2014,33(3):313-317.
[7] Bruchze Jr M,Moronne M,Gin P,Weiss S,Alivisatos A P.Science,1998,281(4):2013-2016.
[8] Chan W C W,Nie S M.Science,1998,281(5385):2016-2018.
[9] Singh N P,McCoy M T,Tice R R,Schneider E L.Exp.CellRes.,1988,175(1):184-191.
[10] Levin D E,Yamasaki E,Ames B A.MolecularMechanismsMutagenesis,1982,94(2):315-330.
[11] Wang Z,Xu Q,Wang H Q,Yin Z H,Yu J H,Zhao Y D.Anal.Sci.,2009,25(6):773-776.
[12] Lu Q,Hu S S,Pang D W,He Z K.Chem.Commun.,2005,28(20):2584-2585.
[13] Yan W,Zhang A M,Mei Y L,Li H F,Wang H S.Chin.J.Anal.Lab.(闫炜,张爱梅,梅艳丽,李红芳,王怀生.分析试验室),2008,27(12):1-4.
[14] Liang J R,Zhong W Y,Yu J S.Chem.J.Chin.Univ.(梁佳然,钟文英,于俊生.高等学校化学学报),2009,30(1):14-18.
[15] Tinoco I,Sauer K,Wang J C,Puglisi J D.PhysicalChemistry:PrinciplesandApplicationsinBiologicalSciences.Englewood Cliffs,N.J:Prentice-Hall,2001.
[16] Laviron E.J.Electroanal.Chem.,1979,100(1):263-270.
[17] Laviron E.J.Electroanal.Chem.,1979,101(1):19-28.
[18] Poet P D T D,Miyamoto S,Murakami T,Kimura J,Karube I.Anal.Chim.Acta,1990,235(2):255-263.
[19] Garjonyte R,Malinauskas A.Biosens.Bioelectron.,2000,15(9):445-451.
Direct Electrochemistry of Glucose Oxidase at Water-soluble CdTe Quantum Dots
YU Yi,YU Jiu-hong*
(Chemical and Environmental Engineering,Wuhan Polytechnic University,Wuhan 430023,China)
In this paper,a glucose oxidase CdTe quantum dots modified carbon paste electrode(GOD/CdTe/CPE)was prepared by the synthesis of CdTe quantum dots(QDs) to fabricate modified material and fixed the glucose oxidase(GOD) at the surface of the water-soluble CdTe quantum dots,and achieved the direct electrochemistry of GOD at the electrode surface.QDs CdTe can effectively accelerate the direct electron transfer of GOD with the electrode surface,and the electron transfer efficiency was about 8 times more than that in the absence of QDs CdTe.The electron transfer rate constantKwas 0.14 s-1and transfer coefficient was 0.60.The average amount of coverage(Γ) of GOD on the surface of GOD/CdTe/CPE was 7.9×10-8mol/cm2.As a third generation glucose biosensor,GOD/CdTe/CPE was successfully applied in the detection of glucose concentration.The calibration curve was linear in the range of 0.050-0.32 mmol/L and the detection limit was 0.020 mmol/L.GOD/CdTe/CPE had the advantages of simple preparation,strong stability,excellent selectivity and reproducibility,and fast response.
CdTe quantum dots(QDs); glucose oxidase; electrochemical biosensor; cyclic voltammetry(CV);direct electrochemistry
2014-09-02;
2014-09-25
生命分析化学教育部重点实验室开放基金(KLACLS1005)
10.3969/j.issn.1004-4957.2015.02.012
O657.72;F767.4
A
1004-4957(2015)02-0194-06
*通讯作者:喻玖宏,博士,副教授,研究方向:电分析化学,Tel:13098877692,E-mail:yjh@whpu.edu.cn

