纳豆激酶抗脑缺血作用及机制研究
于 良,马菁缨,高 静,刘学阳,纪红蕊
(哈尔滨理工大学 化学与环境工程学院/绿色化工重点实验室,黑龙江 哈尔滨 150040)
纳豆激酶抗脑缺血作用及机制研究
于 良,马菁缨,高 静,刘学阳,纪红蕊*
(哈尔滨理工大学 化学与环境工程学院/绿色化工重点实验室,黑龙江 哈尔滨 150040)
目的:探讨纳豆激酶(NK)脑保护作用的具体机制。方法:通过制备大鼠大脑中动脉阻塞(MCAO)致缺血模型,采用酶联免疫吸附实验、实时定量PCR实验、紫外分光光度法研究纳豆激酶对MCAO大鼠血小板内cAMP含量、对酪氨酸激酶1/信号转导子和转录活化子1(JAK1/STAT1)通路表达、对脑组织SOD和MDA的影响;采用荧光分光光度法检测了NK对凝血酶刺激后人刺激酶小板内钙动员动脉阻塞血小板内钙离子浓度变化。结果:NK显著增加MCAO大鼠血小板内cAMP含量,同时激活损伤部位的JAK1/STAT1通路发挥抗细胞凋亡作用,显著提升了脑组织SOD酶的活力、显著降低了MDA的含量;在体外,抑制凝血酶诱导的血小板内钙离子浓度的增加。结论:NK抗脑缺血作用的机制可能为以下几点:升高环腺苷酸含量、抑制细胞内钙释放产生抗血小板活化作用;提高机体清除自由基的能力,降低脂质过氧化物的含量而抗自由基损伤;激活JAK1/STAT1通路产生抗凋亡作用。
纳豆激酶;环腺苷酸;酪氨酸激酶/信号转导子和转录活化子;自由基
血栓栓塞性疾病是目前全球死亡率占首位的病症,严重危害中老年人生命和健康,且呈年轻化趋势,其发病率和死亡率逐年上升[1]。近年来,抗血栓药物的研究和开发受到广泛关注,预防和治疗血栓栓塞性疾病已经成为当前医药界亟待解决的问题。纳豆激酶(nattokinase,NK)是具有溶解血栓的主要成分——纤维蛋白功能的一种丝氨酸蛋白酶,最初由日本学者须见洋行在纳豆中发现并命名[2]。与传统的抗血栓药物相比,NK具有安全性高、成本低、生产工艺简单、可口服、体内半衰期长等优点,有望成为新一代溶栓药物[3]。目前,NK的研究主要集中在高产菌株的筛选和发酵参数的优化等方面,而其抗脑缺血发挥脑保护作用方面的研究少有报道,本研究分别从第二信使、细胞内钙、自由基损伤、信号通路等几方面探讨NK对脑组织的保护作用,旨在为其合理应用提供理论依据。
1 实验材料
1.1 实验动物
健康Wistar大鼠,雄性,体重250~300g,由哈尔滨医科大学附属第二医院实验动物中心提供。
1.2 实验试剂与药品
纳豆激酶胶囊(荣成百合生物技术有限公司);蚓激酶肠溶片(长春远大国奥制药有限公司);蛋白定量测试盒、SOD测定试剂盒、MDA测定试剂盒(南京建成科技有限公司); cAMP试剂盒(美国Cayman chemical公司);fluo-3钙离子染料(Invitrigen公司),凝血酶(Thrombin)、Apyrase(BioLabs公司);EGTA、Hepes(Amresco公司)。
1.3 实验仪器
opticon2实时定量PCR仪(biorad公司),T6紫外分光光度计(北京普析通用仪器有限公司),JY 92-IIN超声波细胞粉碎机(宁波新芝生物科技股份有限公司),TGL-18C高速台式离心机(上海安亭科学仪器厂),GF-F3000酶标仪(山东高密彩虹分析仪器有限公司),F-4500型荧光分光光度计(日本Hitachi公司)。
2 实验方法
2.1 实验分组
将大鼠随机分为假手术组、模型组、阳性药蚓激酶组(0.4万单位·d-1)、NK高剂量组(9.4mg·d-1)、NK低剂量组(4.7mg·d-1)组,药物均溶解于生理盐水中,给药组动物分别于再灌注6h之内、24h、48h,经口给药,末次给药后4h内处死大鼠,取血,取脑;假手术组与模型组给予等量的生理盐水,分别在再灌注24h处死大鼠,取血,取脑。
2.2 大鼠大脑中动脉阻塞模型(middle cerebral artery occlusion,MCAO)制备
Wistar大鼠水合氯醛(10%,0.35mg/kg)麻醉后,仰卧固定,分离右侧颈总动脉(common carotid artery,CCA)、颈内动脉(interal carotid artery,ICA)及颈外动脉(exteral carotid artery,ECA),结扎ECA与CCA,用动脉夹夹闭ICA远心端后,迅速于距ECA与ICA分叉处约0.5cm的颈总动脉处作一切口,插入一端涂有石蜡的渔线(直径为0.234mm),插入深度为(18.5±0.5)mm,实现大脑中动脉阻塞导致脑缺血。结扎入口处,渔线外留约1cm,缝合皮肤。2h后轻轻提拉所留线头至略有阻力以实现大脑中动脉再灌注。在缺血2h和再灌注时间内用电热毯维持大鼠肛温在36.5~37.5 ℃。假手术组大鼠分离颈总动脉、颈内动脉及颈外动脉,但只结扎CCA。
大鼠大脑中动脉阻塞形成缺血,2h后实现再灌注,模型稳定24h后,处死大鼠,迅速取脑取血。
2.3 大鼠洗涤血小板制备
大鼠固定后,从其右侧颈总动脉取血,柠檬酸钠(3.8%,1∶9v/v)抗凝,800rpm离心20min,取上清得富血小板血浆(platelet-rich plasma,PRP),加入apyrase 1μL/mL,PRP 2 000rpm离心10min,沉淀用含0.35% BSA的Tyrode's buffer悬浮,然后用Tyrode's buffer洗涤2次,最后血小板用匀浆缓冲液重悬,得洗涤血小板(washed platelet,WP),调整血小板计数为3.0×108/mL,置-80℃保存。
2.4 NK对MCAO大鼠脑组织SOD、MDA的影响
各不同处理组大鼠再灌注24h后,脱臼处死,取右脑大脑皮层组织,用冰冷的生理盐水制备10%的脑组织匀浆,3 000r/min离心10min。上清液-20℃冷冻保存。按照试剂盒说明书分别在595nm 、532nm处,使用紫外分光光度计对脑组织SOD活力、MDA含量进行检测。
2.5 ELLSA法检测NK对MCAO大鼠洗涤血小板cAMP含量的变化
冰冻保存的WP用超声破碎仪粉碎,30sec/mL,匀浆产物2 500rpm离心10min,取上清。上清适当稀释后按照试剂盒说明用乙酰化ELISA法检测cAMP含量。
2.6 Real-Time PCR法检测NK对大鼠脑组织JAK1/STAT1表达的变化
使用Trizol法对脑组织RNA 进行提取,电泳检查RNA的完整性,紫外分光光度仪测出每个样品RNA的浓度后,用Rnase Free H2O稀释至浓度为1μg/μL。引物序列见表1。然后进行反转录和定量PCR。反应条件为:95℃,10min;95℃,10s;60℃,10s;72℃,30s。共35cycles。制作扩增曲线、标准曲线、融解曲线,记录数值,使用JAK1/STAT1均一化数值进行统计。

表1 引物设计及合成
2.7 荧光分光光度法检测NK对Thrombin 诱导人血小板内钙离子变化的影响
制备正常健康志愿者的PRP(含apyrase 1μL/mL),PRP 2 000rpm离心10 min,得到的片状沉淀用无钙的Hepes buffer洗涤2次,重悬,得洗涤血小板(WP),调整血小板计数为2×109/mL。加入BSA(终浓度为1.5g/L),WP于37℃与fura-3/AM (5μmol/L,溶解于DMSO)孵育40min,然后悬浮于无钙的Hepes buffer,终浓度为2×106platelets/mL。悬浮的WP分别进行如下处理,诱导组:WP与0.5U/mL的thrombin在37℃孵育4min;NK的25μg/mL,50μg/mL和100μg/mL剂量组分别先与WP在37℃孵育10min,再加入0.5U/mL的thrombin于37℃共同孵育4min。之后,不同处理组的WP离心、洗涤、重悬。使用F-4500型荧光分光光度计测量钙离子的浓度,发射波长:506nm,分别记录激发波长在400~800nm的数值。
按照下面公式(1)计算Ca含量,其中,[Ca2+]Free为游离钙离子的浓度,Kd为Fluo-3Ca2+的有效解离常数,在生理条件下其值为325nmol/L;F、Fmax和Fmin均为λex=506nm、λem=460nm时测得的荧光强度;F为Fluo-3与细胞温育后细胞悬液的荧光强度;Fmax为最大荧光强度,即细胞悬液在测定F值后,加入Triton X-100破坏细胞膜,使细胞内尚未与Ca2+结合的Fluo-3被Ca2+完全饱和所测得的荧光强度;Fmin为最小荧光值,即细胞悬液在测定Fmax值后,加入EGTA配合溶液中全部Ca2+,使Fluo-3呈游离状态所测得的荧光强度。
公式(1)
悬浮于含钙的Hepes buffer中的WP操作同上,同样记录其在激发波长400~800nm的数值,记录[Ca2+]i。
2.8 实验数据处理
实验数据用SPSS13.0软件进行统计处理,实验结果采用单因素方差进行分析,以均值加减标准差表示,组间差异采用SNT方法比较。P<0.05为差异有统计学意义。
3 实验结果
3.1 NK对MCAO鼠脑组织SOD、MDA的作用
由表2可以看出,经SPSS13.0软件分析,与模型组比较,假手术组、NK高剂量组、LK组的SOD酶活力显著增强(P<0.05),而MDA含量显著下降,且NK高剂量组和LK组无显著性差异。

表2 NK 对MCAO鼠脑组织SOD 和MDA 的作用 (±s,n=5)
注:与模型组比较,*P<0.05。
3.2 NK对MCAO鼠洗涤血小板cAMP含量的影响
采用ELISA法检测洗涤血小板内cAMP含量,经ANOVA分析,与模型组相比较,高剂量NK、低剂量NK均可使血小板内cAMP含量显著升高。且高剂量NK组与LK组相比较无显著性差异。

表3 NK对MCAO鼠血小板cAMP含量的影响 (±s,n=5)
注:与模型组比较,*P<0.05。
3.3 NK对MCAO大鼠脑组织JAK1、STAT1 PCR表达的影响
采用Real-Time PCR法分析了NK对缺血再灌注大鼠脑组织JAK1/STAT1的影响,其扩增曲线、标准曲线、融解曲线结果良好,使用JAK1/STAT1均一化数值进行统计,结果显示,与模型组JAK1相比较,假手术组显著下降,NK高剂量、中剂量、LK组均显著升高,并且NK高剂量组与LK组无显著性差异。与模型组STAT1相比较,假手术组显著下降,NK高剂量显著下降,见表4。

表4 NK对MCAO大鼠脑组织JAK、STAT1 PCR表达的影响 (±s,n=4)
注:与模型组比较,*P<0.05,**P<0.01。
3.4 NK对人洗涤血小板Ca2+含量的影响
在血小板活化过程中,钙离子动员起到了关键的作用,因此检测了NK对Thrombin诱导人血小板内钙离子变化的影响。在含钙Hepes buffer中,与凝血酶诱导组钙离子浓度相比,空白对照组显著降低,NK高中剂量组预处理10min,显著降低,见表5。此外,还检测了无钙Hepes buffer中NK对Thrombin 诱导大鼠血小板内钙离子的变化,凝血酶诱导钙离子浓度值与含钙Hepes buffer中相比无显著性差异(P>0.05),比较NK对细胞外液中含Ca2+和不含Ca2+时[Ca2+]i的影响,结果无显著差异(P>0.05)。

表5 在含钙液中NK对人洗涤血小板Ca2+含量的影响 (±s,n=5)
注:与凝血酶诱导组比较,**P<0.01。
4 讨论
SOD对于机体防御内、外环境中自由基损伤起着重要作用,是衡量自由基基础代谢状态的重要指标。MDA水平升高,SOD活性降低,即可引发氧化应激过程,会导致细胞受到损害甚至细胞死亡[4]。NK高剂量组中MDA含量显著下降和SOD活力增强,说明NK能够抗细胞损伤,防止氧化应激的发生。
有研究表明,蛋白酪氦酸激酶JAKl在哺乳动物大脑的发育和成熟阶段能够持续表达[5-6]。JAK-STAT通路的确对前脑的发育过程起到了重要作用[7]。本研究发现,假手术大鼠脑组织中JAKl、STATl均有发现,但缺血再灌注损伤后能进一步表达,模型组大鼠表达明显高于假手术组,提示脑缺血再灌注损伤可诱发JAKl、STAT1的表达,它们的高表达,表明它们可能与脑缺血后神经细胞生存与凋亡的基因调控过程有关,目前主要认为JAKl和抗细胞凋亡有关,而STATl与诱导细胞凋亡有关。推测NK可能通过诱导JAKl mRNA高表达发挥其抗凋亡作用,通过降低STAT1mRNA表达而减轻其诱导神经元的凋亡作用,从而保护缺血神经元的损伤。
环核苷酸(cAMP)是重要的细胞内第二信使,血小板的活化往往伴随着胞浆环核苷酸水平的降低,通过提升其内的环核苷酸水平可抑制血小板聚集[8]。实验结果显示NK高中剂量组均可以显著提高血小板cAMP水平,从而达到抑制血小板聚集的作用。
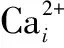
综上所述,通过体内体外研究,我们发现NK可以提升机体清除自由基的能力;可以激活大鼠大脑中动脉阻塞模型损伤部位的JAK1 mRNA的表达、抑制STAT1 mRNA的表达;可以直接通过升高大脑中动脉阻塞模型鼠血小板cAMP含量、抑制凝血酶诱导的血小板内钙离子浓度的升高而发挥脑保护作用。
[1] STRONG K,MATHERS C,BONITA R.Preventing stroke:saving lives around the world[J].Lancet Neurology,2007,6(2):182-187.
[2] SUMI H,HAMADA H,TSUSHIMA H,et al.Anovel fibrinolytic enzyme (nattokinase) in the vegetable cheese natto;a typical and popular soybean food in the Japanese diet[J].Experientia.,1987,43(20):1110-1111.
[3] FUJITA M,OHNISHI K,TAKAOKA S,et al.Antihypertensive effects of continuous oral administration of nattokinase and its fragments in spontaneously hypertensive rats.biol.pharm[J].Bull,2011,34(11):1696-1701.
[4] DEMIR I,KIYMAZ N,GUDU BO,et al.Study of the neuroprotective effect of ginseng on superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) levels in experimental diffuse head trauma[J].Acta Neurochirurgica,2013,155(5):913-922
[5] JASON SR,KRISTIN MR,DOUGLAS AH.The JAK/STAT signaling pathway[J].J Cell Sci,2004,117(Pt8):1281-1283.
[6] DEBRA LS,ERIKA RG,DENISE JM.Requirement for JAK/STAT signaling throughout border cell migration in Drosophila[J].Development,2005,132(15):3483-92.
[7] FLAHERTY MS,SALIS P,EVANS C,et al.Chinmo is a functional effector of the JAK/STAT pathway that regulates eye development,tumor formation,and stem cell self-renewal in Drosophila[J].Dev Cell,2010,18(4):556-568.
[8] BHATTACHARYYA M,KARMOHAPATRA SK,BHATTACHARYA G,et al.The role of leucocytes in the acetyl salicylic acid (aspirin) induced nitric oxide synthesis in the production of interferon-α,a potent inhibitor of platelet aggregation and a thrombolytic agent[J].Journal of Thrombosis and Thrombolysis,2009,28(2):173-184.
[9] GUPTA S,REVIAKINE I.Platelet activation profiles on TiO2:effect of Ca2+binding to the surface[J].Biointerphases,2012,7(1-4):1-12.
(责任编辑:宋勇刚)
2015-06-02
黑龙江省大学生创新实验项目(12521078)
于良(1994-),男,哈尔滨理工大学在读生,研究方向为心血管药理学、毒理学。
纪红蕊(1978-),女,哈尔滨理工大学博士研究生,研究方向为心血管药理学、毒理学。E-mail:jihongrui720@126.com
R743.33
A
1673-2197(2015)21-0010-03
10.11954/ytctyy.201521004

