泽泻汤对Ox-LDL介导的血管平滑肌细胞SM22a表达的影响
邓阳阳,魏 伟,陈 彤, 薛偕华
(1.福建中医药大学,福建 福州 350122;2.福建中医药大学附属康复医院,福建 福州 350003)
泽泻汤对Ox-LDL介导的血管平滑肌细胞SM22a表达的影响
邓阳阳1,魏 伟2,陈 彤1, 薛偕华2
(1.福建中医药大学,福建 福州 350122;2.福建中医药大学附属康复医院,福建 福州 350003)
目的:观察泽泻汤对VSMCs标志性蛋白SM22a表达的影响,研究其在抑制VSMCs表型转化方面的作用。方法:用Ox- LDL(0.05mg/mL)处理大鼠VSMCs 24h,经泽泻汤醇提取物低中高浓度(0.075mg/mL、0.3mg/mL、0.6mg/mL)干预24h,免疫细胞化学法检测表型转化标志性蛋白SM22a的表达情况。结果:与空白组比较,模型组(Ox-LDL诱导)SM22a表达明显降低(P<0.05);经泽泻汤干预后,SM22a蛋白表达水平较模型组显著增加(P<0.05),且随浓度增高呈递增趋势(P<0.05)。结论:泽泻汤能明显上调表型转化标志蛋白SM22a的表达,表明泽泻汤有一定的抑制VSMCs表型转化的作用。
泽泻汤;动脉粥样硬化;血管平滑肌细胞;表型转化
动脉粥样硬化(Athmsclerosis,AS)的发病率逐年升高,已经成为严重影响人类健康的疾病之一,且近年来有年轻化的趋势。血管平滑肌细胞(Vascular Smooth Muscle Cells,VSMCs)的活化、迁移与增殖是AS病变发展的必要条件[1]。而众多研究表明,VSMCs由收缩型转化为合成型是VSMCs获得病理性迁移和增殖的先决条件[2],同时合成型VSMCs合成与分泌各种细胞因子和细胞外基质,在AS斑块形成和发生发展过程中发挥重要作用。因此对VSMCs表型转化进行研究,对AS的防治具有重要意义。 泽泻汤由泽泻、白术配伍组成,为历代医家治疗痰饮眩晕的效方。现代临床及实验研究表明,本方具有利水、改善循环、降脂、抗AS等药理作用,应用范围较为广泛,但对其抗AS发病机理中VSMCs表型转化的影响研究较少。因此本实验采用Ox-LDL诱导体外培养VSMCs,经不同浓度泽泻汤干预后,观察其对VSMCs表型转化能力的影响,研究其对抑制VSMCs 表型转化的作用,为泽泻汤的抗AS作用提供实验和临床研究依据。
1 材料与仪器
1.1 动物及药物
清洁级SD雄性大鼠40只,购自福建医科大学实验动物中心[许可证号:SCXK(闽)2012-0001]。泽泻汤方:泽泻60g,白术30g,购自福建中医药大学附属康复医院药剂科。泽泻、白术剂量严格按《金匮要略》 原方剂量比例制剂并提供,以上药物均经鉴定,符合《中华人民共和国药典》(一部)2005年版有关规定。
1.2 仪器与试剂
DMEM/F12培养基购自Hyclone有限公司;胎牛血清购自FAA有限公司;氧化型低密度脂蛋白(Ox-LDL,1.67mg/L)购自北京协生生物科技公司;SM22a抗体购自Abcam公司;DAB免疫组化试剂盒购自福州迈新生物技术有限公司;细胞培养箱(Therom公司,美国);Leica DM IL LED倒置显微镜。
2 方法与结果
2.1 方法
2.1.1 大鼠VSMC分离培养 颈椎脱臼处死大鼠,无菌条件下,取颈总动脉,放于含1%双抗的20%胎牛血清的DMEM/F12培养基的培养皿中,剥离外层成纤维细胞、内层内皮细胞,剪碎VSMCs后,将其置于1.5mLEP管中,加入500μL II性胶原酶,放入37℃培养箱中过夜后,将EP管中组织液转移至25cm2培养瓶中,加入3mL 1%双抗的20%胎牛血清的DMEM/F12的培养基,置于37℃培养箱中培养。 待细胞融合至80%时,0.25%胰酶消化传代, 取6~8代细胞进行试验。
2.1.2 泽泻汤制备 按照中药醇提法提取泽泻汤,泽泻汤复方90g(泽泻60g,白术30g),按上述组方称取药材,加8倍量75%乙醇浸泡0.5h,加热回流2次,每次1.5h,过滤,滤液合并,旋转蒸发仪减压浓缩,真空干燥成浸膏约15g,-20℃冻存备用。精密称取泽泻汤醇提取浸膏20.6mg,加2.06mL超纯水溶解,超声30min,0.22μm滤膜过滤,配制成10mg/mL母夜。以无双抗20%胎牛血清的培养基分别稀释成0.075mg/mL、0.3mg/mL、0.6mg/mL作为干预培养基。
2.1.3 细胞干预分组 实验分为三组:空白组:大鼠VSMCs+无双抗20%培养基,培养24 h。模型组:大鼠VSMCs +含Ox-LDL (0.05mg/mL)的无双抗20%培养基,培养24h。泽泻汤干预组(低、中、高剂量组):大鼠VSMCs +含Ox-LDL (0.05mg/mL)和泽泻汤低中高浓度(0.075mg/m、0.3mg/mL、0.6mg/mL)无双抗20%培养基,培养24h。
2.1.4 免疫细胞化学法检测SM22a表达 分组和处理方法同“2.1.3”项, 严格按照试剂盒说明书操作方法进行。采用SM22a阳性染色以胞质出现棕黄色或棕褐色为准。选染色均匀的区域,在100倍视野下,取阳性平均灰度值做统计分析。

2.2 结果
与空白组比较,模型组SM22a表达明显降低(P<0.05);与模型组比较,泽泻汤组SM22a表达显著增加,且随泽泻汤浓度增高呈升高趋势(P<0.05)。见图1、表1。

图1 免疫细胞化学法检测SM22a表达 (×200)
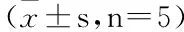

组别SM22a阳性平均灰度值空白组98.180±1.734*模型组(Ox-LDL0.05mg/mL)58.276±0.824泽泻汤低剂量组(0.075mg/mL)69.199±0.351*泽泻汤中剂量组(0.3mg/mL)74.260±1.083*△泽泻汤高剂量组(0.6mg/mL)83.846±1.310*△◇
注:与模型组比较,*P<0.05;与低剂量组比较,△P<0.05;与中剂量组比较,◇P<0.05。
3 讨论
动脉粥样硬化(atherosclerosls,AS)是西方发达国家的主要死亡原因[3],随着我国人民生活水平提高和饮食习惯的改变,该病也逐渐成为主要死因。AS的发生机制十分复杂,目前认为多种细胞参与AS病变的形成,包括巨噬细胞、淋巴细胞、内皮细胞和VSMCs[4]。VSMCs是一种高度特化的细胞,具有收缩型和合成型2种表型[5],细胞表型决定了细胞的生物学特性和功能。正常VSMCs为收缩型,细胞呈纺锤形,含有丰富的肌丝和结构蛋白,主要维持动脉管壁的正常功能,无增殖以及迁移能力;合成型VSMCs分化程度低或未分化,呈扁平形,肌丝和结构蛋白含量少,与合成有关的细胞器丰富,分化、增殖以及合成和分泌基质蛋白能力强,并可迁移入内膜,形成相关病理改变。在多种病理因素的作用下,VSMCs的表型可由收缩型转化为合成型[6],此过程称为表型转化。SM22a是近年发现的一种VSMCs表型标志基因,仅在收缩型VSMCs中高表达,具有高度特异性[7-8]。焦磊等[9]以氧化型低密度脂蛋白(Ox-LDL)作用于VSMCs,结果显示SM22a表达下调,表明Ox-LDL促进了VSMCs由收缩型向合成型转化。本实验以Ox-LDL(0.05mg/mL)体外诱导VSMCs,免疫细胞化学检测SM22a的表达,结果亦显示,与空白组相比,模型组SM22a表达明显降低。
近年来中药在抑制VSMCs的表型转化方面研究越来越受到关注,李琦等[10]研究发现黄芪和当归不仅能抑制bFGF诱导的VSMCs增殖, 而且还可有效逆转bFGF诱导的VSMCs表型转化。车贤达等[11]研究发现麝香保心丸能促使血管平滑肌细胞的表型从合成型向收缩型转化。 泽泻汤出自东汉张仲景《金匮要略》,现代临床及实验研究表明,泽泻汤具有利水、改善循环、降脂、抗AS等药理作用,应用范围较为广泛。王玉仙等[12]应用泽泻汤加味治疗高脂血症,发现该方可改善临床症状,而且能调节患者血脂水平。但是泽泻汤对VSMCs表型转化影响方面还未见研究,本实验在Ox-LDL处理VSMCs的基础上予以泽泻汤干预后,结果显示,与较模型组对比,其SM22a表达显著上调,并且呈一定的浓度依赖性。
综上所述,本研究表明,Ox-LDL促进了VSMCs由收缩型向合成型转化,而泽泻汤具有抑制VSMCs表型转化的作用,从而发挥其抗AS作用。对于泽泻汤通过何种途径来抑制VSMCs的表型转化,还需要进一步研究。
[1] MALLAT Z,TEDGUIA.The role of transforming growth factor beta in athero-Sclerosis:novel insights and futurv perspectives[J].Curr opin Lipidol,2002(13):523-529.
[2] LAVIGNE MC,RAMWELL PW,CLARKE R.Growth and phenotypic characterization of porcine coronary artery smoothmuscle cells[J].In Vitro Cell Dev Biol Anim,1999,35(3):1136-143.
[3] ROGER VL,GO AS,LLOYD-JONES DM,et al.Heart disease and stroke statistics-2011 update :A report from the American heart association[J].Circulation,2011,123 (4): e18-e209.
[4] LUSIS AJ.Atheroclerosis[J].Nature,2000,407(6801):233-241.
[5] 张英民,党红波,王克强,等.ET-1促进人血管平滑肌细胞的表型变化和增殖[J].解剖学杂志,2003,26(3):215-218.
[6] PIDKOVKA NA,CHEREPANOVA OA,YOSHIDA T,et al. Oxidized phospholipids induce phenotypic switching of vascular smooth muscle cells in vivo and in vitro[J].Circ Res, 2007,101(8):792-801.
[7] 程云会,韩梅,温进坤.SM22a:血管平滑肌细胞分化的分子标志[J].细胞生物学杂志,2004,26(3):281-284.
[8] XUE YAN YANG, JI HUA YAO,LU CHENG ,et a1.Molecular cloning and expression of a smooth muscle-specific gene SM22alpha in zebrafish[J].Biochem Biophy Res Comm-Un,2003,31(3):741-746.
[9] LEI JIAO,MIN CHEN WANG, YA AN YANG,et al.Norepinephrine reversibly regula-tes the proliferation and phenotypic transformation of vascular smooth muscle cells[J].Exp Mol Pathol,2008,85(3):196-200.
[10] 李琦,温进坤,韩梅.黄芪和当归对血管平滑肌细胞表型标志基因表达和细胞增殖的影响[J].中国动脉硬化杂志,2004,12(2):147-150.
[11] 车贤达, SIMON X LIANG ,XINGMAI JIANG,等.麝香保心丸对血管平滑肌细胞表型转化的影响[J].中国病理生理杂志,2010,26(11):2149-2154.
[12] 王玉仙,马学荣.泽泻汤加味治疗高脂血症103例[J].陕西中医,2005,26(2):103-104.
(责任编辑:宋勇刚)
2014-12-20
国家自然科学基金项目(81473744);福建省卫生厅中医药科研项目(WZSY201304);福建省卫生系统中青年骨干人才培养项目 (2013-ZQN-20-28)
邓阳阳(1986-),女 ,福建中医药大学硕士研究生,研究方向为脑血管疾病的基础与临床研究。
薛偕华(1978-),男,福建中医药大学附属康复医院主任医师,副教授,研究方向为脑血管疾病的基础与临床研究。
R285.5;R972+.6
A
1673-2197(2015)05-0008-02
10.11954/ytctyy.201505004

