响应曲面法优化蜗牛酶辅助提取黑木耳多糖工艺
杨春瑜,刘海玲,杨春莉,景志刚,徐晓鑫,翟 森
(1.哈尔滨商业大学食品工程学院,黑龙江省食品科学与工程重点实验室,黑龙江哈尔滨150076;2.哈尔滨商业大学轻工学院,黑龙江哈尔滨150028;3.黑龙江省玄鸟生物科技有限公司,黑龙江哈尔滨164831)
响应曲面法优化蜗牛酶辅助提取黑木耳多糖工艺
杨春瑜1,刘海玲1,杨春莉2,景志刚1,徐晓鑫3,翟 森1
(1.哈尔滨商业大学食品工程学院,黑龙江省食品科学与工程重点实验室,黑龙江哈尔滨150076;2.哈尔滨商业大学轻工学院,黑龙江哈尔滨150028;3.黑龙江省玄鸟生物科技有限公司,黑龙江哈尔滨164831)
以黑木耳超微粉为原料,采用蜗牛酶酶解法,在单因素实验的基础上,采用响应曲面法对黑木耳多糖的酶提工艺进行优化。结果表明:酶解时间2.5 h,酶解温度为55.0℃,pH为6.8,酶的添加量为1.3%。在此条件下,多糖得率为31.1%,与理论预测值30.34%的相对误差约为0.76%,重现性良好。说明通过响应曲面优化得到的回归方程具有一定的实践指导意义。
黑木耳,多糖,超微粉碎,蜗牛酶,响应曲面
黑木耳营养成分中主要的活性物质是多糖[1-2],黑木耳多糖具有许多生理活性,如:抗肿瘤、抗氧化、降血脂、降血糖和增强免疫等作用[3]。目前,在正常中性水提条件下,黑木耳多糖的得率不高,集中在10%左右。通过细胞壁破碎,可以促进内容物溶出,提高黑木耳多糖的得率[4]。超微粉碎、酶法和碱法降解均可以使黑木耳细胞壁破碎,多糖溶出率明显提高[5]。
黑木耳属于陆生真菌,其细胞壁的主要组成成分有葡聚糖、甘露聚糖和几丁质等,而蜗牛酶这种复合酶能同时降解葡聚糖、甘露聚糖和几丁质等[6]。因此,将蜗牛酶用于真菌黑木耳的破壁,能使其细胞内的活性物质多糖更好地释放出来[7-10],同时结合机械法超微粉碎进行黑木耳细胞破壁,可以进一步提高多糖的得率。本文以黑木耳超微粉为原料,采用蜗牛酶解法,以酶解时间、酶解温度、酶解pH、酶的添加量为变量因素,在单因素实验的基础上,采用响应曲面实验对黑木耳多糖的酶提工艺进行优化。
1 材料与方法
1.1 材料与仪器
黑木耳 黑龙江省方正县林业局提供;蜗牛酶(破壁率80%~90%、最适pH5.8~7.2) 中国生物技术有限公司;氢氧化钠(AR)、浓硫酸(AR)、苯酚(AR)天津市化学试剂三厂。
LG10-2.4A型高速离心机 北京京立离心机有限公司;ESJ120-4电子天平 沈阳龙腾电子称量仪器公司;LK-2000A摇摆式高速中药粉碎机 新昌县城关红利数控制造厂;721E型可见光光度计 上海天美科学仪器有限公司;78-1型磁力加热搅拌器 上海南江电汎器材厂;DK-98-I型电子恒温水浴 天津泰斯特仪器公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;DHG-9203A型电热恒温鼓风干燥箱 上海一恒科技有限公司;CJM超细粉碎机 宜兴市宏达通用设备有限公司。
1.2 实验方法
1.2.1 黑木耳超微粉的制备 将黑木耳原料用摇摆式高速中药粉碎机粉碎,过100目筛后得到的粗粉用超微粉碎机进行粉碎,即得到黑木耳超微粉。黑木耳超微粉用乙醚脱脂,索氏提取6 h,乙醚挥发干净后,贮存干燥通风条件下,储存备用。
1.2.2 黑木耳多糖的提取 取0.1 g黑木耳超微粉置于试管中,加入10 mL蒸馏水,浸泡12 h。加入0.001 g蜗牛酶,分别以酶解时间、酶解温度、酶解pH、酶添加量为变量因素,然后加入4.4 mol/L NaOH溶液1 mL,温度升高至80℃,提取2 h,4100 r/min离心30 min,测上清液中糖含量。
1.2.3 单因素实验设计
1.2.3.1 酶解时间对多糖得率的影响 固定酶解温度为40℃、酶解pH为7、酶的添加量为0.1%,研究酶解时间0.5、1.0、1.5、2.0、2.5 h时的多糖得率,重复3次实验。
1.2.3.2 酶解温度对多糖得率的影响 固定酶解时间为1 h、酶解pH为7、酶的添加量为0.1%,研究酶解温度为35、40、45、50、55℃时的多糖得率。重复3次实验。
1.2.3.3 酶解pH对多糖得率的影响 固定酶解温度为40℃、酶解时间1 h、酶的添加量为0.1%,研究酶解pH为4、5、6、7、8时的多糖得率。重复3次实验。
1.2.3.4 酶的添加量对多糖得率的影响 固定酶解温度为40℃、酶解pH为7、酶解时间1 h,研究酶的添加量0.5%、1.0%、1.5%、2.0%、2.5%时的多糖得率。重复3次实验。
1.2.4 响应面实验设计 以酶解时间、酶解温度、酶解pH、酶的添加量为变量,多糖得率为指标,进行响应曲面实验,实验因素水平编码见表1。
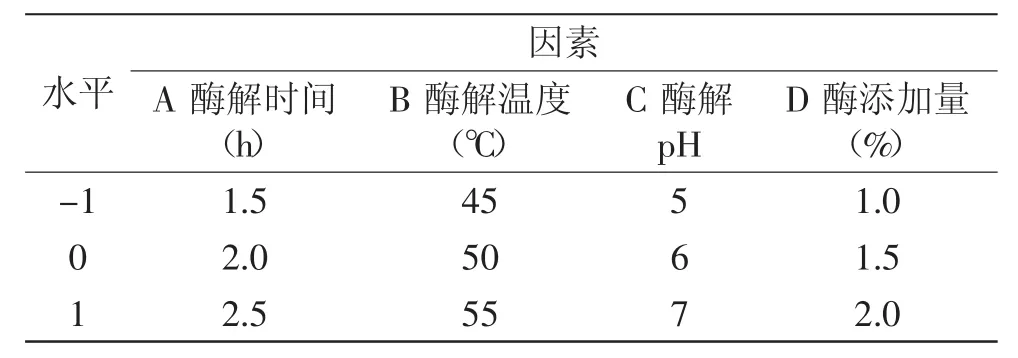
表1 响应面实验因素水平编码表Table 1 Factors and levels of response surface experiments
1.2.5 葡萄糖标准曲线的制作 精密称取105℃干燥至恒重的葡萄糖标准品10.0000 mg,置于250 mL容量瓶中,加水溶解并定容,摇匀,即可得到浓度为0.04 mg·mL-1的葡萄糖标准溶液[13]。准确称取苯酚6 g于烧杯中,加水至100 mL,置于棕色瓶中,摇匀,备用。分别吸取0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mL葡萄糖标准液于9支试管中,各以水补至2.0 mL,然后分别加入6%苯酚1.0 mL,摇匀,迅速滴加浓硫酸5.0 mL,迅速摇匀,静置10 min,摇匀,室温放置20 min,用可见光分光光度计于490 nm处测其吸光度,以2.0 mL水按同样显色操作为空白(10只试管),以横坐标为多糖浓度,纵坐标为光密度值,得标准曲线。
1.2.6 多糖含量的测定 采用苯酚硫酸法。分别取离心后的上清液1 mL于试管中,样品根据实际情况稀释倍数100倍。用水补至2.0 mL,然后分别加入6%苯酚1.0 mL,摇匀,迅速滴加浓硫酸5.0 mL,迅速摇匀,静置10 min,摇匀,室温放置20 min,用可见光分光光度计于490 nm处测其吸光度,以2.0 mL水按同样显色操作为空白对照。根据样品的OD值,计算出样品中糖的浓度。多糖得率计算公式:

式中:X—黑木耳多糖得率(%);C—上清液多糖浓度(mg/mL);V—上清液体积(mL);M—黑木耳粉的质量(mg)。
1.3 数据处理
本文采用Design Expert软件对数据进行分析,根据Box-Behnken中心组合设计实验,并对结果进行数据分析。
2 结果与分析
2.1 葡萄糖标准曲线
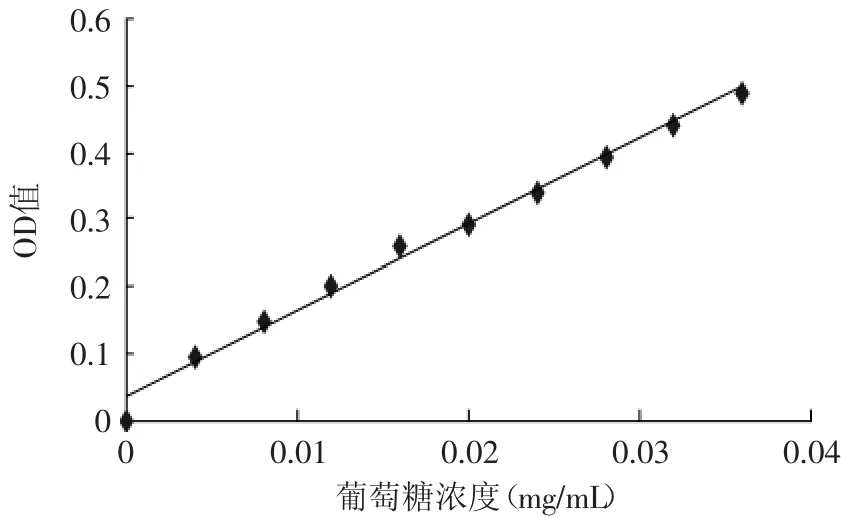
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
标准曲线见图1,回归方程为y=12.852x+0.0347,方程的拟和度R2=0.9905。
2.2 单因素实验
2.2.1 酶解时间对多糖得率的影响 如图2所示,酶解0.5、1.0、1.5、2.0、2.5 h时,多糖的得率分别为14.12%、15.40%、20.83%、23.21%、21.17%。随着酶解时间的增加,酶的作用于细胞壁的效果达到最大,多糖的得率明显升高,当酶解2 h时,多糖得率达到最大,之后酶的作用开始减弱,产物的生成对反应体系造成了抑制作用,又开始下降。可见,酶解的时间可以确定在2 h左右。
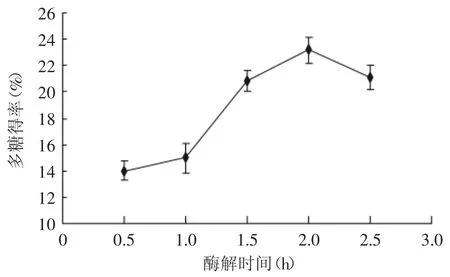
图2 酶解时间对多糖得率的影响Fig.2 Enzymolysis time effect on yield of polysaccharide
2.2.2 酶解温度对多糖得率的影响 如图3所示,在35、40、45、50、55℃下进行酶解,得到的多糖得率分别为7.58%、14.48%、18.65%、23.78%、14.71%。随着酶解温度的增加,酶作用于细胞壁的效果越好,细胞壁裂解的越多,使多糖更容易的释放出来,多糖的得率明显升高,当温度为50℃时,多糖得率达到最大值,之后温度继续升高,超过了酶的最适温度,多糖得率开始下降。可见,酶解的温度,确定在50℃左右为宜。

图3 酶解温度对多糖得率的影响Fig.3 Enzymolysis temperature effect on yield of polysaccharide
2.2.3 酶解pH对多糖得率的影响 如图4所示,pH为4、5、6、7、8时得到的多糖得率分别为10.01%、11.12%、25.31%、22.32%、16.47%,随着酶解pH的升高,越趋近于蜗牛酶最适pH(5.8~7.2),使得多糖得率升高。当pH为6时,多糖得率达到最大值,随着pH的继续升高,超出最适pH范围,多糖的得率开始下降,因此,pH为6左右时为最佳的pH范围。

图4 酶解pH对多糖得率的影响Fig.4 Enzymolysis pH effect on yield of polysaccharide
2.2.4 酶的添加量对多糖得率的影响 如图5所示,蜗牛酶的添加量0.5、1、1.5、2、2.5%时,多糖的得率分别为16.71%、21.40%、27.51%、20.57%、21.2%。随着蜗牛酶添加量的增加,酶逐渐作用于黑木耳的细胞壁,多糖的得率也相应的升高,当蜗牛酶的添加量为1.5%时,多糖的得率达到最高,之后随蜗牛酶添加量的升高,细胞壁被完全水解,多糖得率逐渐趋于平稳。可见蜗牛酶最适添加量在1.5%左右为宜。
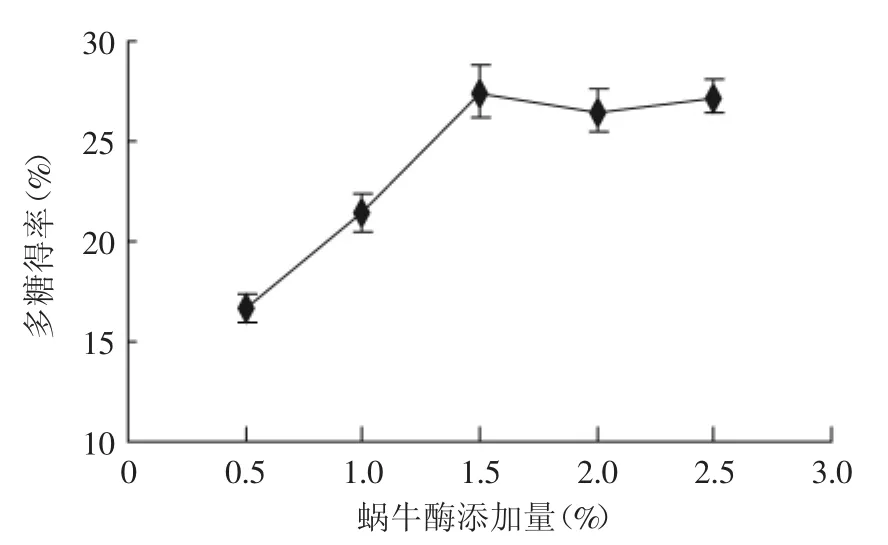
图5 酶的添加量对多糖得率的影响Fig.5 Enzymolysis addition effect on yield of polysaccharide
2.3 响应曲面提取条件的优化
2.3.1 响应曲面实验设计及结果 在单因素实验基础上,根据Box-Behnken中心组合实验设计原理,以酶解时间、酶解温度、加酶量、酶解pH为因子,多糖得率为响应值,设计4因素3水平的响应面实验,结果见表2。
使用Design Expert 7.0软件[14-15],对表2数据进行处理,得到表3回归方程方差分析表,利用软件进行非线性回归的二次多项式拟合,得到预测模型如下:
Y=-646.74333+0.94333A+23.95367B+2.52667C+71.46667D+1.10400AB+2.24000AC-14.26000AD+0.65000BC-0.050000BD+2.18000CD-11.93333A2-0.29503B2-3.39083C2-18.53333D2
回归方差分析显著性检验表明,该模型回归显著(p<0.05),失拟项不显著,且该模型R2=0.9785,说明该模型与实际实验拟合较好,自变量与响应值之间线性关系显著,可以用于黑木耳多糖提取工艺实验的预测。
方程的一次项B对响应值的影响显著,二次项B(酶解温度)、C(酶解pH)、D(酶添加量)对响应值的影响显著。由此可见,各具体实验因素对响应值的影响不是简单的的线性关系[16-18]。
各因素的影响程度分析,各因素的F值可以反映因素对实验指标的重要性,F值越大,表明对实验指标的影响越大,即重要性越大,从方差分析表可知:FA=0.043,FB=4.72,FC=3.52,FD=0.87,即各因素对黑木耳多糖得率影响程度大小顺序为:酶解温度>酶解pH>酶添加量>酶解时间。
根据回归方程,做出响应曲面分析图(图6~图11),考察所拟合的相应曲面的形状,分析酶解时间、酶解温度、解pH、酶的添加量对黑木耳多糖得率的影响。

表2 Box-Behnken实验设计及结果Table 2 Results of response surface experiments of Box-Behnken
2.3.2 各因素之间的交互作用 图6中可见,酶解温度固定不变值时,多糖得率随酶解时间增加先缓慢增加后降低。酶解时间固定时,多糖得率随酶解温度也是先增后减。多糖最大提取率在52.5℃和2.25 h左右。两因素的交互作用不明显。图7与图6的因素变化趋势一致,且酶解pH与酶解时间交互作用不明显。
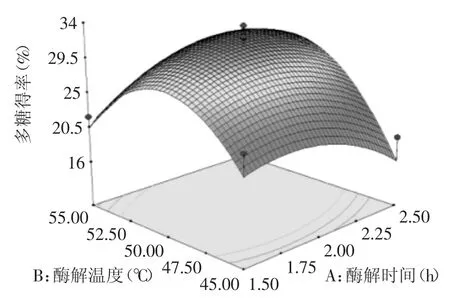
图6 酶解时间和酶解温度对多糖得率影响的响应曲面图Fig.6 Response surface of time and temperature of enzyme on the yield of polysaccharide
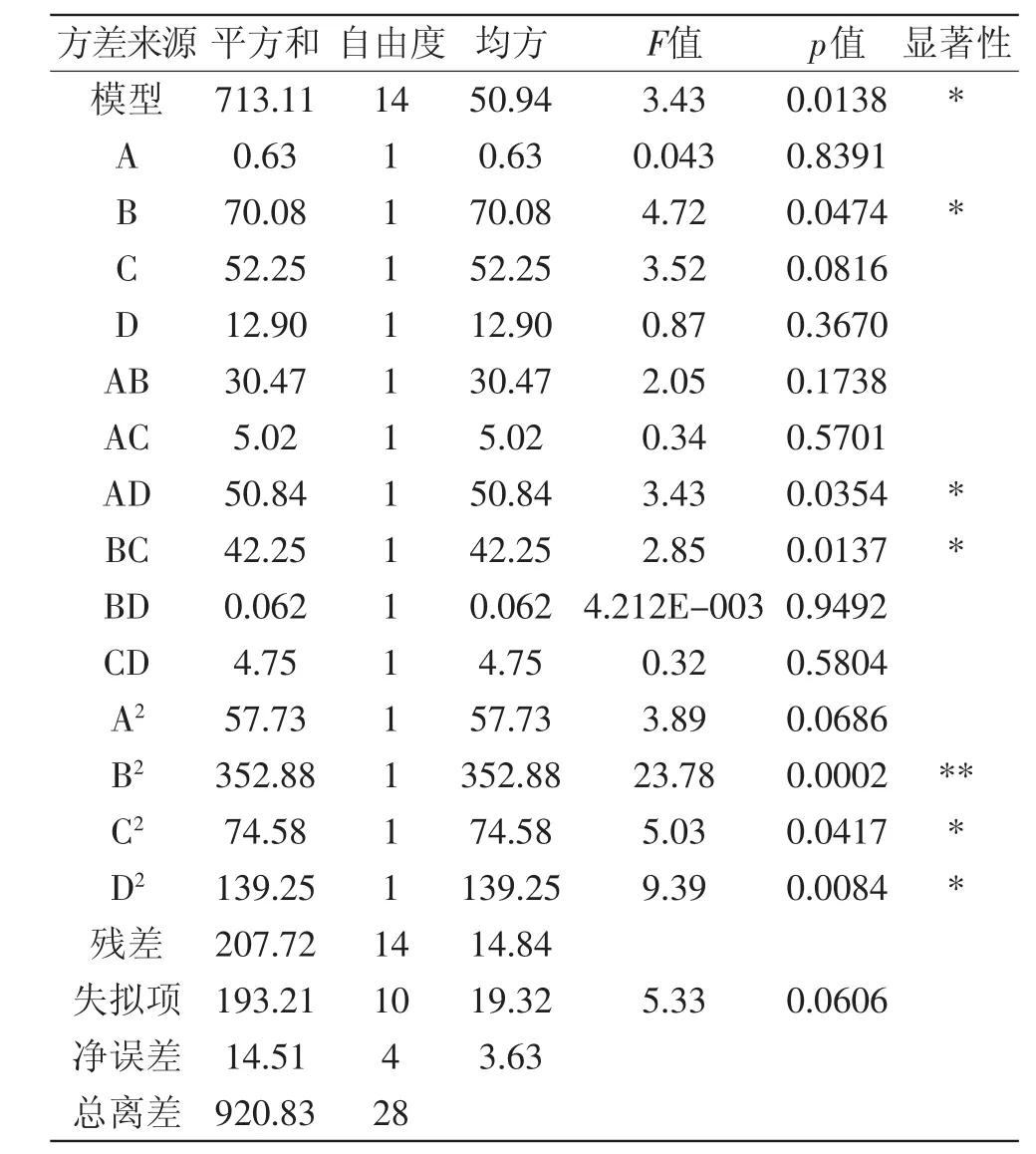
表3 回归方程方差分析表Table 3 Analysis results of regression and variance
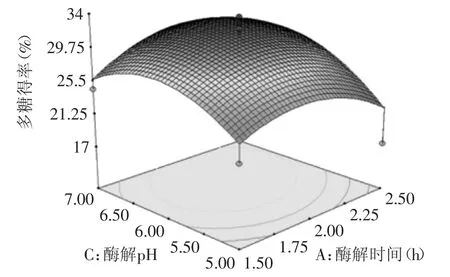
图7 酶解时间和酶解pH对多糖得率的响应曲面图Fig.7 Response surface of time and pH of enzyme on the yield of polysaccharide
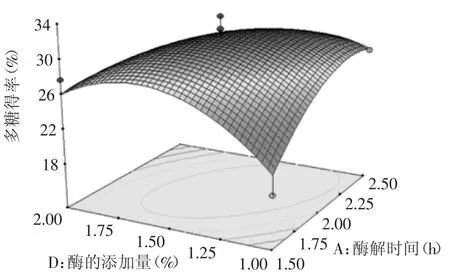
图8 酶解时间和酶的添加量对多糖得率的响应曲面图Fig.8 Response surface of time and addition of enzyme on the yield of polysaccharide
图8中可见,酶添加量固定值时,多糖得率随酶解时间增加的速度先快后慢,最后趋于稳定。酶解时间固定时,多糖得率随酶添加量先增后减。多糖最大提取率在酶添加量1.5%和2.5 h左右。两因素有较明显的交互作用影响。同理,图9中,酶解pH与酶解温度有显著的交互作用影响。
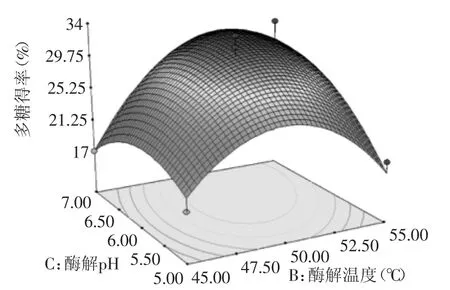
图9 酶解温度和酶解pH对多糖得率的响应曲面图Fig.9 Response surface of PH and temperature of enzyme on the yield of polysaccharide
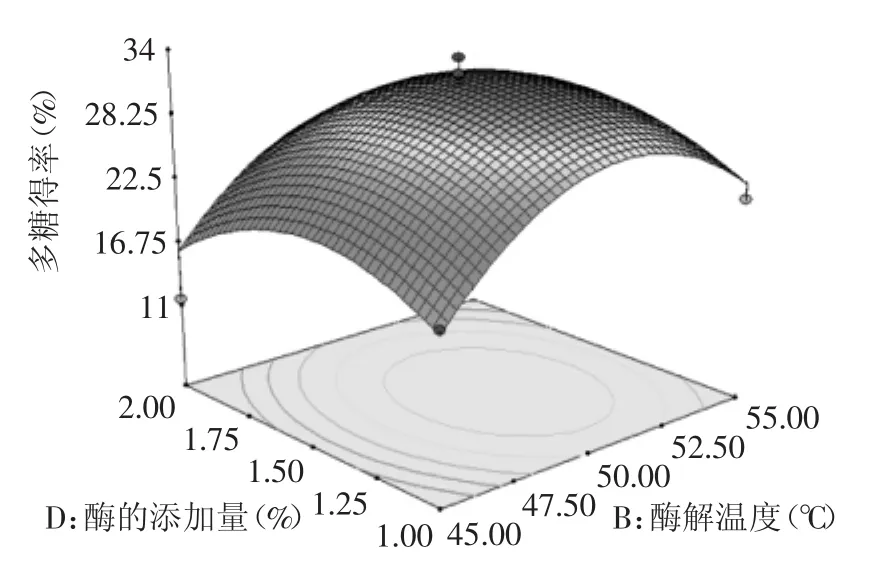
图10 酶解温度和酶的添加量对多糖得率的响应曲面图Fig.10 Response surface of addition and temperature of enzyme on the yield of polysaccharide

图11 酶解pH和酶的添加量对多糖得率的响应曲面图Fig.11 Response surface of addition and pH of enzyme on the yield of polysaccharide
图10、图11中可见,4因子的变化趋势均是先增后减,且交互作用不显著。
2.3.3 最佳组合及其验证 为进一步确定最佳点,在模型浓度范围内选择出发点,使用快速上升法进行优化得到的黑木耳多糖图区的最佳方案为:酶解时间2.50 h,酶解温度为55.02℃,pH为6.89,酶的添加量为2.33%,多糖得率为30.34%。
考虑到实际操作的便利,对提取工艺参数修正为:酶解时间2.5 h,酶解温度为55.0℃,pH为6.8,酶的添加量为1.3%,三次重复验证实验的黑木耳多糖得率分别为31.2%、29.4%、32.6%,平均多糖得率为31.1%,与理论预测值相比,两者相差0.76%,说明上述模型稳定可用。
3 结论
采用蜗牛酶作用于超微粉碎后的黑木耳,对多糖进行提取,通过单因素和响应面实验对提取工艺进行优化,并拟合酶解时间、酶解温度、酶解pH、酶的添加量对多糖得率的回归模型,经检验证明该模型合理可靠,能较好地预测蜗牛酶对黑木耳多糖的得率影响。由该模型确定的最优条件为:酶解时间为2.5 h,酶解温度为55.0℃,pH为6.8,酶的添加量为1.3%,在此条件下,多糖得率为31.1%。通过模型系数显著性检验,得到各因素的主效应关系为:酶解温度>酶解pH>酶的添加量>酶解时间。
目前,将蜗牛酶应用于真菌多糖的提取中还没有得到广泛的应用,为了充分开发陆生真菌类多糖这一活性多糖,仍需要加大科研力度,完善黑木耳等陆生真菌类多糖的提取分离基本理论和方法,满足工业化产业化生产的需要。
[1]刘雅静,袁延强,刘秀河,等.黑木耳营养保健研究进展[J].中国食物与营养,2010(10):66-69.
[2]安东,李新胜,王朝川,等.黑木耳营养保健功能[J].中国果菜,2012(3):51-55.
[3]亓树艳,王荔,莫晓燕.大枣多糖的提取工艺及抗氧化作用研究[J].食品与机械,2012(4):117-120.
[4]李铁柱.黑木耳多糖提取及综合利用[D].长春:吉林大学,2005.
[5]杨春瑜,薛海晶,等.超微粉碎对黑木耳多糖融出率的影响[D].广州:广东工业大学,2005.
[6]张涛,吴昌英,张永模,等.蜗牛酶降解壳聚糖制备壳寡糖的研究[J].华西药学杂志,2010(3):313-315.
[7]李学坤,李莉,田盼盼,等.响应面法优化微波辅助蜗牛酶提取女贞子黄酮[J].化学工程,2014(3):6-10.
[8]Tarsis F Gesteira,Vivien Jane Coulson-Thomas,Fernando T Ogata,et al.A novel approach for the characterisation of proteoglycans and biosynthetic enzymes in a snail model[J]. BBA-Proteins and Proteomics,2011(18):1412-1416.
[9]Zaki M E A,Fathalla O A,Swelam S A,et al.Synthesis of pyrido[2,1-c][1,2,4]triazine,1,2,4 triazolo[4,3-a]pyridine and 2-(substituted-pyrazolyl)nicotinonitrile and their effect on Biomphalaria alexandrina snailenzymes.[J].Acta Poloniae Pharmaceutica,2004,611.
[10]曹健,陈秀金,曾实,等.碱法水解脱铬革屑制备胶原蛋白水解物的研究[J].中国皮革,2003(21):13-15.
[11]刘海玲,杨春瑜,杨春莉,等.碱提黑木耳多糖的工艺优化[J].农产品加工,2015(11):34-36.
[12]薛海晶.黑木耳超微粉多糖分离纯化和降血脂功能性研究[D].哈尔滨:东北林业大学,2008.
[13]贾琳斐,郭姣,李清宇,等.响应曲面法优化海红果水溶性多糖提取工艺及抗氧化活性的研究[J].食品工业科技,2014(10):252-257.
[14]Jiang Chong,Zhao Minghua,Zhou Keping.Reliability analysis of inclined loaded piles using a high-order response surface[J]. European Journal of Environmental and Civil Engineering,2014(9):897-909.
[15]姜雯,何承辉,薛桂蓬,等.Box-Behnken中心组合设计优化复方一枝蒿滴丸成型工艺[J].中草药,2013(9):1134-1140.
[16]崔春兰,郑虎哲,顾立众,等.响应曲面分析法优化苹果渣中多酚类物质的果胶酶辅助提取工艺[J].现代食品科技,2013(9):2235-2240.
[17]张伟刚,范巧宁,贾琳斐,等.响应曲面法优化热水浸提红托竹荪多糖的工艺研究[J].食品工业科技,2013(18):269-274.
[18]Joyce Alison P,Leung Sheldon S.Use of response surface methods and path of steepest ascent to optimize ligand-binding assay sensitivity[J].Journal of Immunological Methods,2013,(2):12-23.
Optimization of the snailase assistant extraction process of polysaccharides from Auricularia Auricula by response surface methodology
YANG Chun-yu1,LIU Hai-ling1,YANG Chun-li2,JING Zhi-gang1,XU Xiao-xin3,ZHAI Sen1
(1.Key Laboratory for Food Science&Engineering,Harbin University of Commerce,Harbin 150076,China;2.College of Light Industry,Harbin University of Commerce,Harbin 150028,China 3.Heilongjiang Phoenix Bio-tech Co.,Ltd.,Harbin 164831,China)
In this paper,superfine powder of Auricularia Auricular was selected as raw material,and polysaccharide from Auricularia Auricular was extracted by enzyme hydrolysis by snailase.On the basis of the single factor experiment,extraction condition was optimized through method of response surface.The results showed that:the optimal extraction condition was enzymatic hydrolysis time 2.5 h,enzymatic hydrolysis temperature 55.0℃,pH6.8 and enzyme concentration 1.3%.Under above conditions,yield of polysaccharide reached 31.1%,the relative average error between predicted yield and actual value was 0.76%,and the reproducible was reliable.So,it was proved that the response surface equation of optimized extracted condition derived some practical significance.
Auricularia Auricula;polysaccharides;ultra-fine;snail enzymes;response surface methodology
TS201.2
A
1002-0306(2015)22-0198-06
10.13386/j.issn1002-0306.2015.22.033
2015-02-02
杨春瑜(1975-),女,博士,教授,研究方向:生物分离纯化技术,E-mail:catherineyang88@126.com。
黑龙江省教育厅青年骨干教师项目(G1155G24)。

