芡种壳提取物抗氧化、抑菌活性及其组分分析
张 汆,陈志宏,何晓伟,于士军,柏 钰
(滁州学院生物与食品工程学院,安徽滁州239000)
芡种壳提取物抗氧化、抑菌活性及其组分分析
张 汆,陈志宏,何晓伟,于士军,柏 钰
(滁州学院生物与食品工程学院,安徽滁州239000)
为了解芡种壳提取物主要生理活性和化学组成,采用体外抗氧化分析方法分析了提取物的总还原力、清除NO2-和DPPH·活性以及抗脂质过氧化性质;采用微生物培养法对其抑菌活性进行了分析;采用高效液相色谱法对其主要组分进行了分析。结果表明4种芡种壳提取物中总酚含量很高(387.62~763.65 mg/g),并显示出较强的总还原力、较强的DPPH·清除作用和脂质过氧化抑制活性以及中等强度的NO2-清除活性。4种提取物对大肠杆菌O157、阪崎肠杆菌、单增李斯特菌等显示较强的抑菌活性。高效液相色谱分析结果表明,提取物中含有芦丁、没食子酸、绿原酸和儿茶素等活性组分。芡种壳提取物具有很强的抗氧化活性和一定的抑菌活性,与其中丰富的多酚物质密切相关,作为天然抗氧化剂具有一定开发潜力。
芡种壳提取物,抗氧化活性,抑菌活性,组分分析
芡实是睡莲科(Nymphaeaceae)芡属植物(Euryale Salisb.ex DC.)芡(Euryale ferox Salisb.)的种子,俗称“鸡头果”。芡实是我国传统的中药原料和滋补食材,除具有“补肾、健脾、养胃”等传统医学理论功效外,还具有抗氧化[1-2]、修复心肌局部缺血[3]的功效。芡种壳约占其种子质量的30%~40%,是芡米加工中的主要副产物,我国(2014)年产量在5000 t以上,目前尚未开发利用。
国内外有关芡实的研究主要集中在营养组分分析[4-5]、生理活性[1-3,6-9]以及加工[10-11]等方面。邓宇等[12]、王和才等[13]先后在芡果皮中检测到丰富的鞣质,张汆等在芡种仁[14]中也检测到大量的植物多酚物质,在其生理保健功能中可能发挥重要作用。前期研究发现,芡种壳中含有非常丰富的多酚物质[15]。多酚物质是自然界仅次于纤维素和淀粉的第三大天然产物,单宁、黄酮、异黄酮、花青素等均属于多酚物质。此类物质一般具有多种生理活性,性质非常活跃,广泛分布于各种食品材料中,如茶多酚、葡萄酒多酚、大豆异黄酮等。目前,国内外对芡种壳中多酚物质的组成和生理活性研究较少,孙文凯等[15]、Wu ChengYing等[16]先后对芡种壳提取物的体外抗氧化性质和体内抗氧化活性进行了分析,结果均显示其提取物具有显著的抗氧化活性,并从中鉴定出四种物质:没食子酸、5,7-dihydroxy-2-(3,4,5-trihydroxyphenyl)-chroman-4-one、5,7,4’-三羟基黄酮(5,7,4-trihydroxy flavanone)和醉鱼草素E(buddlenol E)。Yuan Huaibo等[17]研究发现,芡种壳提取物中富含萜类化合物,可显著降低因链脲霉素(Streptozotocin)导致的糖尿病小鼠的血糖和血脂。
本课题组前期的研究表明芡实种仁和种壳中含有非常丰富的多酚,芡种壳中尤其丰富(20%)[14-15]。已有的数篇文献报道,在芡实的不同组织中也发现鞣制[12-13]、黄酮和醉鱼草素[16]、萜类[17]等生理活性组分。说明芡实种子中发挥抗氧化性质的物质不止一种,其组成比较复杂,它们在芡实保健功能中也应该发挥不同的作用。但是,目前有关芡实生理活性的报道多集中在抗氧化性质分析,而对其组成和作用机理的报道很少。此外,芡种壳提取物作为食品添加剂的使用也少有报道。本研究在前期研究的基础上,主要是针对芡种壳中的酚类物质的抗氧化性质、作为天然食品添加剂对食品中常见微生物的抑菌性质及其酚类物质组成进行分析,希望通过研究探讨芡种壳提取物生理活性及其作用机理,为芡种壳资源的综合利用提供初步的理论依据。
1 材料与方法
1.1 材料与仪器
新鲜芡实(Euryale ferox Salisb.) 安徽省滁州市当地产,2010年10月采收后,在清水中洗干净芡实种子,手工剪开其芡种壳,取出种仁;芡种壳 于40℃烘箱内干燥后,粉碎(过60目筛网),装入聚乙烯自封袋内,于4℃冰箱内贮藏备用;DPPH·(1,1-二苯基-2-苦肼基自由基) 纯度>97.0%,购自梯希爱(上海)化成工业发展有限公司;高效液相色谱用甲醇、乙酸等试剂 均为色谱纯;平板计数琼脂(PCA)培养基 购自北京陆桥公司;芦丁、没食子酸、绿原酸、儿茶素等标准品 购自中国药品生物制品检定所;乳酸链球菌素(Nisin) 购自浙江银象生物工程有限公司;其他常规试剂 均为分析纯,购自国药集团上海试剂公司;实验微生物:魏斯氏菌(Weissella)、粪肠球菌(Enterococcus faecalis)、屎肠球菌(Enterococcus faecium)、葡萄球菌(Staphylococcus)、铜绿假单胞菌(Pseudomonas aeruginosa)、大肠杆菌(Escherichia coli)、大肠杆菌O157(Escherichia coli O157)、阪琦肠杆菌(Enterobacter sakazakii)、单增李斯特菌(Listeria monocytogenes)、肠炎沙门菌(Salmonella enterica)、鼠伤寒沙门菌(Salmonella typhimurium)、酿酒酵母(Saccharomyces cerevisiae)、赤霉菌(Gibberella zeae)、枯草芽孢杆菌(Bacillus subtilis)、巨大芽孢杆菌(Bcaillus megaterium de Bary)等15种微生物菌种由南京农业大学教育部肉品加工与质量控制重点实验室提供。
CP124S型分析天平 德国Sartorius公司;FW135型粉碎机 天津泰斯特仪器有限公司;L550型大容量离心机 湖南湘仪离心机有限公司;LGJ-10B型冷冻干燥机 北京四环科学仪器厂有限公司;RE-85Z型旋转蒸发仪 郑州科工贸有限公司;DGX-9073BC-1型电热鼓风干燥箱 上海福玛实验设备有限公司;UV-2450PC型紫外-可见分光光度计 日本岛津公司;KQ-300DE型数控超声波发生器 昆山市超声波仪器有限公司;GKYS型无菌操作台 苏净集团苏州安泰公司;精密微量移液器 100~5000 μL,德国Eppendorf公司;WH-2型微型旋涡混合仪 上海沪西科学仪器公司;HVE-50型灭菌器 日本Hirayama公司;M2e型酶标仪 美国美谷分子仪器有限公司;e2695型高效液相色谱仪、2489型紫外-可见光检测器 美国Waters公司。
1.2 实验方法
1.2.1 提取物制备 参照文献[15,17]中的提取方法,并做部分修改。称取芡种壳粉100 g左右于烧杯中,向烧杯中加入乙酸乙酯400 mL左右,搅拌均匀,用保鲜膜封口。放入超声波发生器中,20℃下超声浸提10 min。抽滤,滤渣用乙酸乙酯在连续浸提2次,合并滤液,减压回收溶剂,用水洗出提取物,得芡种壳乙酸乙酯提取液。滤渣中加入无水乙醇,采用上述方法连续浸提3次,抽滤,合并滤液,减压回收溶剂,得芡种壳乙醇提取液。滤渣再用50%乙醇水溶液继续浸提,采用同样方法得到芡种壳50%乙醇提取液。最后,滤渣用热水(70~80℃)连续浸提3次,采用同样方法得到芡种壳水提取液。将上述4中提取液真空冷冻干燥48 h,即分别得到4种提取物:芡种壳乙酸乙酯提取物(A)、乙醇提取物(B)、50%乙醇提取物(C)和水提取物(D)。所得4种提取物,装入棕色瓶内,-20℃低温贮藏,备用。
根据所得提取物中总酚含量计算总酚提取率,根据所得提取物质量与芡种壳质量计算样品得率。计算公式如下:
总酚提取率(%)=(提取物中总酚质量/样品中总酚质量)×100
样品得率(%)=(提取物质量/芡种壳质量)×100
1.2.2 提取物组分分析 总酚含量:采用Folin-Ciocalteus(FC)福林酚试剂法[18]测定,总糖含量:采用苯酚-硫酸法测定[19]。
1.2.3 抗氧化特性分析 将A、B、C和D四种提取物配制成10~50 μg/mL的溶液,分别测定其抗氧化特性,同时以相同浓度的VC溶液做对照。总还原力测定:采用铁氰化钾比色法,参照Lee等[1]的方法测定。DPPH自由基(二苯代苦味肼基自由基)清除活性分析:采用比色法,参照Gulcin等[18]和Roussis等[19]的方法测定。抗脂质过氧化能力分析:参照Wang等[20]的方法测定。各提取物的抗氧化活性评价采用其IC50(即发挥50%抗氧化活性时的浓度,μg/mL)进行比较,该值越低说明其氧化活性越强[16-18]。
1.2.4 提取物抑菌活性分析 参照文献[21]中的方法,做适当调整。将菌种用营养肉汤活化增殖12 h(37℃),使其菌体数量达到108cfu/mL。在无菌条件下,用灭菌生理盐水(0.85%)稀释至104cfu/mL,吸取稀释菌液1.0 mL至灭菌培养皿中,再加入提取物溶液1.0 mL(20 mg/mL)和20 mL灭菌液体PCA培养基,迅速混合均匀,冷却至培养基凝固,然后于37℃培养箱内培养3 d。计数每个培养皿中的菌落总数,按照下式计算提取物对每种细菌的抑菌率:
抑菌率(%)=(1-C1/C2)×100
式中:C1—培养3d后培养皿中的菌落总数;C2—培养前实际加入的菌体数量。
Nisin是目前公认的一种安全防腐剂,在本实验中作为芡种壳提取物抑菌性强弱的对照。
1.2.5 提取物组分分析 样品处理:参照文献[22]的方法。取20~30 mg提取物,溶解于2 mL溶剂中,再加入10 mL 1 mol/L盐酸溶液,加热回流30 min后,将样液过滤,滤液再经0.45 μm膜过滤后,用于高效液相色谱(HPLC)分析。
HPLC条件:经反复实验,最终确定HPLC分析的参数为:Waters e2695 HPLC,Waters 2489 UV-visible检测器,XBridgeTM C18柱(5 μm,4.6 mm×250 mm)。流动相:甲醇∶1%乙酸(30∶70,v/v),流速1.0 ml/mL,检测波长240 nm,进样量5 μL,柱温35℃。
提取物组分分析:采用芦丁、没食子酸、绿原酸、儿茶素、表儿茶素等标准物质作为对照品,以保留时间定性,峰面积定量。
1.3 数据处理与统计分析
采用Microsoft Excel 2010和DPS 7.55数据处理软件对数据进行分析。实验数据均重复测定3次,取平均值,表示为:平均值±标准差(SD),应用DPS 7.55数据处理软件对不同处理之间的显著性差异进行分析。
2 结果与分析
2.1 提取物理化组分分析
芡种壳中总酚含量较高(183.17 mg/g),所得提取物A、B、C和D中以无水乙醇提取物(B)中的总酚含量最高(763.65 mg/g),热水提取物D中最低(387.62 mg/g)。用乙酸乙酯、乙醇、50%乙醇水溶液和水等四种不同极性有机溶剂进行分级提取,样品总得率32.53%,芡种壳中总酚提取率98.22%(表1)。总糖分析结果显示,4种芡种壳提取物中总糖含量接近(8.57%、11.72%、12.32%、10.47%),但其溶液中并未检测出游离低聚糖(HPLC法),由此推测芡种壳提取物中可能含有糖苷结构,类似单宁酸分子中含有葡萄糖基团一样[23],经苯酚-硫酸法测定,其分子中的糖苷键发生水解,释放出糖分子,故而可测得其中的总糖含量。依次推测,4种芡种壳提取物中均含有酚类物质,其具体组成还有待后续分析。
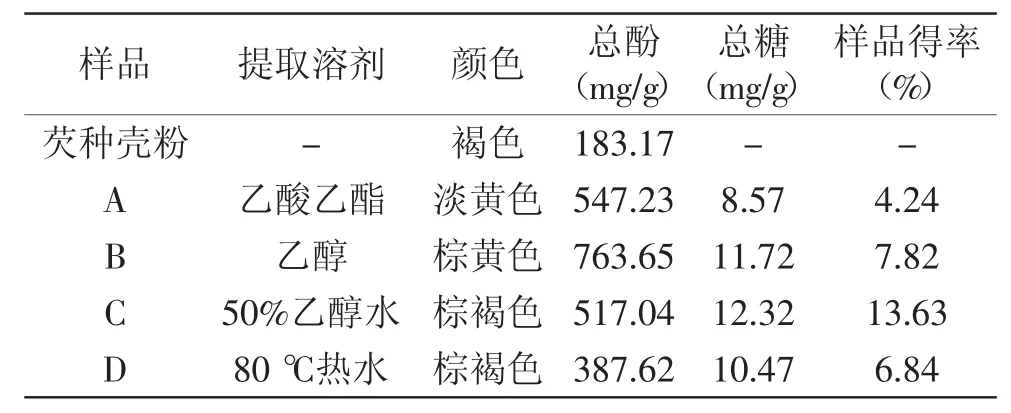
表1 提取物组分分析Table 1 The compositions analysis of extracts
2.2 芡种壳提取物抗氧化特性分析
2.2.1 总还原力 随浓度增加,4种提取物的总还原力几乎呈线性增加(图1),不同浓度提取物总还原力存在极显著差异(p≤0.01)。根据其IC50值(μg/mL)进行评价,乙醇提取物B的总还原力最高,其次是A、C、维生素C(VC)和D(表2)。在10~50 μg/mL范围内,四种芡种壳提取物均显示出较强的总还原力,其中的提取物D与VC的总还原力无显著差异(p>0.05),A、B和C三种提取物均显著高于同浓度的VC溶液(p<0.05),表明芡种壳提取物具有很强的还原性。

图1 提取物总还原能力Fig.1 The total reducing ability of extracts
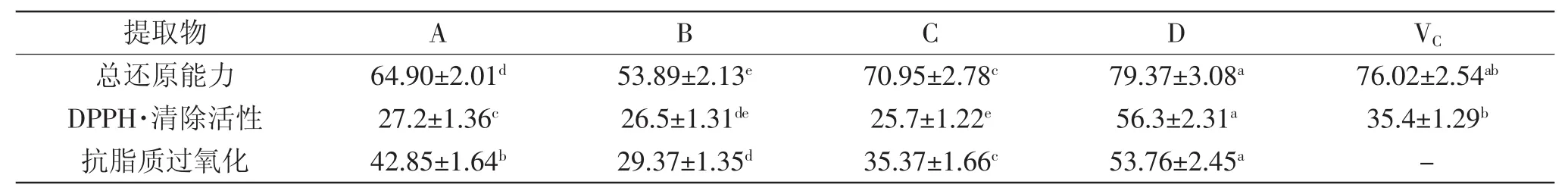
表2 提取物抗氧化活性的IC5(0μg/mL)Table 2 The IC50of extracts antioxidative activity(μg/mL)
2.2.2 清除DPPH自由基(DPPH·)活性 4种提取物对DPPH·均显示出较强的清除作用,在较低的浓度范围内(0~50 μg/mL),提取物A、B、C对DPPH·的清除活性均高于VC,在100 μg/mL时,A、B、C三种提取物的DPPH·清除率均超过80%,与VC持平(图2)。说明芡种壳提取物具有较强的DPPH·清除活性。
根据其IC50值,提取物和VC对DPPH·的清除活性次序为:C>B>A>VC>D,不同提取物间的IC50值差异显著(p<0.05)(表2)。水提取物D的DPPH·清除活性相对较低,这可能与其较低的总酚含量(387.62 mg/g)有关。
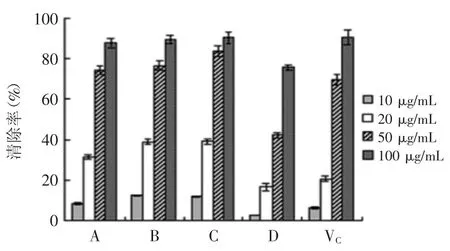
图2 提取物对DPPH·的清除活性Fig.2 The scavenging activity of extracts against DPPH·
2.2.3 抗脂质过氧化活性 4种芡种壳提取物对Fe2+引发的亚油酸过氧化具有较强的抑制率,且随浓度的增加,其脂质过氧化抑制率显著增加(p<0.01)(图3),据其IC50,4种芡种壳提取物的脂质过氧化抑制活性依次为:B>C>A>D(表2)。酚羟基具有较强的还原力,可有效还原脂质过氧化物,并且在分子内和分子间能形成缔合氢键,成为一个大的供氢体,阻断脂类自由基的链式反应,进而防止过氧化物积累所造成的亚油酸过氧化[18,23]。本实验中,芡种壳提取物对亚油酸过氧化体系的抑制活性较强。
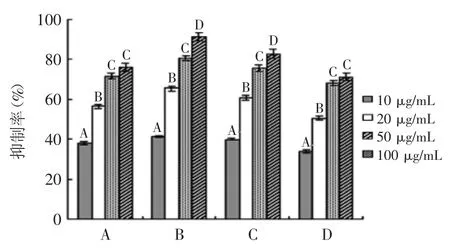
图3 芡种壳提取物脂质过氧化抑制活性Fig.3 The lipids peroxidation inhibition activity of extracts
2.3 提取物抑菌性分析
本实验所用15种微生物多为食品中常见的致腐或致病菌,涉及革兰氏阴性菌、阳性菌和真菌。抑菌率分析结果显示,4种芡种壳提取物中,以乙酸乙酯提取物(A)的抑菌活性最强,15中实验菌种中,除对枯草芽孢杆菌抑菌率较弱外,对其他菌种的抑菌率均>90%,甚至100%。其次是乙醇提取物(B),其抑菌活性略低于提取物A。提取物C和D的抑菌活性相对较弱,尤其是提取物D。结果显示,Nisin对实验所用15种微生物均显示出很强的抑菌活性,其抑菌活性总体上要优于芡种壳提取物(表3)。
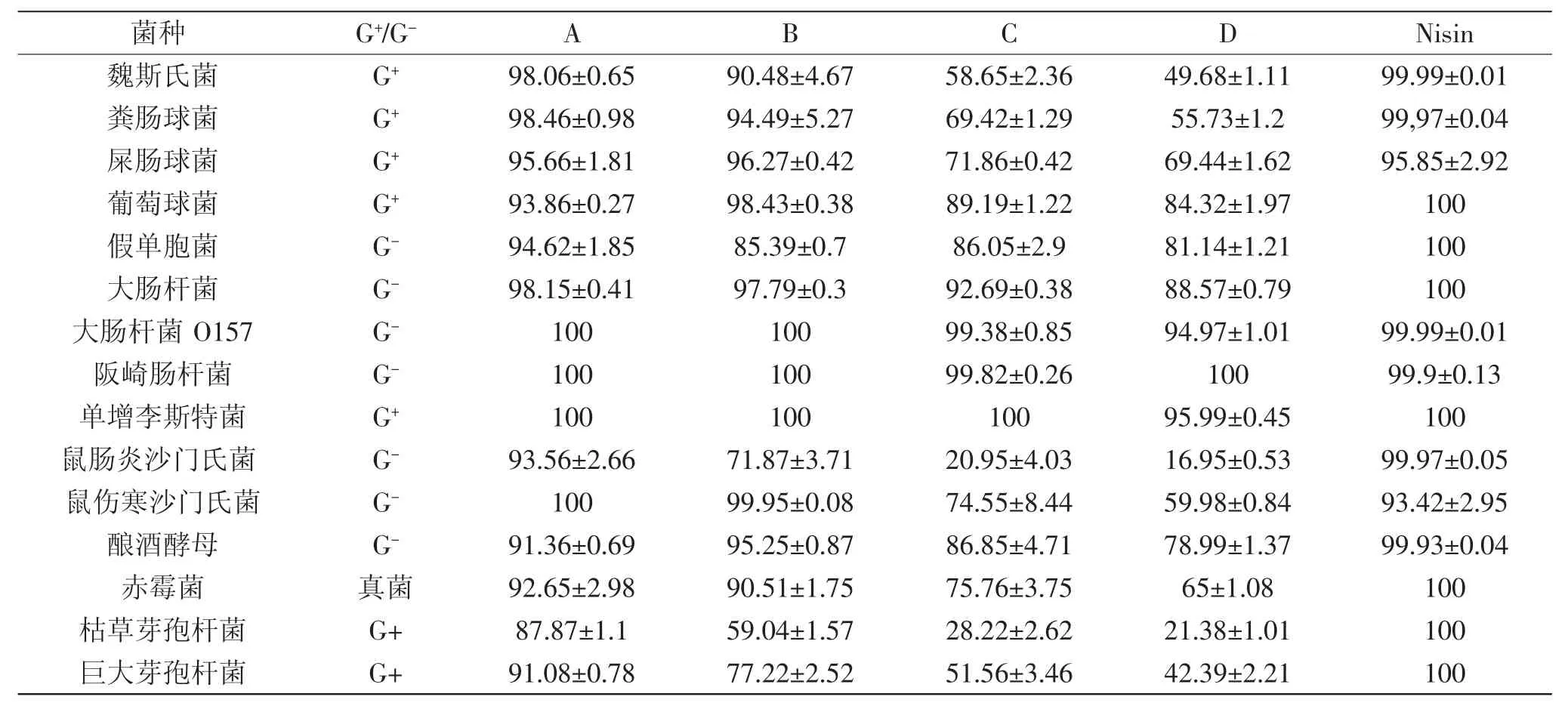
表3 芡种壳提取物抑菌性分析结果Table 3 Antibacterial activities of gorgon nut shell extracts on 15 kinds of microbials
此外,虽然4种芡种壳提取物对不同微生物显示不同强度的抑菌活性,但对大肠杆菌O157、阪崎肠杆菌和单增李斯特菌等3种实验用菌种均显示出较强的抑菌活性。
2.4 提取物组分的HPLC分析
目前有关芡实中多酚物质组成的相关文献很少,因此标准物质选择时缺乏依据,只能选择5种自然界植物中分布最为广泛的多酚物质(没食子酸、儿茶素、绿原酸、表儿茶素和芦丁)作为HPLC的多酚对照物质。经HPLC-UV分析,从芡种壳提取物中初步检测出5种多酚化合物,分别为:没食子酸、儿茶素、绿原酸、表儿茶素和芦丁,其HPLC分离图谱及相对含量分别见图4和表4。因芡种壳中多酚物质的参考资料有限,还有部分其他未知组分有待进一步定性。
结果表明,4种芡种壳提取物中均含有丰富的芦丁和没食子酸,其中含量最高的组分是芦丁。这些组分均为公认的强抗氧化活性组分,其中,没食子酸是常见的食品抗氧化剂,具有抗菌、抗病毒的功能,芦丁和绿原酸是许多中成药中的有效组分。尤其是芦丁具有降低毛细血管通透性和脆性的作用,保持及恢复毛细血管的正常弹性,临床上用于防治高血压脑溢血、糖尿病视网膜出血和出血性紫癜等[24]。
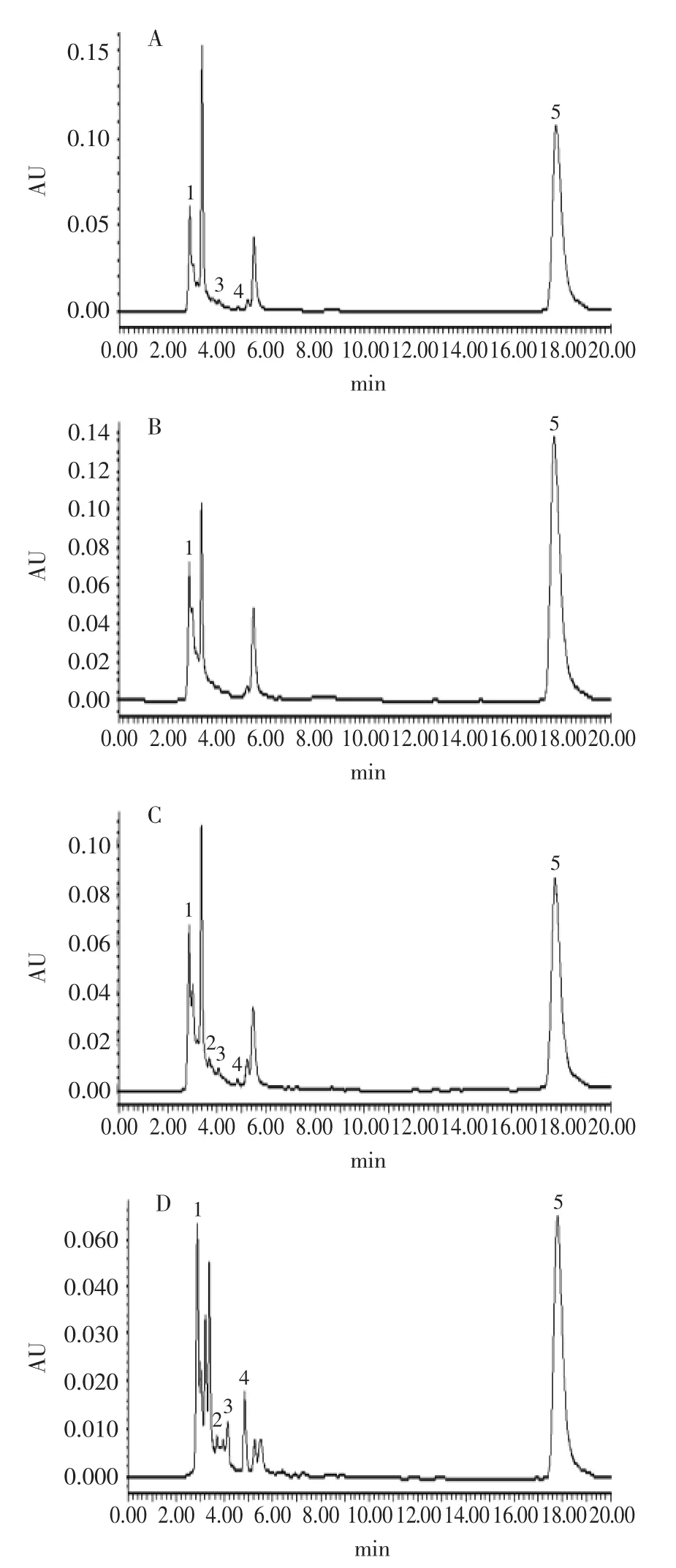
图4 芡种壳提取物的HPLC图Fig.4 The HPLC potography of gorgon nut shell extracts

表4 芡种壳提取物组分的HPLC分析结果Table 4 The compositions of gorgon nut shell extracts analyzed by HPLC method
3 结论
本实验依次采用乙酸乙酯、乙醇、50%乙醇水溶液和水等这四种极性依次增加的溶剂体系,对芡种壳中的活性组分进行分级提取,分别得到A、B、C和D等4种提取物,其中总酚平均值分别为547.23、763.65、517.04、387.62 mg/g。体外抗氧化分析表明,这4种芡种壳提取物具有较强的还原性和清除DPPH·活性,高于或接近于相同浓度的VC,芡种壳提取物显示出很强的脂质过氧化抑制活性。此外,芡种壳提取物显示出较强的、且比较广谱的抑菌活性,其中,提取物A和B的抑菌活性较强,在天然抗氧化剂领域具有一定应用潜力。HPLC分析结果表明,芡种壳提取物中含有丰富的没食子酸、儿茶素、绿原酸和芦丁等4种多酚化合物,尤其是芦丁的含量很高。
[1]Si Eun Lee,Eun Mi Ju,Jeong Hee Kim.Antioxidant activity of extracts from Euryale ferox seed[J].Experimental and Molecular Medicine,2002,34:100-106.
[2]李成良,陈学好,李良俊,等.芡实黄酮类物质的提取及抗氧化性研究[J].长江蔬菜:学术版,2010(14):57-61.
[3]Samarjit Das,Peter Der,Utpal Raychaudhuri,et al.The effect of Euryale ferox(makhana),an herb of aquatic origin,on myocardial ischemic reperfusion injury[J].Molecular and Cellular Biochemistry,2006,289:55-63.
[4]R N Dutta,S N Jha,U N Jha.Plant content and quality of makhana(Euryale ferox)[J].Plant and Soil,1986,96:429-432.
[5]凌庆枝,袁怀波,赵美霞,等.瓦埠湖产芡实种仁的蛋白质、氨基酸测定[J].食品研究与开发,2009,30(6):118-120.
[6]Zhao Haoru,Zhao Shouxun,Sun Chongqing,et al. Glucosylsterols in extracts of Euryale ferox identified by high resolution NMR and mass spectrometry[J].Journal of Lipid Research,1989,30:1633-1637.
[7]刘玉鹏,刘梅,刘俊英,等.30种中草药的抗氧化活性研究[J].烟台大学学报:自然科学与工程版,2000,13(1):70-73.
[8]李美红,杨雪琼,万直剑,等.芡实的化学成分[J].中国天然药物,2007,5(1):24-26.
[9]李美红,李璠,太志刚,等.芡实中的三个环二肽[J].昆明学院学报,2009,31(3):39-41.
[10]S N Jha,Suresh Prasad.Determination of Processing Conditunions for Gorgon Nut(Euryale ferox)[J].J Agric Engng Res,1996,63:103-112.
[11]S N Jha.Physical and hygroscopic properties of makhana[J]. Journal of Agricultural Engineering Research,1999,72:145-150.
[12]邓宇.表面活性剂在芡实栲胶提取中作用的初步研究[J].化学工业与工程技术,2002,23(2):1-3.
[13]王和才.芡实种皮总鞣质的提取及含量测定[J].食品工业科技,2009,30(8):224-226.
[14]张汆,薛连海,贾小丽,等.D101树脂分离纯化芡实多酚的特性研究[J].食品科学,2009,30(20):260-264.
[15]孙文凯,袁怀波,许卫,等.芡实壳提取物抗氧化能力研究[J].食品工业科技,2011,32(4):100-102.
[16]Wu ChengYing,Chen Rong,Wang Xin Sheng,et al. Antioxidant and Anti-Fatigue Activities of Phenolic Extract from the Seed Coat of Euryale ferox Salisb.and Identification of Three Phenolic Compounds by LC-ESI-MS/MS[J].Molecules,2013,18,11003-11021.
[17]Yuan Huaibo,Meng Shaohua,Gong Zhaobin,et al. Hypoglycemic activity and the activation of phosphorylation of a triterpenoid-rich extract from Euryale shell on streptozotocininduced diabetic mice.Bangladesh J Pharmacol,2013,8:230-233.
[18]Gulcin I,Huyut Z,Elmastas M,et al.Radical scavenging and antioxidant activity of tannic acid[J].Arabian Journal of Chemistry,2010,3,43-53
[19]Roussis I G,Lambropoulos I,Tzimas P,et al.Antioxidant activities of some Greek wines and wine phenolic extracts[J]. Journal of Food Composition and Analysis,2008,21:614-621.
[20]Wang L L,Xiong Y L.Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J].Journal of Agricultural and Food Chemistry,2005,53(23):9186-9192.
[21]Blaise Ouattara,Ronald E Simard,Richard A Holley,et al. Antibacterial activity of selected fatty acid and essential oils against six meat spoilage organisms[J].International Journal of Food Microbiology,1997,37:155-162.
[22]Sara Arranz,Fulgencio Saura Calixto.Analysis of polyphenols in cereals may be improved performing acidic hydrolysis:A Study in wheat flour and wheat bran and cereal of the diet[J]. Journal of Cereal Science,2010,51:313-318.
[23]Ilhami Gulcin,Zubeyr Huyut,Mahfuz Elmastas,et al.Radical scavenging and antioxidant activity of tannic acid[J].Arabian Journal of Chemistry,2010(3):43-53.
[24]Yang Jianxiong,Guo Juan,Yuan Jiangfeng.In vitro antioxidant properties of rutin[J].LWT,2008,41:1060-1066.
Antioxidative and antibacterial activities of Euryale ferox Salisb.shell extracts and its compositions analysis
ZHANG Cuan,CHEN Zhi-hong,HE Xiao-wei,YU Shi-jun,BAI Yu
(College of Biology and Food Engineering,Chuzhou University,Chuzhou 239000,China)
Four kinds of extracts were extracted from Euryale ferox Salisb.shell with different solvents,such as,ethyl acetate,ethanol,50%aqueous ethanol and hot water(70~80℃),respectively.The antioxidative properties of four extracts were evaluated with the method of total reducing capacity,scavenging NO2-and DPPH· activities and lipid peroxidation inhibition ability,respectively.The microbial method was used to analyze the antibacterial activity of extracts to 15 kinds of bacterials.The main compositions of extracts analyzed with HPLC method in the article.The results showed that high content polyphonic compounds were obtained in four extracts,and exhibited strong total reducing power,DPPH·scavenging activity,possessed significant lipid peroxidation inhibition activity and moderate NO2-scavenging activities.Four kinds of extracts exhibited strong antibacterial activity to three kinds of common pathogens,such as,Escherichia coli O157,Enterobacter sakazakii and Listeria monocytogenes.By standard substances qualitative,five kinds of polyphenols were determined form extracts,they were gallic acid,catechin,epicatechin,chlorogenic acid and rutin,respectively.In a conclusion,the extracts possessed strong antioxidant capacity and antibacterial activities,which may be closely related to the high content polyphenols,so,they could be potential in food antioxidant.
Euryale ferox Salisb.shell extracts;antioxidant capacity;antibacterial activity;composition analysis
TS251.1
A
1002-0306(2015)22-0151-06
10.13386/j.issn1002-0306.2015.22.023
2015-03-01
张汆(1970-),女,博士,副教授,主要从事食品化学与营养学、膳食蛋白方面的研究,E-mail:zhangchuan2005@126.com。
2014年度公益性行业(农业)科研专项(201303039);滁州学院重点科研项目(2012kj006Z)。

