pH对厌氧氨氧化反应脱氮效能的影响
陈宗姮,徐杉杉,李 祥,刘福鑫
(1. 苏州科技学院 环境生物技术研究所,江苏 苏州 215011;2. 苏州科技学院 环境科学与工程学院,江苏 苏州 215011)
pH对厌氧氨氧化反应脱氮效能的影响
陈宗姮1,2,徐杉杉1,2,李 祥1,2,刘福鑫1,2
(1. 苏州科技学院 环境生物技术研究所,江苏 苏州 215011;2. 苏州科技学院 环境科学与工程学院,江苏 苏州 215011)
采用具有恒定pH功能的SBR接种厌氧氨氧化颗粒污泥,研究了pH对厌氧氨氧化菌脱氮效能的影响。实验结果表明:在进水ρ(氨氮)和ρ(亚硝酸盐氮)分别为58.00 mg/L和79.28 mg/L、TN容积负荷为0.82 kg/(m³·d)、不控制反应pH的条件下,随着反应的进行,pH不断升高,当pH=8.02时,菌种的去除效能最高;在进水ρ(氨氮)和ρ(亚硝酸盐氮)分别为120.00 mg/L和159.33 mg/L、TN容积负荷为1.62 kg/(m³·d)、恒定反应pH为8.00的条件下,反应4.0 h时的容积基质氮去除速率(NRR)达到1.42 kg/(m³·d),氨氮去除率达98.39%,亚硝酸盐氮去除率达99.48%;拟合曲线推导的最适pH的理论值为7.85,反应4.0 h时的NRR理论最大值达1.52 kg/(m³·d)。
厌氧氨氧化;pH;容积基质氮去除速率;序批式反应器;脱氮效能
厌氧氨氧化是在缺氧的条件下,自养型厌氧氨氧化菌以亚硝酸盐为电子受体,直接将氨氮氧化为氮气的反应。它改变了传统氮循环中需投加电子供体才能将氨根转化成氮气的过程[1],故与传统的生物脱氮反应[2]相比优势明显:无需有机碳源和氧气、节能约60%、剩余污泥产量低[3]。然而,厌氧氨氧化菌生长缓慢(倍增时间长达11 d),且生长条件严格,易受温度、pH、DO等条件的制约[4]。厌氧氨氧化过程是一个消耗H+的过程[5],过高或过低的pH都会影响反应的正常进行。因此,相对于温度[6]、DO[7]等可恒定控制的影响因子,动态影响因子pH的控制更加重要。目前已有将pH作为厌氧氨氧化运行过程中一个主要影响因子的相关研究[8]。Puyol等[9]在密封的血清瓶中接种厌氧氨氧化污泥,发现进水pH为7.2~7.6时污泥活性较大。鲍林林等[10]采用上向流厌氧氨氧化生物滤池在常温、低基质浓度条件下进行反应,发现最适的进水pH为6.7~8.5。但上述研究缺少对反应过程的调控,无法准确说明动态的pH对脱氮效能的影响。
本工作采用具有恒定pH功能的厌氧反应器,接种成熟的厌氧氨氧化污泥,研究了pH对厌氧氨氧化污泥脱氮性能的影响,以期为厌氧氨氧化反应器运行参数的选取提供参考,实现高效脱氮。
1 实验部分
1.1 试剂、材料和仪器
KH2PO4,CaCl2·2H2O,MgSO4·7H2O,NH4C1,NaNO2,KHCO3:分析纯;氮气:工业级,纯度99.99%。
微量元素浓缩液I(ρ,g/L):EDTA 5,FeSO45;微量元素浓缩液Ⅱ(ρ,g/L):EDTA 15,H3BO40.014,MnCl2·4H2O 0.99,CuSO4·5H2O 0.025,ZnSO4·7H2O 0.43,NiCl2·6H2O 0.19,NaSeO4·10H2O 0.21,NaMnO4·2H2O 0.22。
模拟废水:KH2PO40.01 g/L,CaCl2·2H2O 0.005 6 g/L,MgSO4·7H2O 0.3 g/L;微量元素浓缩液I 1.00 mL/L,微量元素浓缩液II 1.25 mL/L;NH4C1和NaNO2,适量;KHCO3,按m(C)∶m(N)= 1∶1投加。反应前用氮气吹脱除氧。
接种污泥:本实验室培养的厌氧氨氧化颗粒污泥,砖红色,氨氮和亚硝酸盐氮的总去除速率可达3.54 kg/(m³·d),总去除率稳定在80%以上。
UVmini-1240型紫外-可见分光光度计:日本岛津公司;ICS900/AS23型离子色谱仪:戴安中国有限公司;pHS-3TC型数显pH计仪:上海嘉鹏科技有限公司;2100e型在线监测pH计:Mettler Toledo公司。
1.2 实验装置及方法
采用具有恒定pH功能的SBR进行实验。反应器主体为内径16 cm、有效体积2.5 L的圆柱型玻璃罐。厌氧氨氧化菌是化能自养菌,为了防止光能影响其生长,在反应器外部包裹一层黑布。反应器设有玻璃夹套,内通循环水,温度控制在(30±1) ℃。反应器设有搅拌装置。
实验进行时,在线监测系统通过pH探头的反馈信息控制系统添加1 mol/L NaOH溶液或1 mol/L HCl,使反应pH控制在设定值的±0.01范围内。
HRT设定为4.0 h。每一周期进水5 min、反应225 min、沉淀5 min、排水5 min。在反应阶段需连续搅拌,并保持充水比为4/5。整个实验阶段不排泥。每隔一段时间从出水口取样测定。
1.3 分析方法
采用纳氏试剂光度法测定ρ(氨氮)[11]279-281;采用离子色谱法测定ρ(亚硝酸盐氮)[11]268-271、ρ(硝酸盐氮)[11]261。按式(1)计算容积基质氮去除速率(NRR,kg(/m³·d))。
NRR=Δ[ρ(氨氮)+ρ(亚硝酸盐氮)]/HRT ( 1)
式中,Δ[ρ(氨氮)+ρ(亚硝酸盐氮)]为进出水ρ(氨氮)+ρ(亚硝酸盐氮)的差值。
2 结果与讨论
2.1 厌氧氨氧化过程中基质浓度与pH的变化
在进水ρ(氨氮)和ρ(亚硝酸盐氮)分别为58.00 mg/L和79.28 mg/L(ρ(氨氮)∶ρ(亚硝酸盐氮)约为1∶1.3)、TN容积负荷为0.82 kg/(m³·d)、不控制反应pH的条件下,基质质量浓度与反应pH随反应时间的变化见图1。由图1可见:随着反应的进行,基质质量浓度与pH均发生了变化,ρ(氨氮)和ρ(亚硝酸盐氮)逐步降低,ρ(硝酸盐氮)和pH逐步上升;经过4.0 h反应,ρ(氨氮)和ρ(亚硝酸盐氮)分别降至3.18 mg/L和7.59 mg/L,ρ(硝酸盐氮)由0升至15.06 mg/L,同时反应pH由7.78升至8.71。这是由于厌氧氨氧化反应耗酸,随着反应的进行,基质被不断消耗,反应pH升高。

图1 基质质量浓度与反应pH随反应时间的变化
在上述过程中,反应pH与NRR的关系见图2。由图2可见:当反应pH为8.02时软件拟合的切线斜率最大,说明该条件下菌种的脱氮效能最高;pH升至8.44~8.72时,TN去除速率变化趋势逐渐平缓,切线斜率减小,菌种的脱氮效能降低。这是由于pH和基质浓度的变化改变了游离氨(FA)和游离亚硝酸盐(FNA)的浓度,间接对厌氧氨氧化菌造成影响。过高或过低的pH会引起厌氧氨氧化菌活性显著下降[12-14],也易引发菌种的中毒[15]或基质缺乏。
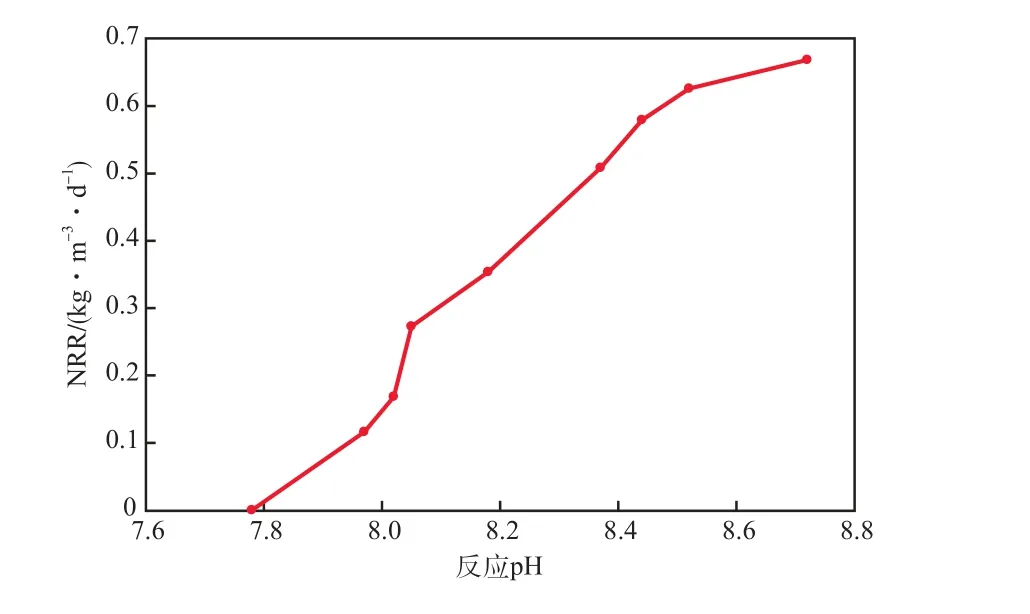
图2 反应pH与NRR的关系
2.2 恒定反应pH对厌氧氨氧化过程的影响
在进水ρ(氨氮)和ρ(亚硝酸盐氮)分别为120.00 mg/L和159.33 mg/L(ρ(氨氮)∶ρ(亚硝酸盐氮)约为1∶1.3),TN容积负荷为1.62 kg/(m³·d)、恒定反应pH的条件下,基质质量浓度随反应时间的变化见图3。由图3可见:反应pH恒定不变时,随着反应的进行,ρ(氨氮)和ρ(亚硝酸盐氮)不断减小;恒定反应pH=8.00时,脱氮效果最好,且与不控制反应pH时相比,可在较短的反应时间内达到较好的脱氮效果。
在上述条件下,恒定反应pH时氨氮及亚硝酸盐氮的去除率见表1。由表1可见:反应1.0 h时,恒定反应pH为7.00和7.50时的氨氮及亚硝酸盐氮的去除率较恒定反应pH为8.00和8.50时要小,这是由于在相同的进水基质浓度、不同的恒定反应pH下,对应的FA的浓度不同,厌氧氨氧化菌所表现的活性也不同;反应4.0 h时,恒定反应pH为8.00时的氨氮及亚硝酸盐氮去除率分别达到98.39%和99.48%,反应周期率先结束,恒定反应pH为7.00和7.50时氨氮及亚硝酸盐氮去除率均达80%以上,而恒定反应pH为8.50时反应相对缓慢;恒定反应pH为8.00时的氨氮及亚硝酸盐氮去除率始终大于其他pH时。这是因为:在不同的恒定反应pH条件下,存在NH4+及NH3的不同形态,NH4+可以透过菌体的细胞壁进入细胞内部,从而影响微生物的活性;当pH增大时,NH4+转化成的FA增多,高浓度FA对微生物具有一定的毒性,影响其脱氮性能。因此,将反应体系稳定在适宜的pH下,并控制基质浓度,调节FA浓度以降低对厌氧氨氧化菌的毒性影响显得尤为重要[16]。
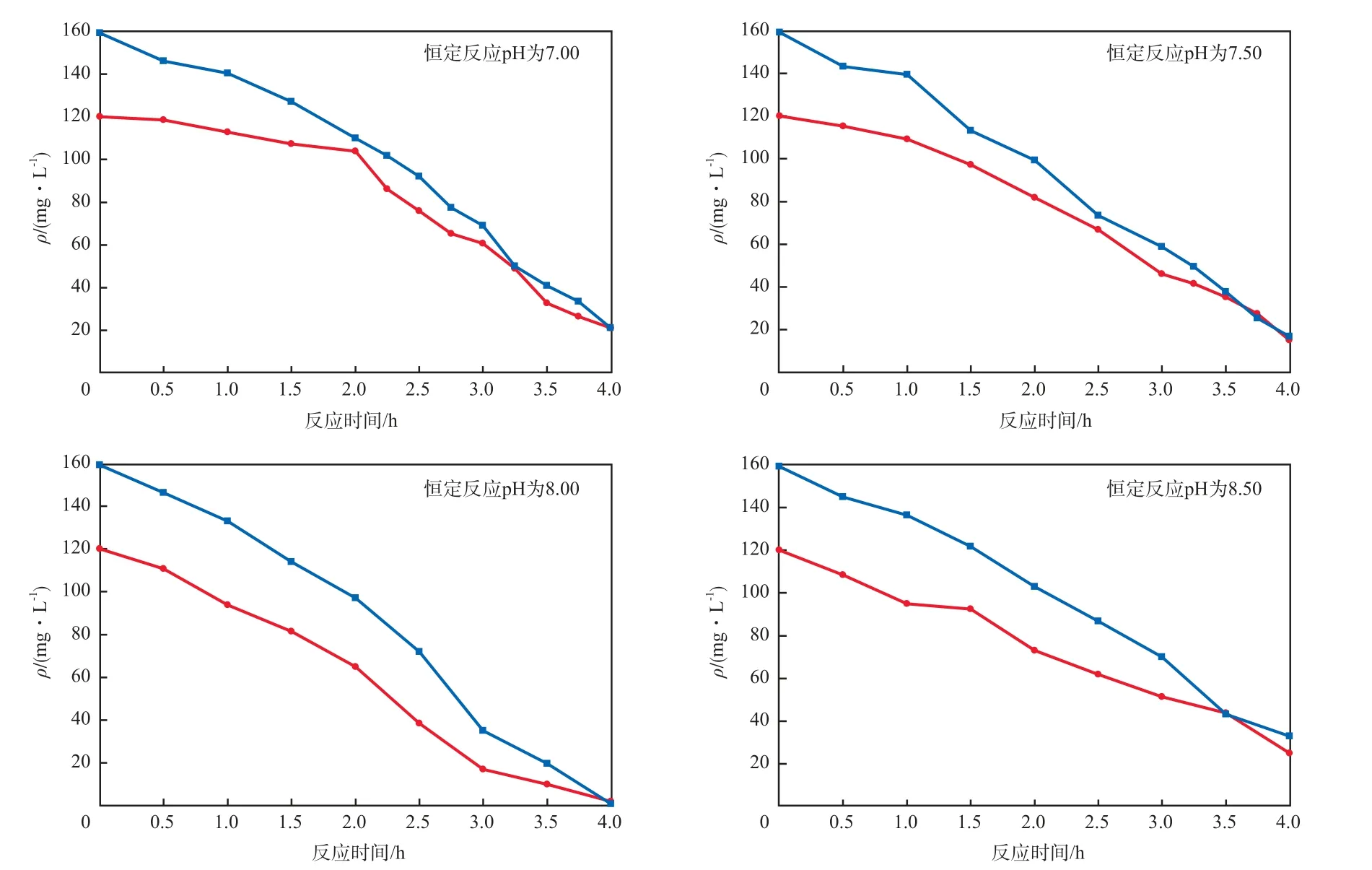
图3 恒定反应pH时基质质量浓度随反应时间的变化

表1 恒定反应pH时氨氮及亚硝酸盐氮的去除率
2.3 恒定反应pH对厌氧氨氧化脱氮性能的影响
恒定反应pH时NRR随反应时间的变化见图4。由图4可见:随反应pH的上升,NRR总体呈现先增快后减慢的趋势;整个反应过程中,恒定反应pH为8.00时的NRR均快于其他pH条件。
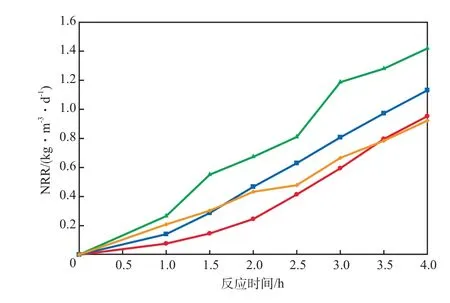
图4 恒定反应pH时NRR随反应时间的变化
将反应4.0 h时的NRR与对应的恒定反应pH数据进行拟合,拟合方程见式(2),拟合曲线见图5,拟合优度判定系数为0.904 2。
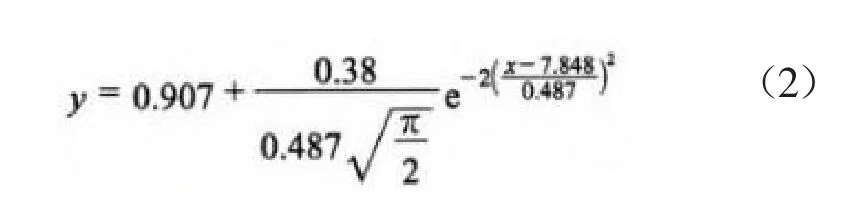
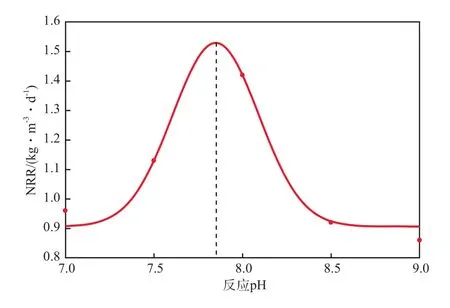
图5 NRR与恒定反应pH的拟合曲线
由图5可见:恒定反应pH对NRR的影响表现为钟形曲线;随恒定反应pH的升高,NRR先增快后减慢;当恒定反应pH由7.00升至8.00时,NRR增至1.42 kg/(m³·d);继续升高恒定反应pH会抑制厌氧氨氧化菌的活性,NRR不断减慢。由式(1)求导可得,当恒定反应pH为7.85时,NRR达理论最大值1.52 kg/(m³·d),厌氧氨氧化菌的活性最大。
低pH减少了FA的浓度但是增加了FNA的浓度,高pH增加了FA的浓度但减少了FNA的浓度,两者的浓度均会影响厌氧氨氧化菌的活性[17]。当pH高于9.00、ρ(氨氮)为120.00 mg/L时,由Anthonisen方程式[18]计算可得FA质量浓度为71.86 mg/L,该浓度基本达到FA对厌氧氨氧化菌的抑制常数75.6 mg/L[19],可诱发氨中毒,抑制厌氧氨氧化菌的活性,影响其脱氮性能。pH会通过影响微生物细胞内的电解质平衡而直接影响厌氧氨氧化菌的活性。pH对细胞膜的结构、渗透性以及保持细胞质子浓度所需的能量均会产生影响。高浓度的FA通过细胞膜进入细胞,改变了细胞内部的pH,中和了膜电位,最终导致了细胞死亡[20]。
2.4 讨论
上述实验结果表明,通过对反应过程中pH的调控,可在较短的反应时间内实现对高含氮废水的处理。唐崇俭等[21]在启动中试反应装置时发现,前期未调控反应的进出水pH,无厌氧氨氧化反应发生;调整pH后有明显的厌氧氨氧化反应发生。由此可见,通过对pH的调控可加快反应的启动,可将pH作为厌氧氨氧化反应器启动进程的指示参数。朱杰等[22]将进水pH维持在7.5,反应器运行效果良好,氨氮去除率可上升至86.96%,但反应的HRT过长,运行成本增加。由于厌氧氨氧化为pH升高的反应,故可适当提高反应过程中pH的设定值,一方面可节省酸的用量,另一方面可缩短反应时间。Tang等[23]采用SBA-ANAMMOX工艺对制药废水进行处理时发现,将pH控制在8.0左右可避免低于浓度限值的FA对反应造成抑制。陈胜等[24]在填充床稳定运行过程中发现,pH维持在8.0左右时厌氧氨氧化菌活性处于较高水平。以上研究结果均与本实验获得的结论具有较好的一致性。因此,通过对反应过程中pH的调控,不仅可缩短启动及反应的时间,且能获得较高的脱氮性能,对工程应用具有很好的指导意义。
3 结论
a)在进水ρ(氨氮)和ρ(亚硝酸盐氮)分别为58.00 mg/L和79.28 mg/L,不控制反应pH的条件下,随着反应的进行,pH不断升高,当pH=8.02时,厌氧氨氧化菌的脱氮效能最高。
b)在进水ρ(氨氮)和ρ(亚硝酸盐氮)分别为120.00 mg/L和159.33 mg/L、恒定反应pH为8.00的条件下,反应4.0 h时的NRR达1.42 kg/(m³·d)、氨氮去除率达98.39%、亚硝酸盐氮去除率达99.48%。
c)反应pH对厌氧氨氧化菌活性的影响表现为钟形拟合曲线。最适pH的理论值为7.85,反应4.0 h时的NRR理论最大值达1.52 kg/(m³·d),此时厌氧氨氧化菌的活性最大。
[1] Magrí A,Béline F,Dabert P. Feasibility and Interest of the Anammox Process as Treatment Alternative for Anaerobic Digester Supernatants in Manure Processing: An Overview[J]. J Environ Manage,2013,131:170 - 184.
[2] 陈昕. 含氨氮催化剂生产废水的处理[J]. 化工环保,2014,34(2):128 - 132.
[3] Aktan C K,Yapsakli K,Mertoglu B. Inhibitory Effects of Free Ammonia on Anammox Bacteria[J]. Biodegradation,2012,23(5):751 - 762.
[4] 杨洋,左剑恶,沈平,等. 温度、pH值和有机物对厌氧氨氧化污泥活性的影响[J]. 环境科学,2006,27(4):691 - 695.
[5] Monballiua A,Desmidta E,Ghyselbrecht K,et al. Enrichment of Anaerobic Ammonium Oxidizing(Anammox) Bacteria from OLAND and Conventional Sludge:Features and Limitations[J]. Sep Purif Technol,2013,104:130 - 137.
[6] Kawagoshi Yasunori,Fujisaki Koichiro,Tomoshige Yuki,et al. Temperature Effect on Nitrogen Removal Performance and Bacterial Community in Culture of Marine Anammox Bacteria Derived from Sea-Based Waste Disposal Site[J]. J Biosci Bioeng,2012,113(4):515 - 520.
[7] Cema G,Plaza E,Trela J,et al. Dissolved Oxygen as a Factor Inf uencing Nitrogen Removal Rates in a One-Stage System with Partial Nitritation and Anammox Process[J]. Water Sci Technol,2011,64(5):1009 - 1015.
[8] Carvajal-Arroyo J M,Sun Wenjie,Sierra-Alvarez Reyes,et al. Inhibition of Anaerobic Ammonium Oxidizing (Anammox) Enrichment Cultures by Substrates,Metabolites and Common Wastewater Constituents[J]. Chemosphere,2013,91(1):22 - 27.
[9] Puyol D,Carvajal-Arroyo J M,Li G B,et al. High pH (and not Free Ammonia) is Responsible for Anammox Inhibition in Mildly Alkaline Solutions with Excess of Ammonium[J]. Biotechnol Lett,2014,36(10):1981–1986.
[10] 鲍林林,赵建国,李晓凯,等. 常温低基质下pH值和有机物对厌氧氨氧化的影响[J]. 中国给水排水,2012,28(13):38 - 42.
[11] 原国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4版. 北京:中国环境科学出版社,2002.
[12] Oshiki Mamoru,Shimokawa Masaki,Fujii Naoki,et al. Physiological Characteristics of the Anaerobic Ammonium-Oxidizing Bacterium ‘Candidatus Brocadia sinica’[J]. Microbiology,2011,157(6):1706 - 1713.
[13] Jaroszynski L W, Cicekb N, Sparling R,et al. Importance of the Operating pH in Maintaining the Stability of Anoxic Ammonium Oxidation (Anammox) Activity in Moving Bed Biof lm Reactors[J]. Bioresour Technol,2011,102(14):7051 - 7056.
[14] Jane Gao W J,Lin H J,Leung K T,et al. Inf uence of Elevated pH Shocks on the Performance of a Submerged Anaerobic Membrane Bioreactor[J]. Process Biochem,2010,45(8):1279 - 1287.
[15] Fernández I,Dosta J,Fajardo C,et al. Shortand Long-Term Effects of Ammonium and Nitrite on the Anammox Process[J]. J Environ Manage,2012,95(S):S170 - S174.
[16] Jung J Y,Kang S H,Chung Y C,et al. Factors Affecting the Activity of Anammox Bacteria during Start up in the Continuous Culture Reactor[J]. Water Sci Techlnol,2007,55(1/2):459 - 468.
[17] Tao Wendong,He Yuling,Wang Ziyuan,et al. Effects of pH and Temperature on Coupling Nitritation and Anammox in Biof lters Treating Dairy Wastewater[J]. Ecol Eng,2012,47:76 - 82.
[18] Anthonisen A C,Loehr R C,Prakasam B S,et al. Inhibition of Nitrification by Ammonia and Nitrous Acid[J]. JWPCF,1976,48(5):835 - 852.
[19] 郑平,胡宝兰. 厌氧氨氧化菌混培物生长及代谢动力学研究[J]. 生物工程学报,2001,17(2):193 -198.
[20] Vangsgaard A K,Mauricio-Iglesias M,Valverde-Pérez B,et al. pH Variation and Inf uence in an Autotrophic Nitrogen Removing Biofilm System Using an Effcient Numerical Solution Strategy[J]. Water Sci Technol,2013,67(11):2608 - 2615.
[21] 唐崇俭,郑平,陈建伟,等. 中试厌氧氨氧化反应器的启动与调控[J]. 生物工程学报,2009,25(3):406 - 412.
[22] 朱杰,黄涛,范兴建,等. 厌氧氨氧化工艺处理高氨氮养殖废水研究[J]. 环境科学,2009,30(5):1442 - 1448.
[23] Tang Chongjian,Zheng Ping,Chen Tingting,et al. Enhanced Nitrogen Removal from Pharmaceutical Wastewater Using SBA-ANAMMOX Process[J]. Water Res,2011,45(1):201 - 210.
[24] 陈胜,孙德智,遇光禄. 填充床快速启动厌氧氨氧化反应器及其脱氮性能研究[J]. 环境科学,2010,31(3):691 - 696.
(编辑 魏京华)
对废聚乙烯热解过程的研究
Fuel,2014,133(10):276
废高密度聚乙烯(HDPE)可转化为大量的气体(转化率大于 90%)。感应加热被引入作为热解废HDPE的一种高效节能方法。研究人员研究了加氢裂化对烷烃-烯烃比的影响,并评估了连续操作模式下催化剂的失活和再生性能。
研究人员深入研究了废聚乙烯瓶的热催化裂解,以确定在连续模式下操作该工艺的可能性。以强大的催化性能和精确的选择性而著称的两种类型的沸石催化剂(HUSY 和HBeta),被用来研究在不同的操作条件下生成产品的产率。研究人员通过气相色谱-质谱联用仪分析了液体和气体样品,按照烷烃、烯烃和芳烃确定碳氢化合物链分布。在加热且没有催化剂存在的条件下,气体产率达到17.8%;当HUSY和HBeta沸石催化剂被用于蒸汽接触模式时,气体产率提高到93%~96%。当采用节能感应加热时,气体产率降至57%。在加氢裂化下,由于C13以上馏分中烷烃含量的提高,同时P-O质量比提高,气体产率进一步下降到51.6%。
该催化剂失活的阶段研究表明,当废HDPE被连续装进反应器时,HUSY和HBeta沸石开始失去其活性。在HDPE第三次装填之后,固体和液体蜡产生的数量急剧增加,且该过程开始类似热裂解。当在550 ℃下用工业空气进行催化剂再生时,获得90%以上的高气体产率,表明催化剂可再生。
生物质和塑料废弃物的混合废料热解降低能耗
Energy,2014,75(10):127
废弃物混合物的热共处理在过去的10年里得到了很多关注。这主要是由于某些协同效应,如石油产量的增大和质量的改善、某些原料供应的短缺以及整个热解工艺的改进。为了在生物质和塑料废弃物的共热解中实现上述的协同效应,通过热解重量分析(TGA)和不同的反应器进行了许多实验。
塑料在热解过程中的热性能不同于生物质,因为它的分解发生在高温范围,可迅速地释放挥发物质,相比而言生物质的热分解温度范围更宽。设计一个适当的混合原料的配方和操作策略可以减轻操作困难,同时减少能耗和/或提高产品产量。因此对整个共热解过程中使用的能耗的可能协同效应的研究是有价值的。
在这项研究工作中,两种不同的建模方法被用于研究在聚苯乙烯(PS)和竹子废料之间能源相关的协同效应。质量的损失量和挥发性物质的产生量表明,这两种原料之间存在重要的相互作用。研究结果还表明,当PS和竹子一起共热解时,两种建模方法都具有明显的总能源降低的协同效应,但第二种方法(允许两种原料之间相互作用)的总能源使用量减少得更多,可达6.2%,取决于在混合的掺混料中PS的比例。
(以上由彭琳供稿)
Effect of pH on Denitrification Efficiency of Anaerobic Ammonia Oxidation Reaction
Chen Zongheng1,2,Xu Shanshan1,2,Li Xiang1,2,Liu Fuxin1,2
(1. Institute of Environmental Biotechnology,Suzhou University of Science and Technology,Suzhou Jiangsu 215011,China;2. School of Environmental Science and Engineering,Suzhou University of Science and Technology,Suzhou Jiangsu 215011,China)
The effect of pH on denitrif cation eff ciency of anaerobic ammonia oxidation (ANAMMOX) bacteria was studied using ANAMMOX granular sludge in a SBR with constant pH. The experimental results show that: Under the conditions of inf uentρ(NH4+-N) andρ(NO2--N) 58.00,79.28 mg/L respectively,TN volume loading 0.82 kg/(m³· d) and uncontrolled pH,the reaction pH increases continually and the denitrif cation eff ciency of the bacteria is highest when pH=8.02;Under the conditions of influentρ(NH4+-N) andρ(NO2--N) 120.00,159.33 mg/L respectively,TN volume loading 1.62 kg/(m³·d),constant pH 8.00 and reaction time 4.0 h,the nitrogen removal rate (NRR)reaches 1.42 kg/(m³·d) and the removal rates of NH4+-N and NO2--N are 98.39%,99.48% respectively;The f tting curve shows that the theoretical optimum pH is 7.85,and the theoretical maximum NRR is 1.52 kg/(m³·d) at 4.0 h of the reaction time.
anaerobic ammonium oxidation (ANAMMOX);pH;nitrogen removal rate (NRR);sequencing batch reactor(SBR);denitrif cation eff ciency.
X703
A
1006 - 1878(2015)02 - 0121 - 06
2014 - 10 - 22;
2015 - 01 - 18。
陈宗姮(1988—),女,江苏省盐城市人,硕士生,电话18761987464,电邮402439022@qq.com。联系人:李祥,电话 13606134203,电邮 lixiang68411364@163.com。
国家自然科学基金项目(51408387);江苏省环保厅重大项目(201104);江苏省2012年度普通高校研究生科研创新计划项目(CXZZ12-0858);江苏省研究生创新基金项目(CXZZ14-1289)。

