两个含N羧酸配合物的合成及晶体结构*
袁 颖,王菲菲,朱 纯,张云黔
(贵州大学化学与化工学院,贵州贵阳550025)
羧酸类有机配体如芳香族羧酸和含氮杂环羧酸等,由于具有较强的配位能力,配位方式灵活多样,在配位聚合物的合成中可作为良好的框架,与各种金属形成维数不同、结构多样的配位超分子化合物,该类化合物具有分子(离子)识别、气体及有机小分子吸附、催化及特殊的电学、磁学、光学等性质,是目前配位化学研究的热点[1-6]。3-(4,4’-联吡啶)丙酸(BPA)[7]是一种新型的羧酸配体,目前报道的配合物还很少。BPA配体同时含有O、N配位原子,不仅羧基以灵活多样的配位模式与金属参与键合,杂环中的N原子也可提供额外的配位点或潜在的氢键识别点与金属配位,从而展现出更加新颖而丰富的配位模式。对氨基苯甲酸含羧基和氨基两个配位基团,配位形式灵活多样,它既可以作为单齿配体分别用羧基或氨基配位,也可以作为二齿或三齿配体同时用羧基和氨基配位,因此是一种常见的有机配体,一系列单核、双核结构和多维结构的配合物已有一些报道[8-10]。
本文选用两种结构相似的含N羧酸配体:3-(4,4’-联吡啶)丙酸(BPA)和对氨基苯甲酸(p-ABA),合成得到两个过渡金属配合物:2[Ni(SO4)(H2O)3(BPA)]·2(H3O)·6(H2O)(1)和[Cd
(H2O)(p-ABA)2]·2(H2O)(2)。用元素分析、红外光谱、X-射线单晶衍射等方法对配合物进行了结构表征,并对配合物2的热稳定性进行了考察。
1 实验部分
1.1 试剂和仪器
3-(4,4’-联吡啶)丙酸按文献[7]合成,实验所用试剂 p-氨基苯甲酸、Ni(SO4)·6H2O和 Cd(NO3)2·4H2O等均为分析纯。
Bruker Smart Apex2 CCD X-射线单晶衍射仪;Bruker Vertex 70 FT-IR红外光谱仪;Netzsch STA499C综合热分析仪;Elenmentar Vario ELⅢ元素分析仪。
1.2 配合物的合成
1.2.1 配合物 [Ni(SO4)(H2O)3(BPA)]2·2(H3O)·6(H2O)(1)的合成:
将0.012 g(0.05 mmoL)BPA、0.026 g(0.1 mmoL)NiSO4·6H2O 溶于5 mL H2O:DMF(1∶1)混合溶液中,加热回流3 h,冷却至室温,过滤;滤液在室温下静置,一周后的得到绿色块状晶体。FTIR(KBr固体压片,v/cm-1):3242(s),1570(s),1480(m),1103(s),750(m),600(w),530(w)。元素分析(%,按C26H48N4O26Ni2S2计算,括号内为计算值):C 30.79(30.73),H 4.77(4.81),N 5.52(5.45)。
1.2.2 [Cd(H2O)(p-ABA)2]·2(H2O)(2)的合成:
将0.027 g(0.1 mmoL)3,5-二氧乙酸基苯甲酸、0.012 g(0.1 mmoL)p-HABA、0.062 g(0.2 mmoL)Cd(NO3)2·4H2O和0.06 g(0.1 mmoL)KOH溶于10 mL蒸馏水中,加热回流3h,冷却至室温,过滤;滤液在室温下静置,三天后得到无色针状晶体。FTIR(KBr固体压片,v/cm-1):3364(s),1607(s),1519(s),1403(s),1255(m),1175(m),945(s),844(m),784(m),630(m)。元素分析(%,按 C14H18N2O7Cd计算,括号内为计算值):C 38.33(38.27),H 4.14(4.17),N 6.39(6.33)。
1.3 晶体结构测定
选择尺寸约为0.3×0.25×0.25 mm的配合物晶体,使用Bruker Smart Apex2 CCD单晶X射线衍射仪,经石墨单色化的MoKα射线(λ=0.071073 nm),以φ-ω扫描方式在一定θ范围内收集衍射数据。衍射强度数据进行了Lp校正、经验吸收校正。晶体结构由直接法解得,结构解析和精修用SHELX-97程序完成,氢原子坐标由理论计算得到。
2 结果与讨论
2.1 配合物[Ni(SO4)(H2O)3(BPA)]2·2(H3O)·6(H2O)(1)的晶体结构
配合物1为正交晶系,空间群为P bcn,a=7.219(8)Å,b=19.25(2)Å,c=29.15(3)Å,α =90.00°,β =90.00°,γ =90.00°,V=4051(8)Å3,Z=8,Dx=1.666 g·cm-3,R1=0.0590,wR2=0.1950。
在配合物1晶体结构的不对称单元中,包含两个Ni(Ⅱ)离子(Ni1、Ni1a),两个BPA配体和两个配位SO2(4阴离子。中心Ni(Ⅱ)离子采用6配位模式,为八面体几何构型,6个配位原子分别为BPA配体的羧基氧原子(O1)、另一个BPA配体的胺基N原子(N1a)、SO2-4阴离子的氧原子(O3)及三个配位水分子(O1W、O2W、O3W),Ni(Ⅱ)离子(Ni1)与配位原子间键长分别为:Ni1-O1,2.086(4)Å;Ni1-O3,2.084(4)Å;Ni1-N1a,2.106(5)Å,Ni1-O1W,2.085(5)Å,Ni1-O2W,2.085(4)Å,Ni1-O3W,2.093(4)Å。BPA配体的羧基氧原子(O1)以单齿配位方式与Ni(Ⅱ)离子(Ni1)配位,胺基N原子(N1)与另一个Ni(Ⅱ)离子(Ni1a)配位,两个BPA配体同时与两个Ni(Ⅱ)离子进行配位作用,形成首尾相连的双核配合物(图1)。

图1 配合物1不对称单元的晶体结构(图中氢原子及结晶水分子被省略)
配合物1分子中配位水分子O1W、O3W分别与两个相邻配合物分子的配位SO2-4阴离子的氧原子(O4b、O5c)形成氢键作用,同时,配位SO2-4阴离子的氧原子(O4、O5)与另两个相邻配合物分子的配位水分子(O1Wb、O3Wc)形成氢键作用,作用距离分别为:O4-O1W,2.689 Å;O5-O3W,2.686 Å。每个配合物分子通过氢键作用分别与6个相邻配合物分子连接形成三维超分子结构(图2)。
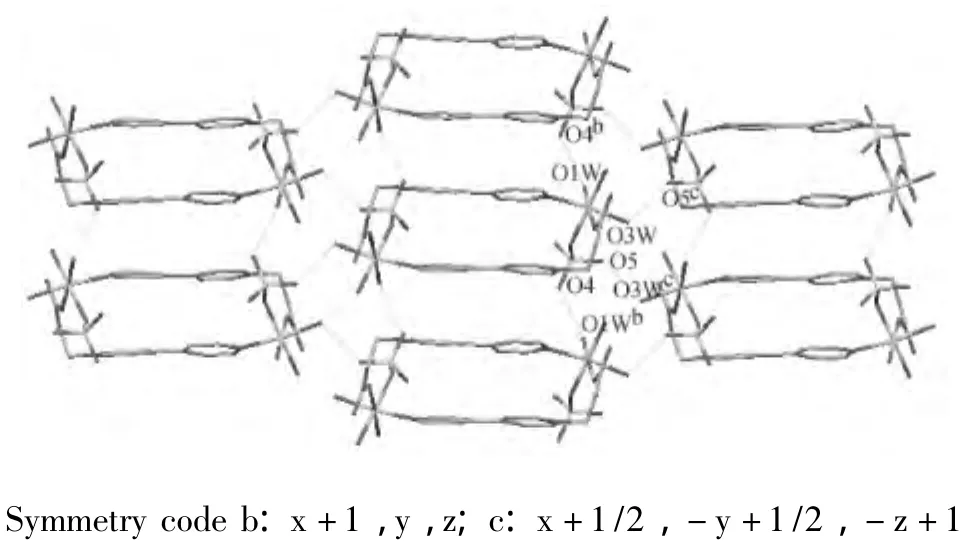
图2 配合物2通过氢键网络形成三维超分子结构
2.2 配合物[Cd(H2O)(p-ABA)2]·2(H2O)(2)的晶体结构
配合物2为单斜晶系,空间群为C 2/c,a=15.4064(11)Å,b=6.1937(4)Å,c=17.8267(13)Å,β =106.254(4)°,V=1633.1(2)Å3,Z=4,Dx=1.784 g·cm-3,R1=0.0306,wR2=0.0843。
配合物2为两种配体与Cd(Ⅱ)离子混配合成的副产物,其结构与文献[9]类似。在晶体结构的不对称单元中,一个Cd(Ⅱ)离子(Cd1)同时与4个p-ABA配体和一个水分子配位,为7配位变形八面体几何构型,7个配位原子中,4个为两个p-ABA 配体的羧基 O 原子(O1、O2、O1i、O2i),每个羧基为双齿配位;2个为另两个p-ABA配体的胺基N原子(N1ii、N1iii),及1个配位 OH(阴离子(O3)(图1)。Cd(Ⅱ)离子(Cd1)与配位原子间键长分别为:Cd1-O1(O1i),2.340(2)Å;Cd1-O2(O2i),2.418(3)Å;Cd1-N1ii(N1iii),2.447(3)Å,Cd1-O1W,2.309(4)Å。两个Cd(Ⅱ)离子(Cd1、Cd1d)分别与2个p-ABA配体的羧基和胺基配位,形成2个p-ABA配体首尾相连的双核配合物结构基元,并进一步形成一维配位聚合链(图3),聚合链之间通过与结晶水分子的氢键作用,堆积形成具有多孔结构的三维超分子自组装体,孔隙中填充着一些结晶水分子(图4)。
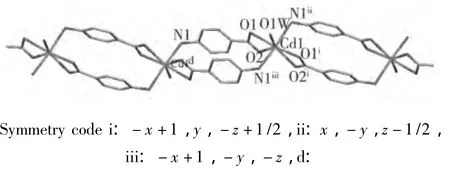
图3 配合物2形成的一维配位聚合链(图中氢原子及结晶水分子被省略)

图4 配合物2与结晶水分子间通过氢键作用在ac面堆积形成的孔结构
2.3 配合物2的热稳定性考察
图5为配合物2的热分析曲线。实验以空石英坩锅为参比,氮气流速50 mL·min-1,升温速率15℃·min-1,扫描范围35~800℃。
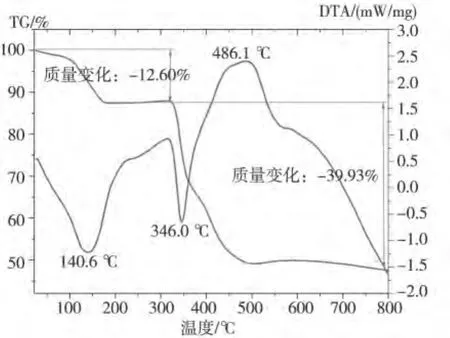
图5 配合物2的热分析曲线
热分析结果表明,配合物的失重分二个阶段,第一阶段从室温到200℃之间,失重为12.6%,失重部分应为配合物2中3个结晶水分子,与理论计算结果(12.4%)吻合,与此对应的是DTA曲线上140.6℃时的吸热峰为配合物失水。第二阶段失重在300~500℃之间,失重为39.93%,失重部分应为配合物2中两个苯胺基团(H2NC6H4-)分解,理论计算结果为42.09%,DTA曲线上346℃时的吸热峰对应的是苯胺基团的分解。DTA曲线上486.1℃时的放热峰,应为残留的两个羧酸基团(COO-)和Cd(Ⅱ)离子化合的表现,计算结果为45.79%与实际残留物的质量分数47.47%基本吻合,说明残留物为镉的羧酸盐。热分析结果表明,配合物2在300℃前是稳定的。
3 结论
本文选用两种结构相似的含N羧酸配体:3-(4,4’-联吡啶)丙酸(BPA)和对氨基苯甲酸(p-ABA),合成得到两个过渡金属配合物:[Ni(SO4)(H2O)3(BPA)]2·2(H3O)·6(H2O)(1)和[Cd(H2O)(p-ABA)2]·2(H2O)(2),用 X-射线单晶衍射方法测定了配合物的晶体结构。
配合物1中BPA配体的吡啶N原子和羧基原子都参与了配位,两个BPA配体同时与两个Ni(Ⅱ)离子配位,形成配体首尾相连的双核配合物。配合物2中p-ABA配体的两个配位基团氨基和羧基也都参与了配位,形成与配合物1相似的首尾相连的配合物结构单元,并进一步形成一维配位聚合链。两个配位物都通过氢键作用形成三维结构的超分子化合物。
[1]Hailian L,Eddaoudi M,Yaghi O M,et al.Establishing Microporosity in Open Metal-Organic Frameworks:Gas Sorption Isotherms for Zn(BDC)(BDC:1,4-Benzene dicarboxylate)[J].J Am Chem Soc,1998(120):8571-8572.
[2]Sun D F,Ke Y X,Mattox T M,et al.Temperature-dependent supramolecular stereoiso merlsm in porouscopper coordination networks based on a designed carboxylate ligand[J].Chem Commun,2005:5447-5449.
[3]Pang-Kuan Chen,Yun-Xia Che,Lin Xue,et al.Two 2-Fold Interpenetrated Frameworks Showing Different Topologies Based on the Isomerous Benzenedicarboxylate Mixed with a Flexible N,N'-Type Ligand.[J].Crystal Growth & Design,2006,6(11):2517-2522.
[4]Millward,A.R.,Yaghi,O.M.metal-organic frameworks with exceptionally high capacity for storage of carbon dioxide at room emperature[J].J Am Chem Soc,2005,127(51):17998-17999.
[5]M.T.Ding,J.Y.Wu,Y.H.Liu,K.L.Lu,Dissolution/Reorganization toward the Destruction Construction of Porous Cobalt(II)-and Nickel(II)-Carboxylate Coordination Polymers[J].Inorg.Chem,2009(48):7457-7465.
[6]He X,Yah Y,wu C D,et al.Hydrothermal Synthesis of Three Novel Multidimensional Metal-Organic Frameworks with Unusual U-nits and Mixed Ligands[J].Crys Growth Des,2006(6):820-826.
[7]Mausam Kalita,Sreeram Cingarapu,Santanu Roy,et al.Direct Synthesis of Aqueous Quantum Dots through 4,4'-Bipyridine-Based Twin Ligand Strategy.|Inorg.Chem,2012(51):4521-4545.
[8]George T A,Hammud H H,Isber S T.Structure,Thermal Analysis and Magnetism of the Doubly Bridged Linear Polymer[Ni(4-NH2-C6H4CO2)2(CH3OH)2]·CH3OH [J].Polyhedron,2006,25(14):2721-2729.
[9]Amiraslanov I R,Nadzhafov G N,Usubaliev B T,et al.An X-ray Structural Study of the Complexes of p-Aminobenzoic Acid with Metals[J].J Struct Chem(Engl.Transl.),1980,21(3):363-368.
[10]Wang R H,Hong M C,Luo H H,et al.Syntheses and Characterizations of Six Hydrogen-bonded Silver(I)Complexes from Assembly of Silver(I)Nitrate and Aminobenzoic acid[J].Inorg.Chim.Acta.,2006,357(1):103-114.

