1,6-亚甲基桥[10]轮烯并[3,4-g]-蒽醌衍生物的合成*
屈 莹,王志华,刘建军,左胜利
(北京化工大学 理学院,北京100029)
1964 年,Vogel[1]首次合成了具有芳香性的1,6-亚甲基桥[10]轮烯;Kuroda 等[2]综述了1,6-亚甲基桥[10]轮烯的研究进展及其在有机发光材料中的应用;近年来,1,6-亚甲基桥[10]轮烯衍生物被大量报道,并证实具有广阔的应用前景[3-6]。
蒽醌是一种重要的有机合成原料,在合成染料和许多天然产物(如色素、维生素和酶等)时有广泛的应用[7]。其中,羟基化 9,10-蒽醌由于具有多种生物活性和药理作用,有较好的临床应用潜力[8-9]。
ZrOCl2·8H2O作为高效固体酸催化剂,既能有效避免AlCl3催化剂对产物的污染,也能避免无机酸催化剂对环境的危害。
基于此,本文采用无溶剂合成法,以1,6-亚甲基桥[10]轮烯-3,4-二甲酸酐(1)为原料,ZrOCl2·8H2O/NaCl为催化剂,于165℃下分别与取代苯(2a~2d)经Friedel-Crafts缩合反应合成了4个新型的1,6-亚甲基桥[10]轮烯并[3,4-g]-蒽醌衍生物(3a~3d,Scheme 1),其结构经1H NMR,13C NMR,IR,MS和HR-MS表征。
1 实验部分
1.1 仪器与试剂
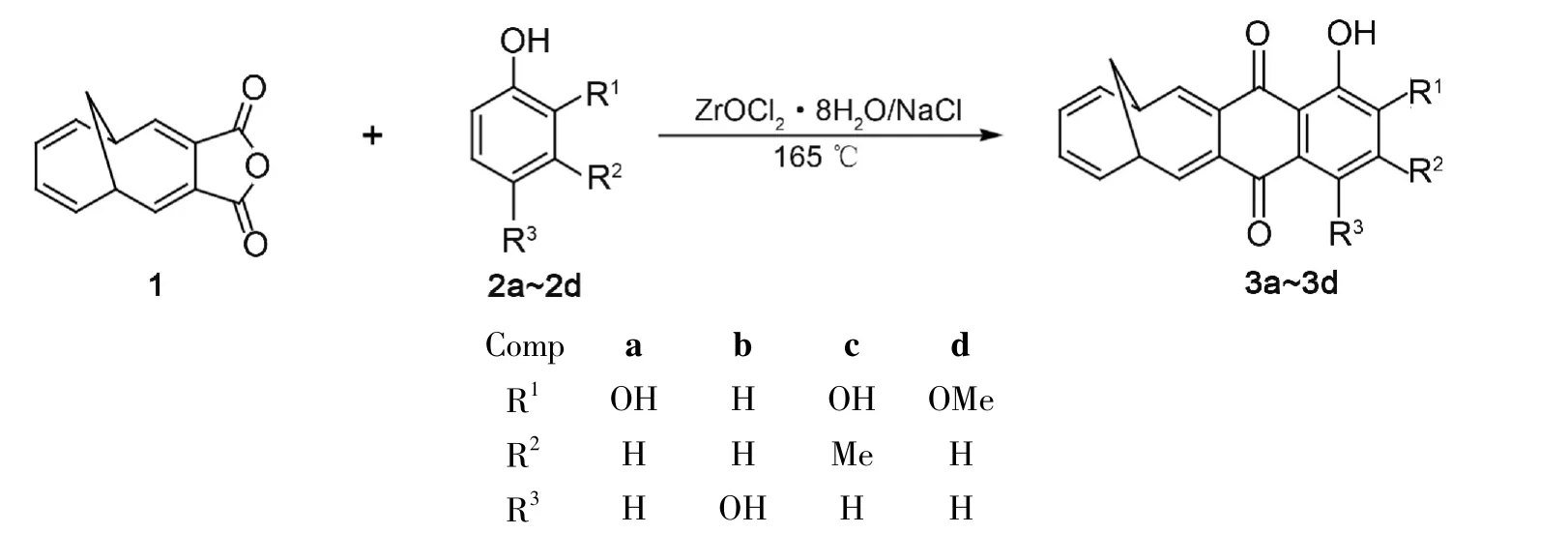
Scheme 1
Bruker AV-400 MHz型核磁共振仪(DMSO为溶剂,TMS为内标);Nicolet AVATAR-370型红外光谱仪(KBr压片);JEOL JMS-D-300型和GCMate型质谱仪(EI源,70 eV);Bruker MicroTOFQⅡ型液质联用仪(ESI源,负离子模式)。
1按文献[3]方法合成;其余所用试剂均为分析纯。
1.2 3a~3d的合成通法
在圆底烧瓶中加入无水ZrOCl2·8H2O 6.445 g(20 mmol)和NaCl 585 mg(10 mmol),搅拌下于155℃(浴温)使其完全熔融;加入1 2.12 g(10 mmol)和取代苯2a~2d 11 mmol,于165℃反应2 h。降温至0℃,静置,用乙酸乙酯(3×30 mL)萃取,合并有机层,用水(2×50 mL)洗涤,无水硫酸镁干燥,减压浓缩后经硅胶柱层析[洗脱剂:A=V(乙酸乙酯)∶V(正己烷)=2 ∶3]纯化得3a~3d。
1,6-亚甲基桥[10]轮烯并[3,4-g]1,4-二羟基-蒽醌(3a):红色固体,产率94%,m.p.199℃ ~200 ℃;1H NMR δ:12.94(s,2H),8.85(d,J=7.28 Hz,2H),8.15(m,2H),7.67(d,J=7.28 Hz,2H),7.46(m,2H),- 0.13(d,J=9.84 Hz,1H),-0.20(d,J=9.84 Hz,1H);IR ν:3 426,2 928,1 734,1 622,1 458,1 236,790 cm-1;MS m/z(%):76(21),104(41),148(11),176(2),213(14),290(5),304(100);HR-MS m/z:Calcd for C19H12O4{[M+H]+}304.089 2,found 304.074 0。
1,6-亚甲基桥[10]轮烯并[3,4-g]1,3-二羟基-蒽醌(3b):黄色固体,收率92%,m.p.229℃ ~230 ℃;1H NMR δ:13.13(s,1H),13.11(s,1H),8.76(d,J=6.16 Hz,2H),8.10(m,2H),7.22(d,J=6.16 Hz,2H),6.91(m,1H),6.19(m,1H),- 0.13(d,J=9.72 Hz,1H),-0.20(d,J=9.72 Hz,1H);IR ν:3 374,2 928,2 859,1 752,1 606,1 476,1 288,1 158,961,739 cm-1;MS m/z(%):77(3),104(5),213(15),276(12),289(3),304(100);HR-MS m/z:Calcd for C19H12O4{[M+H]+}304.089 2,found 304.073 9。
1,6-亚甲基桥[10]轮烯并[3,4-g]1,4-二羟基-2-甲基-蒽醌(3c):红色固体,收率 94%,m.p.164 ℃ ~ 166 ℃;1H NMR δ:13.45(s,1H),13.03(s,1H),8.87(d,J=6.96 Hz,2H),8.14(m,2H),7.41(d,J=6.96 Hz,2H),7.10(m,1H),1.28(m,3H),-0.16(d,J=9.76 Hz,1H),-0.21(d,J=9.76 Hz,1H);IR ν:3 417,2 916,1 759,1 631,1 451,1 279,1 219,1 039,918,739 cm-1;MS m/z(%):44(21),140(11),191(3),212(5),304(6),318(32);HR-MS m/z:Calcd for C20H14O4{[M+H]+}318.104 9,found 318.089 6。
1,6-亚甲基桥[10]轮烯并[3,4-g]1-羟基-4-甲氧基-蒽醌(3d):红色固体,收率88%,m.p.202 ℃ ~ 204 ℃;1H NMR δ:12.97(s,1H),8.62(m,2H),8.51(m,2H),7.92(d,J=2.76 Hz,2H),7.45(d,J=2.76 Hz,2H),6.56(m,3H),-0.12(d,J=9.88 Hz,1H),-0.22(d,J=9.88 Hz,1H);IR ν:3 426,2 926,2 850,1 759,1 613,1 450,1 270,1 219,918,737 cm-1;MS m/z(%):140(21),149(36),168(41),212(49),304(15),318(100);HR-MS m/z:Calcd for C20H14O4{[M+H]+}318.104 9,found 318.092 3。
2 结果与讨论
2.1 合成
合成3a~3d时,以熔融的 ZrOCl2·8H2O/NaCl为催化剂,采用无溶剂合成法,避免了传统催化剂和有机溶剂对产物和环境的污染,收率较高(>90%)。反应结束后,ZrOCl2·8H2O溶液经碱中和生成Zr(OH)4沉淀,可回收利用。
2.2 表征
(1)1H NMR
由3a~3d的1H NMR分析可见,不同取代基对轮烯环上H相对化学位移的影响不同:取代基通过诱导作用降低了轮烯环上的电子云密度,环电流抗磁性增强,产生去屏蔽作用,使共振信号向低场方向移动,δ值增大;由于屏蔽效应,桥亚甲基的两个质子吸收峰出现在高场,且分裂为二重峰。3a~3d的δ分别为 -0.13和 -0.20,-0.13和 -0.20,-0.16 和 -0.21,-0.12 和 -0.22。
羟基为强吸电子基,当其处于α-位时,能与羰基产生缔合,使内氢键强度增加,δ向低场移动(>12.25);羰基α-位有两个羟基时,羰基与两个羟基形成内氢键,δ向高场移动;对于β-位羟基,既可与邻位取代基上的质子缔合形成内氢键,也可与溶剂(DMSO)缔合形成分子间氢键,β-位羟基的δ比α-位羟基偏向高场。β-位羟基又分为两种情况:一类是羟基邻位无取代基(3a,3b和3d),另一类是羟基邻位有取代基(3c),由于空间位阻,后者的δ比前者偏向高场,分别为12.94(3a),13.11 和 13.13(3b),13.03 和 13.45(3c),12.97(3d)。
(2)IR
由3a~3d的IR分析可见,羟基吸收峰出现在比碳氢吸收峰频率高的部位。3 300 cm-1和2 800 cm-1~3 000 cm-1为亚甲基伸缩振动吸收峰;1 600 cm-1~1 800 cm-1为羰基伸缩振动吸收峰,表明3a~3d中有羟基和羰基生成。
(3)MS和HR-MS
由3a~3d的MS及HR-MS结果可见,测量值与计算值基本一致。
综上所述,合成的3a~3d结构与预期一致。
[1]Vogel E,H D Roth.The cyclodecapentaene system[J].Angew Chem Int Ed Engl,1964,3(3):228 -229.
[2]Kuroda S,Kajioka T,Fukuta A,et al.Revisitation of cycloheptatriene derivatives as a building block for various substituted and fused 1,6-methano[10]annulenes and substituted 4,9-methanothia[11]annulenes[J].Mini-Reviews in Org Chem,2007,4(1):31-39.
[3]金峰,刘建军,陈海平,等.无溶剂条件下新型N-氨基取代的1,6-亚甲基桥[10]轮烯-3,4-二甲酰亚胺的合成[J].合成化学,2009,17(5):606 -608.
[4]陈海平,刘建军,曹小舟,等.基于1,6-亚甲基桥[10]轮烯的多环化合物的合成[J].合成化学,2010,18(5):591 -593.
[5]金峰,刘建军,陈海平,等.新型N-氨基取代的1,6-亚甲基桥[10]轮烯-3,4-二甲酰亚胺的合成[J].北京化工大学学报(自然科学版),2010,37(1):28 -31.
[6]张若思,刘建军,屈莹,等.N-取代-R-氧基羰基-1,6-亚甲基桥[10]轮烯-3,-二甲酰亚胺类化合物的合成[J].合成化学,2013,21(4):458 -459.
[7]Madje B R,Shelke K F,Sapkal S B.An efficient one-pot synthesis of anthraquinone derivatives catalyzed by alumin aqueous media[J].Green Chem,2010,3(4):269 -273.
[8]Naeimi H,Namdari R.非均相温和条件下 AlCl3/H2SO4高效催化一锅法合成蒽醌衍生物[J].催化学报,2008,29(1):86 -90.
[9]Meazza G,Dayan F E,Wedge D E.Activity of quinones on colletotrichum species[J].J Agric Food Chem,2003,51(13):3824 -3828.

