基于HER2受体的新型喹唑啉衍生物的合成及其抗肿瘤活性*
蔡志强,马维英,王建雅,李志利,郭洪彬,蔡奥飞,薛 斌
(沈阳工业大学石油化工学院,辽宁辽阳 111003)
喹唑啉类化合物作为酪氨酸激酶抑制剂已有较为深入的研究,其成果促进了大量抗肿瘤药物的开发,如抗乳腺癌药物拉帕替尼。但喹唑啉类药物溶解性差、口服生物利用度低等缺点限制了其药效的充分发挥。
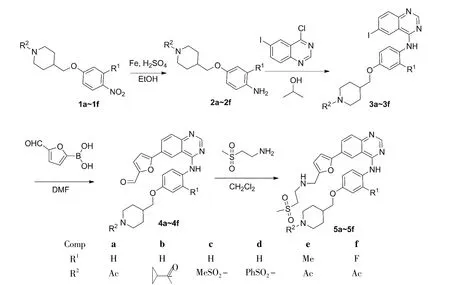
Scheme 1
为获得活性更强,溶解性和口服生物利用度更好的喹唑啉类药物,本文根据改变刚性的4-位取代芳环为柔性饱和脂肪环的设计思路[1-2],在文献[3-6]方法基础上,以取代 4-[(4-硝基苯氧基)亚甲基]哌啶(1a~1f)为原料,经还原、取代、Suzuki和加成4步反应合成了6个新型的喹唑啉衍生物(5a~5f,Scheme 1),其结构经1H NMR和ESI-MS表征。用MTT法考察了5a~5f对人脐静脉内皮细胞(HUVEC),人肺癌细胞(A-549),乳腺癌细胞(MCF-7)和人早幼粒白血病细胞(HL-60)的体外活性抑制效果。
1 实验部分
1.1 仪器与试剂
Bruker ARX-400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Agient 1100型液质联用仪。
1a~1f,实验室自制;其余所用试剂均为分析纯。
1.2 合成
(1)2a~2f的合成(以2a为例)
在四口瓶中加入乙醇500 mL,硫酸5 mL和1a 55.6 g(0.2 mol),搅拌下升温至回流;分批加入铁粉 56.0 g(1.0 mol),加毕,回流反应 3 h。冷却至室温,用氨水调至pH≈9。过滤,滤液用盐酸调至pH 4,析出固体;过滤,滤饼干燥得白色固体4-[(4-氨基苯氧基)亚甲基]-N-乙酰基哌啶(2a)36.8 g ,产率 73.6%;1H NMR δ:1.38(m,4H,CH2),2.05(m,1H,CH),2.42(s,3H,CH3),3.40(m,4H,CH2),3.94(d,J=8.0 Hz,2H,CH2),6.80(dd,4H,ArH),6.36(br,2H,NH2);ESI-MS m/z:249.2{[M+H]+}。
用类似的方法合成2b~2f。
(2)3a~3f的合成(以3a为例)
在反应瓶中加入 4-氯-6-碘喹唑啉 90.2 g(0.31 mol),2a 76.9 g(0.31 mol)和异丙醇 500 mL,搅拌使其溶解;回流反应2 h。冷却至室温,过滤,滤饼依次用异丙醇和乙醚洗涤,干燥得淡黄色固体1-【4-【{4-[(6-碘喹唑啉-4-基)氨基]苯氧基}甲基】哌啶-1-基】乙基酮 3a 120.5 g,产率 66.0%;1H NMR δ:1.31(m,4H,CH2),1.98(m,1H,CH),2.23(s,3H,CH3),3.20(m,4H,CH2),3.86(d,J=8.0 Hz,2H,CH2),6.62(m,2H,ArH),7.78(m,2H,ArH),7.98(d,J=6.0 Hz,1H,ArH),8.16(br,1H,NH),8.24(m,2H,ArH),8.66(s,1H,ArH);ESI-MS m/z:503.1{[M+H]+}。
用类似的方法合成3b~3f。
(3)4a~4f的合成(以4a为例)
在反应瓶中加入3a 13.0 g(26 mmol),乙酸钯5.8 g(26 mmol),三苯基磷6.8 g(26 mmol),三乙胺2 mL和DMF 35 mL,搅拌使其溶解;分批滴加5-甲酰基-2-呋喃硼酸3.6 g(26 mmol),滴毕,回流反应7 h。冷却至室温,倒入水中,用二氯甲烷(3×100 mL)萃取,合并有机相,用硫酸镁干燥,蒸除溶剂得粗品;粗品经硅胶柱层析[洗脱剂A:V(二氯甲烷)∶V(甲醇)=80∶1]纯化得黄色固体 5-【4-【{4-[(1-乙酰基哌啶-4-基)甲氧基]苯基}氨基】喹唑啉-b-基】呋喃-2-甲醛 4a 7.6 g,产率 62.4%;1H NMR δ:1.29(m,4H,CH2),1.96(m,1H,CH),2.27(s,3H,CH3),3.23(m,4H,CH2),3.82(d,J=8.0 Hz,2H,CH2),6.66(m,2H,ArH),7.79(m,2H,ArH),7.93(d,J=6.0 Hz,1H,ArH),8.15(br,1H,NH),8.22(m,3H,ArH),8.60(m,2H,ArH),9.80(s,1H,CHO);ESI-MS m/z:471.2{[M+H]+}。
用类似的方法合成4b~4f。
(4)5a~5f的合成(以5a为例)
在反应瓶中加入4a 4.7 g(10 mmol),2-甲磺酰基乙胺1.2 g(10 mmol)和二氯甲烷20 mL,搅拌下于室温反应2 h;滴加三乙酰基硼氢化钠5.5 g(26 mmol)的乙酸(3 mL)溶液,滴毕,反应6 h。倒入水中,用二氯甲烷(3×20 mL)萃取,合并有机相,用硫酸镁干燥,蒸干溶剂后经硅胶柱层析(洗脱剂A=30∶1)纯化得白色固体5a 3.2 g。
用类似的方法合成白色固体5b~5f。
5a:产率 55.5%;1H NMR δ:1.28(m,4H,CH2),1.99(m,2H,CH,NH),2.25(s,3H,CH3),2.82(s,3H,CH3),3.22(m,8H,CH2),3.72(s,2H,CH2),3.80(d,J=8.0 Hz,2H,CH2),6.63(m,2H,ArH),7.77(m,2H,ArH),7.96(d,J=6.0 Hz,1H,ArH),8.13(br,1H,NH),8.27(m,3H,ArH),8.62(m,2H,ArH);ESI-MS m/z:578.2{[M+H]+}。
5b:产率 46.3%;1H NMR δ:0.64(m,4H,CH2),1.13(m,1H,CH),1.24(m,4H,CH2),1.95(m,2H,CH,NH),2.88(s,3H,CH3),3.26(m,8H,CH2),3.77(s,2H,CH2),3.84(d,J=8.0 Hz,2H,CH2),6.67(m,2H,ArH),7.79(m,2H,ArH),7.98(d,J=6.0 Hz,1H,ArH),8.19(br,1H,NH),8.22(m,3H,ArH),8.61(m,2H,ArH);ESI-MS m/z:604.2{[M+H]+}。
5c:产率 57.1%;1H NMR δ:1.24(m,4H,CH2),2.06(m,2H,CH,NH),2.77(s,3H,CH3),3.05(s,3H,CH3),3.33(m,8H,CH2),3.75(s,2H,CH2),3.88(d,J=8.0 Hz,2H,CH2),6.69(m,2H,ArH),7.74(m,2H,ArH),7.86(d,J=6.0 Hz,1H,ArH),8.09(br,1H,NH),8.24(m,3H,ArH),8.69(m,2H,ArH);ESI-MS m/z:614.2{[M+H]+}。
5d:产率67.4%;1H NMR δ:1.30(m,4H,CH2),2.03(m,2H,CH,NH),2.88(s,3H,CH3),3.15(m,8H,CH2),3.79(s,2H,CH2),3.88(d,J=8.0 Hz,2H,CH2),6.69(m,2H,ArH),7.71(m,7H,ArH),7.92(d,J=6.0 Hz,1H,ArH),8.10(br,1H,NH),8.25(m,3H,ArH),8.71(m,2H,ArH);ESI-MS m/z:676.2{[M+H]+}。
5e:产率42.9%;1H NMR δ:1.19(m,4H,CH2),1.92(m,2H,CH,NH),2.07(s,3H,CH3),2.33(s,3H,CH3),2.89(s,3H,CH3),3.13(m,8H,CH2),3.67(s,2H,CH2),3.86(d,J=8.0 Hz,2H,CH2),6.78(m,2H,ArH),7.70(m,1H,ArH),7.88(d,J=6.0 Hz,1H,ArH),8.02(br,1H,NH),8.18(m,3H,ArH),8.48(m,2H,ArH);ESI-MS m/z:592.2{[M+H]+}。
5f:产率 39.5%;1H NMR δ:1.37(m,4H,CH2),2.06(m,2H,CH,NH),2.38(s,3H,CH3),2.94(s,3H,CH3),3.34(m,8H,CH2),3.88(s,2H,CH2),3.98(d,J=8.0 Hz,2H,CH2),6.93(m,2H,ArH),7.68(m,1H,ArH),7.90(d,J=6.0 Hz,1H,ArH),8.35(br,1H,NH),8.42(m,3H,ArH),8.85(m,2H,ArH);ESI-MS m/z:596.2{[M+H]+}。
1.3 体外抗肿瘤活性测试
取对数生长期的细胞,用0.25%胰蛋白酶消化(悬浮细胞无须消化)后悬浮于含10%小牛血清的培养液中;用玻璃滴管轻轻吹打成单细胞悬液,显微镜下用血细胞记数板记数活细胞;在96孔板每孔接种(3~6)×104个·mL-1的细胞悬液90 μL,置培养箱内培养;24 h后每孔加药液10 μL。以等浓度DMSO为阴性对照,不加细胞样为空白本底,各组均设6个复孔。继续培养48 h后每孔加入5 mg·mL-1的 MTT 溶液 10 μL,作用4 h后,吸去上清液。每孔加入DMSO 100 μL,置微量振荡器震荡5 min使结晶完全溶解,用酶标仪测定492 nm处的OD值,并用Bliss法计算IC50。
2 结果与讨论
表1为5a~5f的体外抗肿瘤活性结果。由表1可见,5d体外抗肿瘤活性相对较弱;5a,5c,5e和5f体外抗肿瘤活性与拉帕替尼基本相当;5b抗肿瘤活性最强。其可能原因在于,4-位苯胺基与6-位取代基团对5活性有至关重要的作用[7-8]。在喹唑啉4-位苯胺基的对位连接亚甲基哌啶基后再连接较小的取代基,可增强5对MCF-7的抑制活性;若连接体积较大的芳基,则5会因靶点空腔孔径太小,较大的基团无法键合而致使抗肿瘤活性明显降低。构效关系有待进一步研究。
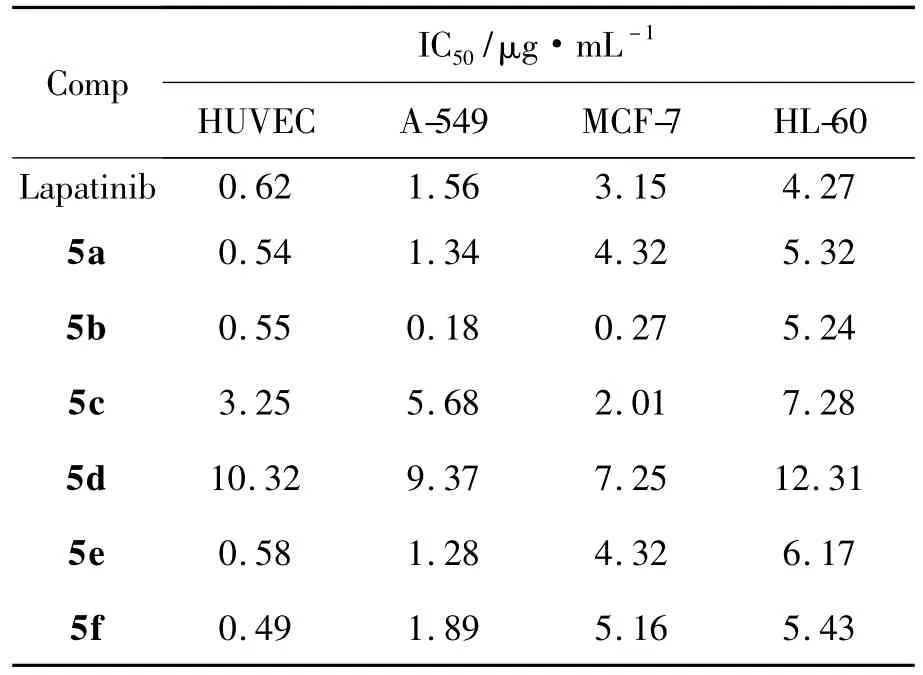
表1 5a~5f对人脐静脉内皮细胞,人肺癌细胞,乳腺癌细胞和人早幼粒白血病细胞的抑制活性Table 1 The inhibition activities of 5a~5f against HUVEC,A-549,MCF-7 and HL-60
3 结论
合成了6个新型的喹唑啉衍生物(5a~5f)。抗肿瘤活性实验结果表明:环丙基【4-【【4-【【6-【5-{[(2-甲磺酰基乙基)氨基]甲基}呋喃-2-基】喹唑啉-4-基】氨基】苯氧基】甲基】哌啶-1-基】甲基酮(5b)对人脐静脉内皮细胞(HUVEC),人肺癌细胞(A-549),乳腺癌细胞(MCF-7)和人早幼粒白血病细胞(HL-60)的抑制活性最好,其IC50分别为 0.55 μg·mL-1,0.18 μg·mL-1,0.27 μg·mL-1和 5.24 μg·mL-1。其抑制活性优于对照药拉帕替尼,显示出较好的抗肿瘤活性,值得进一步研发。
[1]茆勇军,李海泓,李剑峰,等.蛋白酪氨酸激酶信号转导途径与抗肿瘤药物[J].药学学报,2008,43(4):323-334.
[2]Kim K J,Li B,Winer J,et al.Inhibition of vascular endothelial growth favor induced angiogenesis suppresses tumor growth in vivo[J].Nature,1993,362(6423):841-844.
[3] 蔡志强,石玉,袁静,等.N-{3-氯-4-[(3-氟苄基)氧基]苯基}-6-碘喹唑啉-4-胺的合成工艺研究[J].合成化学,2011,19(3):421 -424.
[4]陈舒忆,吕同杰,严和平,等.喹唑啉类衍生物的合成及其抗肿瘤活性[J].合成化学,2013,21(1):92 -95.
[5]Mcclure M S,Osterhout M H,Roschangar F,et al.Quinazoline ditosylate salt compounds[P].WO 2 002 002 552,2002.
[6]Cai Z Q,Liu J G,Zhou W W,et al.[3-Chloro-4-(3-fuoro-benzyloxy)-phenyl]-(6-iodo-quinazolin-4-yl)amine[J].Acta Cryst E,2010,E66:1810.
[7]Norbert H H,Herbert N,Henning P,et al.Structurebased design of novel potent nonpeptide thrombin inhibitors[J].J Med Chem,2002,45(9):1757 -1766.
[8]Petrov K G,Zhang Y M,Carter M,et al.Optimization and SAR for dual ErbB-l/ErbB-2 tyrosine kinase inhibition in the 6-furanylquinazoline series[J].Bioorganic & Medicinal Chemistry Letters,2006,16(17):4686-4691.

