(S)-2,2,2-三氟-1-(2-甲基-1H-1-吲哚基)乙胺的不对称合成*
杨家林,章嘉丽,黄焰根
(东华大学化学化工与生物工程学院,上海 201620)
α-杂环取代胺类化合物用途十分广泛,既可作为合成抗癌药物的中间体[1],也可直接作为神经类药物[2]和金属催化剂 Pd的配体[3]。目前,对该类化合物的α-位进行化学修饰制得含氟和杂环取代的衍生物报道较少,且方法单一,产率不高。
本课题组长期从事含氟胺类化合物的不对称合成研究[4-5]。研究表明,在三氟甲基诱导效应作用下,α-三氟甲基醛亚胺的亲核加成活性提高,从而可与不同的亲核试剂加成制得含不同取代基的脂肪胺类化合物。这些胺类化合物活性较强,可作为合成前体[6-8]。
本文尝试以2-甲基吲哚(1)为原料,在碱性条件下与α-三氟甲基醛亚胺(2)经加成反应合成了关键中间体——含三氟甲基的(S)-叔丁基亚磺酰胺(3),收率95%,d/r>99/1;3脱除保护基得(S)-2,2,2-三氟-1-(2-甲基-1H-1-吲哚基)乙胺(4,Scheme 1),收率 97%,其结构经1H NMR,13C NMR,19F NMR,FT-IR,EI-MS和 HR-EI-MS确证。4的合成,为类似化合物的合成探索提供参考。

Scheme 1
1 实验部分
1.1 仪器与试剂
WRS-2A型熔点仪(温度未校正);Bruker AV 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet 380 FT-IR型傅立叶变换红外光谱仪(KBr压片);Finnign-MAT-8430型质谱仪。
2按文献[9]方法合成;其余所用试剂均为分析纯。
1.2 合成
(1)3的合成
氮气保护下,在反应试管中加入1 197 mg(1.5 mmol)的 THF(5 mL)溶液,搅拌下于 -42℃注入 2.5 mol·L-1正丁基锂 0.67 mL(1.67 mmol),滴毕,反应1 h(反应液变为红棕色);依次滴加2 214 mg(1.0 mmol)和 Ti(OPri)4284 mg(1.0 mmol)的 THF(5 mL)溶液,滴毕,反应至终点(TLC检测)。加入饱和NH4Cl溶液10mL淬灭反应,用乙酸乙酯(3×10 mL)萃取,合并有机相,用Na2SO4干燥,旋干溶剂后经硅胶柱层析[洗脱剂A:V(石油醚)∶V(乙酸乙酯)=3∶1]纯化得淡黄色固体3 338 mg,收率95%,m.p.108℃ ~110 ℃,[α]26D-21.8°(c 0.50,CHCl3);1H NMR δ:8.49(s,1H),7.58(dd,J=14.1 Hz,10.8 Hz,1H),7.35 ~7.20(m,1H),7.17 ~7.04(m,2H),5.06(qd,J=7.8 Hz,4.0 Hz,1H),3.93(d,J=3.8 Hz,1H),2.39(s,3H),1.33(s,9H);13C NMR(101 MHz)δ:135.33(d,J=8.7 Hz),134.62(d,J=5.9 Hz),125.78 ~ 125.72(d,J=11.0 Hz),121.71(d,J=18.8 Hz),120.41,118.44,56.79,55.36 ~ 53.94(m),22.42,11.96;19F NMR(377 MHz)δ:- 74.06(d,J=7.8 Hz);IR ν:3 398,3 264,2 969,1 663,1 460,1 064,744 cm-1;EI-MS m/z:355.1{[M+Na]+};HR-EI-MS m/z:Calcd for C15H19N2OSF3Na{[M+Na]+}355.106 8,found 355.106 2。
(2)4的合成
在三口瓶中加入3 178 mg(0.5 mmol),1,4-二氧六环2.0 mL和甲醇2.0 mL,搅拌使其溶解;加入 6 mol·L-1盐酸 1.2 mL,于室温反应 6 h。用 2 mol·L-1NaOH 溶液调至 pH 8.5,用乙酸乙酯(3×10 mL)萃取,合并有机相,用 Na2SO4干燥,旋干溶剂后经硅胶柱层析(洗脱剂A)纯化得淡黄色固体4 111 mg,收率97%,m.p.106℃ ~110 ℃,[α]26D-12.3°(c 0.25,CHCl3);1H NMR δ:8.10(s,1H),7.76(d,J=7.7 Hz,1H),7.35~ 7.25(m,1H),7.23 ~ 7.04(m,2H),4.71(q,J=8.1 Hz,1H),3.79 ~3.69(m,1H),2.43(s,3H),2.05(s,2H);13C NMR δ:135.23,134.02,126.73,126.73,121.55,119.99,119.45(d,J=1.6 Hz),110.55,67.09,51.60(q,J=31.5 Hz),12.12;19F NMR δ:-76.23(d,J=8.6 Hz);IR ν:3 401,3 064,2 925,1 617,1 458,1 156,747 cm-1;EI-MS m/z:228.1[M+];HR-EI-MS m/z:Calcd for C11H11N2F3[M+]228.087 9,found 228.087 4。
2 结果与讨论
2.1 合成
(1)2的合成
2在室温下很活泼,遇酸极易分解,故合成后必须经减压蒸馏提纯,并于-10℃密封保存。
(2)3的合成
用正丁基锂作有机碱,脱除1的N-H,形成氮负离子与2进行亲核加成反应合成了3,产率95%,d/r>99/1。3的19F NMR谱图中仅在 δ-74.51处有单一的氟信号,结合文献[5]分析,推测合成3的反应机理经历六元环过渡态(A,Chart 1)。大位阻的叔丁基处于e键,三氟甲基在其与硫原子孤对电子之间的斥力作用下,也处于e键,路易斯酸与叔丁基亚磺酰基上的O和N配位,导致过渡态A形成。根据以上分析可知,3中新形成的手性中心为R构型。
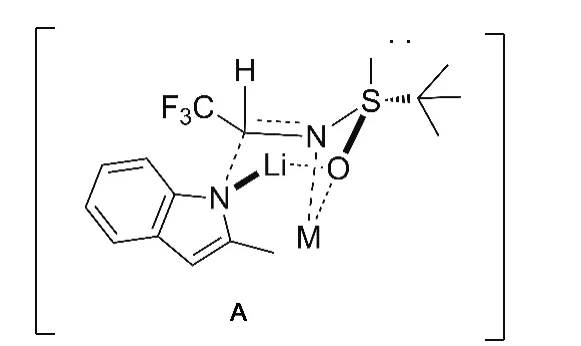
Chart 1
此外,我们也考察了1和2的反应条件。实验结果表明,采用K2CO3作碱,乙腈为溶剂,于室温反应也可合成3,但产率略有下降(92%)。
(3)4的合成
研究表明[4],叔丁基亚磺酰基可在温和条件下高效脱除,且不会影响手性中心构型。因此,实验中3在6 mol·L-1HCl溶液中于室温反应6 h,顺利脱除叔丁基亚磺酰基制得4,收率97%,d/r>99/1。比旋光测试显示无消旋现象发生。
在纯化4的过程中我们发现:与三氟甲基相邻的氨基仍显碱性,当pH<8.0时,纯化得4·HCl;当 pH >8.0 时,纯化得4。
[1]Keana J F,Westberg P,Curd J,et al.[P].US 00 841 007 5B2,2013.
[2]Katritzky A R,Lue P,Chen Y X.An alternative route to 2-substituted indoles via N-aminal-directed lithiation[J].J Org Chem,1990,55:3688 -3691.
[3]Yu J O,Lam E,Sereda J L,et al.2-Indolylphosphines,a new class of tunable ligands:Their synthesis,facile Derivatization and coordination to palladium(II)[J].Organometallics,2005,24:37 -47.
[4]Liu Y L,Liu J W,Huang Y G,et al.Lewis acid-catalyzed regioselective synthesis of chiral α-fluoroalkyl amines via asymmetric addition of silyl dienolates to fluorinated sulfinylimines[J].Chem Commun,2013,49:7492-7494.
[5]Xiao H Q,Huang Y G,Qing F L.Highly diastereoselective synthesis of trifluoromethylated-propargylamines by acetylide addition to chiral CF3-substituted N-tertbutanesulfinyl ketimines[J].Tetrahedron Asy,2010,21:2949-2955.
[6]Peng S Y,Zhuang X G,Wang J J.Histamine excites neurons of the inferior vestibular nucleus in rats by activation of H1 and H2 receptors[J].Neuroscience Lett,2013,87:541 -548.
[7]Barrett O J,Childs J L,Disney M D.Chemical microarrays to identify ligands that bind pathogenic cells[J].ChemBioChem,2006,7:1882 -1885.
[8]Xu C J,Shen Q,Sun X L,et al.Synthesis,characterization and highly selective ethylene dimerization to 1-butene of[O-NX]Ni(II)complexes[J].Chin J Chem,2012,30:1105 -1113.
[9]Truong V L,Ménard M S,Dion I.Asymmetric syntheses of 1-aryl-2,2,2-trifluoroethylamines via diastereoselective 1,2-addition of arylmetals to 2-methyl-N-(2,2,2-trifluoroethylidene)propane-2-sulfinamide[J].Org Lett,2007,9:683-685.

