槐豆总黄酮提取工艺及其抗氧化活性研究
任顺成,王 玮
(河南工业大学 粮油食品学院,河南 郑州 450001)
0 引言
槐豆(Sophora japonica L.)是槐角的别名,为国槐树的果实,具有凉血、止血、清热泻火的功效[1].它富含类黄酮和异黄酮类化合物,含有槐属苷、槐属双苷、山柰酚糖苷-C、槐属黄酮苷和芸香苷等,其中芸香苷的含量较高[2].槐豆也含有人体必需的氨基酸、亚麻酸、磷酯、胶原蛋白、亚油酸和多种微量元素[3],可以调节血脂、降低血压,在促进身体各系统清除垃圾方面有显著效果.
黄酮类化合物是植物通过光合作用产生的多酚类的次级代谢产物,因具有酚羟基而成为一种很强的抗氧化剂,有改善血液循环,降低胆固醇的药效.但黄酮类化合物的种类较多且结构相似,对于不同的自由基,其清除的机理有所不同,清除不同的自由基存在选择性,因此对各种自由基所表现出的清除能力也有强有弱[4].黄酮类化合物作为槐豆中的重要活性成分,已成为人们最为关注的一种天然的自由基清除剂,研究乙醇提取槐豆总黄酮的工艺条件及其抗氧化活性具有重要意义.本文采用分光光度法进行检测,以期为槐豆资源的合理开发利用提供理论参考依据.
1 材料与方法
1.1 试验材料
槐豆:采集于郑州栽培的国槐,晾干保存.
1.2 主要仪器与设备
SHX-D(Ⅲ)循环水式真空泵:巩义市予华仪器有限责任公司;101FX-1 电热鼓风干燥箱:上海树立仪器仪表有限公司;752 紫外可见分光光度计:上海菁华科技仪器有限公司.
1.3 试验方法
黄酮类化合物在乙醇和甲醇等极性溶剂中溶解能力大,在非极性溶剂中溶解能力小.黄酮类化合物与AlCl3溶液反应产生络合物,有荧光出现,并且颜色大部分为黄色.利用该性质测定黄酮类化合物含量.
1.3.1 黄酮的提取工艺流程
工艺流程:槐豆干燥→粉碎后过80 目筛→乙醇回流热提取→真空抽滤→滤液定容→待测样液.
为了保证在试验过程中乙醇浓度和体积不变,本试验采用冷凝回流的方法.
1.3.2 芦丁标准曲线的绘制
以芦丁为标准品,采用AlCl3显色法测定槐豆中黄酮类化合物含量[5-6].
精确称取芦丁标准品2.5 mg,用甲醇溶解,于25 mL 容量瓶中定容,得到质量浓度为0.1 mg/mL的芦丁标准溶液,精确吸取芦丁标准溶液1.0、2.0、3.0、4.0、5.0 mL 并分别置于25 mL 容量瓶中,分别加入20 mL 0.1 mol/L AlCl3甲醇溶液,定容,摇匀,10 min 后在420 nm 处测定吸光度(A).以吸光度为纵坐标、浓度为横坐标,绘制标准曲线.经统计分析,得回归方程:

式中:A 为吸光度;X 为黄酮质量浓度,μg/mL.
1.3.3 槐豆总黄酮的提取
称取1 g 槐豆干粉,按照试验设计条件加入一定量的提取剂,提取一定时间后趁热减压抽滤.滤液用90%的乙醇定容于100 mL 的容量瓶中摇匀,避光保存待测.
1.3.4 槐豆总黄酮含量的测定
用移液管移取2 mL 槐豆提取滤液于25 mL容量瓶中,加20 mL 0.1 mol/L AlCl3甲醇溶液,用90%的乙醇定容,摇匀,10 min 后,在波长420 nm处测定吸光度.依据标准曲线回归方程计算出提取滤液中槐豆总黄酮的浓度c (μg/mL),并按下列公式计算槐豆总黄酮的得率.
总黄酮得率(mg/g)=黄酮类化合物的质量(mg)/槐豆粉的质量(g).
1.3.4.1 单因素试验
以提取时间、提取温度、乙醇浓度和料液比为主要考察因素进行试验.提取时间选取0.5、1.0、1.5、2.0、2.5、3.0 h 6 个水平,提取温度选取40、50、60、70、80、90 ℃6 个水平,料液比选取1∶5、1∶10、1∶15、1∶20、1∶256 个水平,乙醇浓度选取30%、40%、50%、60%、70%、80% 6 个水平,分别进行单因素试验.
1.3.4.2 正交试验
根据单因素试验结果,以总黄酮得率为考察指标,对上述四因素进行正交试验,考察各因素对槐豆总黄酮得率的影响,得出最佳工艺条件.
1.3.5 槐豆总黄酮抗氧化活性的测定
在波长510 nm 处对上述槐豆总黄酮提取液的吸光度进行测定,根据芦丁标准曲线计算出总黄酮浓度,将待测液45 ℃旋蒸,浓缩至一定浓度后,提取液用70%的乙醇溶液适当稀释得到黄酮浓度为20、40、60、80、100 μg/mL 的提取液,作为不同浓度槐豆总黄酮类化合物的样品液.
2.2.3 角尺度 角尺度用来描述相邻树木围绕参照树的均匀性,用角尺度描述林木个体在水平地面上的分布形式,或者说种群的空间分布格局(描述非规则性)。任意2个邻接最近相邻木的夹角有2个,小角为α,最近相邻木均匀分布时的夹角设为标准角α0。对于n=4,标准角的可能取值范围为(60°,90°),最优标准角为72°[11]。角尺度被定义为α角小于标准角α0的个数占所考察的n个夹角的比例,其表达式式中:Wi为第i株参照树的角尺度;Zij为离散性变量,其值定义为,当第j个α角小于标准角α0时,Zij=1,否则式中:W为树种或林分平均角尺度;N为树种或林分的林木总株数。
1.3.5.1 对[DPPH·]清除能力的测定
测定方法参照文献[7-9].取洁净试管,加入2 mL 0.1 mmol/L 的[DPPH·]溶液和2 mL 不同浓度的黄酮待测溶液、Vc 溶液,用分光光度法测定,在波长517 nm 处测定体系的吸光度值Ai.用95%的乙醇溶液代替[DPPH·]溶液,测定吸光度值为Aj.用95%的乙醇溶液代替样品溶液重复试验,进行测定的吸光度值为A0.按下面公式计算样品的清除率.

式中:Ai表示2 mL[DPPH·]溶液+2 mL 黄酮提取液的吸光度;Aj表示2 mL 95%的乙醇溶液+2 mL 黄酮提取液的吸光度;Ao表示2 mL [DPPH·]溶液+2 mL 95%乙醇的吸光度.
1.3.5.2 对羟自由基[·OH]清除能力的测定
测定方法参照文献[10-12],在25 mL 比色管中依次加入6 mmol/L FeSO42 mL,6 mmol/L 水杨酸2 mL 及不同浓度的黄酮提取液、Vc 溶液2 mL加蒸馏水至8 mL,最后加2 mL 6 mmol/L 过氧化氢来启动反应,摇匀后于37 ℃水浴加热反应15 min.在510 nm 波长下测量各浓度的吸光度值Ai,并以蒸馏水为参比.清除率计算公式:

式中:Ao为空白对照液的吸光度;Ax为加入黄酮提取液后的吸光度;为不加H2O2黄酮提取液本底的吸光度.
1.3.5.3 对超氧阴离子[O2-·]的清除作用
测定方法参照文献[13-15],将4.7 mL Tris-HCl(pH=8.0)置于10 mL 具塞试管中,并在25 ℃水浴中加热20 min,分别加入不同浓度的黄酮提取液0.1 mL,均加入0.2 mL 邻苯三酚,混匀,水浴4 min 后将样品取出,加入1 滴10 mol/L 盐酸终止反应,在320 nm 处测定样品吸光度Ax.以甲醇为代替样品,测得空白对照吸光度A0.用Vc 作为对照品.按照下面的公式计算,得到不同黄酮浓度下对超氧阴离子自由基的清除率.

式中:Ao为空白对照液的吸光值;Ax为加入黄酮提取液后的吸光值.
2 结果与分析
2.1 单因素试验结果
2.1.1 提取时间的选择
在提取温度70 ℃、乙醇体积分数60 %、料液比1∶20 的条件下进行提取时间的单因素试验,结果见图1.

图1 提取时间对总黄酮得率的影响Fig.1 Effect of extraction time on the yield of total flavonoids
由图1 可知,提取时间为2 h 时,总黄酮得率最高,在0.5~2 h 时,总黄酮得率随提取时间的增加而逐渐增加,呈现出较好的量效关系.2.0~3.0 h时,总黄酮得率略有下降,其原因可能是溶于乙醇溶液中的槐豆黄酮类化合物长时间的加热,导致部分热不稳定的黄酮类物质的分解或转化,最终总黄酮减少.考虑产品纯度、黄酮得率、能源消耗等,因此选择提取时间为2 h.
2.1.2 提取温度的选择
在提取时间2 h、乙醇体积分数60%、料液比1∶20(g/mL)的条件下进行温度的单因素试验,结果见图2.

图2 提取温度对总黄酮得率的影响Fig.2 Effect of extraction temperature on the yield of total flavonoids
由图2 可知,提取温度为80 ℃时,总黄酮得率最高.提取温度为40~80 ℃,槐豆总黄酮得率随提取温度的增加逐渐增大,当温度高于80 ℃,总黄酮得率略有下降.由于温度升高导致槐豆中的部分热敏性黄酮类物质损失[16],高温还有助于分子的运动,增加了黄酮向细胞外的溶出率[17],从而使得总黄酮得率有所下降.综合考虑,选择提取温度为80 ℃.
2.1.3 料液比的选择
在提取时间2 h、乙醇体积分数60%、温度为80 ℃的条件下进行料液比的单因素试验,结果见图3.
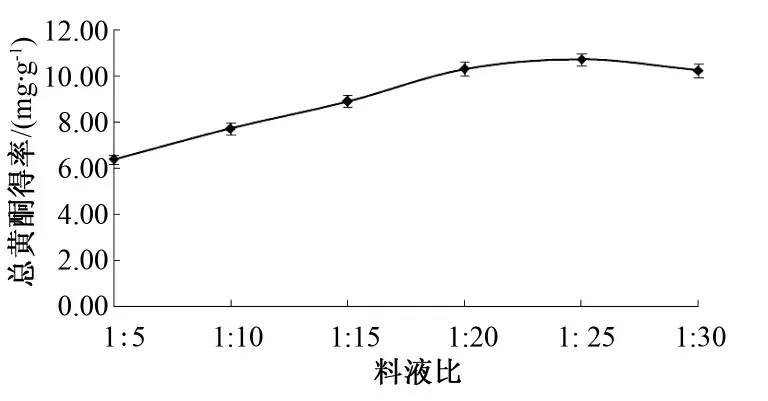
图3 料液比对总黄酮得率的影响Fig.3 Effects of material-liquid ratio on the yield of total flavonoids.
由图3 可知,料液比为1∶25 时,总黄酮得率最高.料液比在1∶5~1∶25 时,槐豆总黄酮得率随料液比的增大而增大,当料液比高于1∶25 时,槐豆总黄酮得率趋于稳定.可能由于回流提取是一种传质扩散过程,在料液比较小时,有效成分尚未完全溶出而溶液已达到饱和.料液比高于1∶25,此时,黄酮大部分已经溶出,槐豆黄酮的得率趋于稳定.综合考虑,选择料液比为1∶25.
2.1.4 乙醇体积分数的选择
在提取时间2 h、料液比1∶25、温度为80 ℃的条件下进行乙醇体积分数的单因素试验,结果见图4.

图4 乙醇体积分数对总黄酮得率的影响Fig.4 Effect of ethanol concentration on the yield of total flavonoids
由图4 可知,乙醇体积分数为60%时,总黄酮得率最高.乙醇体积分数在30%~60%时,随着体积分数增加,槐豆总黄酮得率呈增加趋势.乙醇体积分数增至70%时,槐豆总黄酮得率略有降低但差别不大,当增至80%时降低幅度明显.这可能是由于槐豆中的黄酮类物质的大部分是黄酮苷类物质.当乙醇体积分数增大时,部分醇溶性黄酮能较好地溶出.但当乙醇体积分数较大时,水溶性黄酮的溶解度会降低.综合考虑,选取乙醇体积分数为60%.
2.2 槐豆总黄酮提取工艺的优化
在以上单因素试验的基础上,设置四因素三水平进行L9(34)正交试验,考察各因素对总黄酮提取得率的影响,结果见表1,显著性分析见表2.
由表1 可以得出,以槐豆总黄酮得率为判断指标,各因素对槐豆总黄酮得率影响的大小顺序为乙醇体积分数>提取温度>料液比>提取时间.经SPSS 软件对数据进行显著性分析,表2 中乙醇体积分数的F 值极显著,其余几个因素的F 值均不显著.
从实际生产效益、经济成本和溶剂回收角度考虑,提取时间作为影响最小的因素可以选择2 h,因此最优组合为A3B2D1C2.最佳的工艺条件为乙醇体积分数70%,提取温度80 ℃,料液比1∶20,提取时间2 h,在此工艺条件下,总黄酮提取率较高.

表1 正交试验结果Table 1 Results of orthogonal experiment
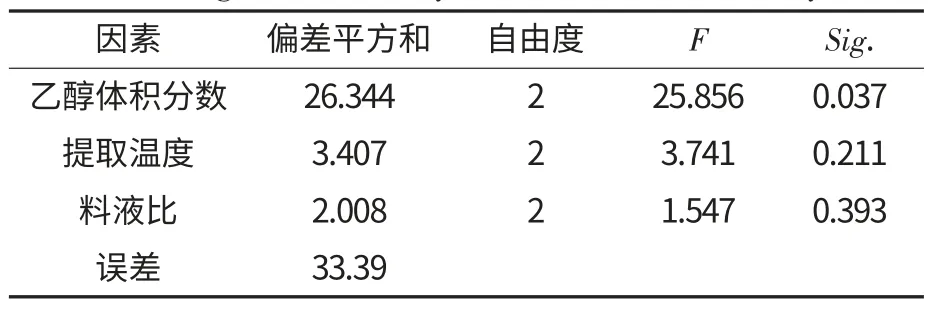
表2 总黄酮得率的显著性分析Table 2 Significant analysis of total flavonoids yield
2.3 验证试验
在提取温度为80 ℃、提取时间为2.0 h、料液比为1∶20、乙醇体积分数70%的条件下做验证试验,槐豆总黄酮平均得率为12.61 mg/g,6 次重复测定的相对标准偏差为0.017 %,表明重复性好,测定结果可靠.
2.4 槐豆黄酮氧化活性测定
2.4.1 槐豆黄酮清除[DPPH·]的能力(图5)
由图5 可知,槐豆黄酮提取液在20~40 μg/mL范围内的清除率增长较快.在40~100 μg/mL 范围内线性较好,呈量效关系,但增长缓慢.在试验条件下的最大清除率可达91.6%,槐豆黄酮提取液的抗氧化能力显著高于VC,表明其具有较强的对[DPPH·]的清除能力.
2.4.2 对羟自由基[·OH]清除能力的测定(图6)
由图6 可知,槐豆总黄酮提取液在20~40 μg/mL范围内,对[·OH]表现出一定的清除效果.在20~100 μg/mL 范围内,随浓度的增加,对[·OH]的清除率呈增长趋势.在试验条件下的最大清除率可达71.4%,对比Vc 清除羟自由基的能力可知,槐豆黄酮对羟自由基具有较强的清除能力.

图5 黄酮提取液对[DPPH·]的清除作用Fig.5 [DPPH·]-scavenging activity of flavonoids extract

图6 黄酮提取液对羟自由基[·OH]的清除作用Fig.6 [·OH]-scavenging activity of flavonoids extract
2.4.3 槐豆黄酮对超氧阴离子自由基[O2-·]的清除作用(图7)
由图7 可知,槐豆黄酮提取液在 20~100 μg/mL 范围内,槐豆总黄酮对[O2-·]具有比较好的量效关系.20~40 μg/mL 的范围内,随浓度的增加,对[O2-·]的清除作用增强不明显,在40~100 μg/mL的范围内随浓度的增加,对[O2-·]的清除率增强较明显.在试验条件下的最大清除率可达70.6%,对比Vc 清除超氧阴离子的能力可知,槐豆黄酮对超氧阴离子具有较强的清除能力.

图7 黄酮提取液对超氧阴离子自由基[O2-·]的清除作用Fig.7 [O2-·]-scavenging activity of flavonoids extract
3 结论
本试验采用乙醇回流法提取槐豆总黄酮,其最佳工艺条件为乙醇体积分数70%、提取温度80℃、提取时间2.0 h、料液比(g/mL)1∶20,此条件下总黄酮得率为12.61 mg/g.槐豆总黄酮显示出较强的自由基清除能力,其清除能力强弱依次为1,1-二苯基-2-三硝基苯肼自由基[DPPH·]、羟自由基[·OH]和超氧阴离子自由基[O2-·],这种清除能力优于VC,且其抗氧化活性与黄酮浓度呈显著的量效相关关系.
[1]冯爱青,胡秋娈,崔娟.槐豆中天然芦丁的提取工艺研究[J].安徽农业科学,2008,36(15):6163-6164.
[2]韦华梅,闫腾蛟,林宜沛,等.正交试验优选槐角总黄酮的提取工艺及不同来源槐角中总黄酮的含量测定[J].陕西中医,2011,32(9):1231-1233.
[3]潘维,罗增锋,刘锦梅.槐豆黄酮提取物对酪氨酸酶活性抑制作用的研究[J].现代农业科学,2008,15(8):12-15.
[4]Manjinder Singh,Maninder Kaur,Om silakari.Flavones:An important scaffold for medicinal chemistry[J].European Journal of Medicinal Chemistry,2014,12(84):206-239.
[5]任顺成,丁霄霖.玉米须黄酮类测定方法的研究[J].食品科学,2004,24(3):139-139.
[6]任顺成,常云彩,刘梦文.19 种花茶提取液中总黄酮得率及其清除自由基活性的研究[J].河南工业大学学报:自然科学版,2014,35(4):6-11.
[7]闫家凯,张国文,周佳,等.不同因素对夏枯草黄酮稳定性及DPPH 自由基清除活性的影响[J].南昌大学学报:理科版,2012,36(4):341-346.
[8]塔娜,李蜀眉,田唯平,等.桔皮中黄酮类化合物抗氧化活性的研究[J].内蒙古农业大学学报:自然科学版,2003,24(2):96-98.
[9]Jelena J Vuliĉ,Tatjana N Cebovic,Gordana S Cetkovic,et al.In vivo and in vitro antioxidant effects of beetroot pomace extracts[J].Journal of Functional Foods,2014,6:168-175.
[10]丁利君,吴倩萍.黄芪多糖的提取及其对自由基的清除作用[J].食品与机械,2003,19(4):7-9.
[11]付晓丹,汤春丰,刘壤莲,等.枇杷叶黄酮提取物的抗氧化作用研究[J].食品工业科技,2015(1):135-139.
[12]Solomon H.Antioxidant activity of Knipholone anthrone[J].Food Chemistry,2007,102:1042-1047.
[13]李旭,刘停.杜仲叶总黄酮微波辅助提取工艺的优化及其抗氧化活性研究[J].食品工业科技,2013,34(4):243-248.
[14]莫开菊,柳圣,程超.生姜黄酮的抗氧化活性研究[J].食品科学,2006,27(9):110-113.
[15]Simon W A,Sturm E,Hartmann Ha J,et al.Hydroxyl radical scavenging reactivity of proton pump inhibitors[J].Biochemical Pharmacology,2006,71:1337-1341.
[16]许先猛,王芬,乔冬.小麦麸皮总黄酮超声提取工艺研究[J].粮食加工,2014,39(2):51-53.
[17]吕凤娇,谢晓兰.黄芪总黄酮乙醇提取工艺研究[J].安徽农业科学,2012,40(33):16380-16382.

