GC-MS法测定白酒塑化剂样品前处理方法的选择与优化
徐 忠,陆步诗 *,李新社,汪小鱼,马利群,彭新凯
(1.邵阳学院 生物与化学工程系,湖南 邵阳 422000;2.湖南湘窖酒业有限公司,湖南 邵阳 422000;3.长沙市质量技术监督局,湖南 长沙 410004)
邻苯二甲酸酯(phthalates,PAEs)是环境激素类物质中的一类重要化合物,常应用于塑料,是增塑剂的组成部分。它能增加塑料的可塑性,改变加工树脂的流动性,增强制品的柔韧性[1]。从分子水平来看,塑料包装制品内部PAEs 与聚烯烃分子之间由氢键连接,这种共价键结合并非十分紧密,其化学性质相对独立,之间存有空隙,邻苯二甲酸酯类具有迁移效应,可由塑料中迁移出来,造成对土壤、水、特别是食品的污染[2]。研究表明,PAEs具有生殖毒性,有些具有雌性激素活性。长期接触易导致男子精子数量减少,活力降低,严重危害生殖健康。孕前能干扰胎盘的基因表达与内分泌活动,致使胎儿畸形,生长发育缓慢等不良影响[3]。此外PAEs可通过皮肤接触、饮食等途径进入人和动物体内,干扰正常激素分泌,影响正常生长代谢,具有潜在的生殖和发育毒性,若PAEs在体内长期积累可能引发基因紊乱胚胎致畸等[4-5]。
白酒生产过程中塑化剂主要源于酒泵进出乳胶管、塑料输酒管、封酒缸塑料布、塑料接酒桶、成品酒塑料内盖、成品酒塑料桶包装等。PAEs是溶于乙醇中的[6]。经过迁移,PAEs会从输送白酒的塑料管或存储白酒的塑料包装材料转移到酒中,迁移量与时间具有相关性,会增加酒中的塑化剂残留量[7-11]。给人们的身体健康带来了潜在的危害。因此,有必要对白酒生产各个环节的PAEs残留量进行快速,有效的监测,确保白酒的质量与安全。目前对白酒中塑化剂的检测方法大都采用GB/T 21911—2008《食品中邻苯二甲酸酯的测定》[12]的检测方法进行测定,该法采用正己烷直接提取,受白酒中乙醇的干扰,测定结果不准确[13]。本实验在GB/T 21911—2008及相关文献资料方法基础上,对影响因素进行探究,选择合适的前处理方法,优化仪器操作参数,以建立准确性好,精密度高的白酒塑化剂检测方法。
1 材料与方法
1.1 材料与试剂
白酒样:湖南湘窖酒业有限公司。
无水硫酸钠(分析纯):国药集团化学试剂有限公司;正己烷(色谱纯)、二氯甲烷(色谱纯)、乙酸乙酯(色谱纯)、丙酮(色谱纯):美国TEDIA公司;邻苯二甲酸二丁酯(dibutyl phthalate,DBP),纯度≥99.0%、邻苯二甲酸二(2-乙基)己酯(diethylhexyl phthalate,DEHP),纯度≥98.5%、邻苯二甲酸二异壬酯(diisononyl phthalate,DINP),纯度≥99.9%:德国Dr.Ehrenstorfer GmbH 公司。
1.2 仪器与设备
GC7890/5975MS型气相色谱-质谱联用仪(gas chromatography-mass spectrometry,GC-MS):美国安捷伦公司;CT14D型高速离心机:上海天美科学仪器有限公司;OA-SYSX型氮吹仪:北京同泰联科技发展有限公司;RE-52AA型旋转蒸发器:上海瑞兹仪器公司;SK-1 型涡旋混匀器:金坛市友联仪器研究所;SB-25-12DT型超声波清洗仪:赛飞(中国)有限公司;Milli-Q型超纯水系统:广州谱峰科学仪器有限公司。
1.3 方法
1.3.1 标准溶液配制
分别精确称取DBP、DEHP标准样品100 mg于100 mL容量瓶中,用正己烷定容为1 000 mg/L的标准储备液,将标准储备液用正己烷逐级稀释至质量浓度为0.5 μg/mL、1.0 μg/mL、2.0 μg/mL、4.0 μg/mL、5.0 μg/mL、10.0 μg/mL的系列标准溶液,于4 ℃冰箱保存待用。
1.3.2 样品前处理
(1)方法一(国标法):直接正己烷提取。称取5.0 g左右白酒样品于10 mL具塞玻璃试管中,加入2 mL正己烷提取液,涡旋2 min充分混匀,静置10 min后待其分层取上层清液,进行GC-MS分析。
(2)方法二:水浴氮吹后正己烷提取。称取5.0 g左右白酒样品于10 mL具塞玻璃试管中,于38 ℃水浴氮吹30 min至酒精挥发干。再加2 mL混合提取液(正己烷∶乙酸乙酯=4∶1)提取,涡旋2 min,置于离心机中离心5 min,转速设为3 000 r/min,静置分层,取上清液,待进行GC-MS分析。
(3)方法三:净化小柱提取。称取5.0 g左右白酒样品于10 mL具塞玻璃试管中,加入2 mL混合提取液(正己烷∶乙酸乙酯=4∶1),涡旋2 min充分混匀,3 000 r/min离心5 min,取上清液置于CNWBOND净化小柱中净化10 min,取出待GC-MS分析。
(4)方法四:固相萃取柱提取。称取5.0 g左右白酒样品于10 mL具塞玻璃试管中,加入5 mL混合提取液(正己烷∶乙酸乙酯=4∶1),充分涡旋混合2 min,4 000 r/min离心2 min,取上清液。再用5 mL混合提取液(正己烷∶乙酸乙酯=4∶1)重复提取一次,合并两次上清液。于38 ℃水浴氮吹至近干,用正己烷定容至2 mL,待固相萃取柱(solid phase extraction,SPE)净化。
洗脱程序:ProElut PSA 玻璃固相萃取柱(SPE柱)
活化:向SPE小柱中加入1.0 g无水硫酸钠,再依次加入5 mL丙酮,5 mL正己烷,弃去流出液。上样:加入待净化液,流速控制在1 mL/min内,收集流出液。洗脱:依次加入5 mL正己烷、5 mL 4%丙酮-正己烷溶液,接收流出液,合并上样、洗脱流出液。重新溶解:40 ℃缓慢氮气流吹至近干后挥干,用正己烷定容至1 mL,供GC-MS分析。
1.3.3 仪器工作条件
(1)色谱条件
色谱柱:DB-17MS毛细管气相色谱柱(30 m×0.25 mm×0.25 μm);进样口温度:250 ℃;升温程序:初始温度90 ℃,保持1 min,以15 ℃/min升温至220 ℃保持10 min,5 ℃/min升温至280 ℃,保持8 min;载气:氦气,纯度≥99.999%;流速:1 mL/min;进样方式:不分流;进样量:1 μL。
(2)质谱条件
电子电离(electron ionization,EI)源:70 eV;温度:230 ℃;色谱与质谱接口温度:280 ℃;监测方式:选择离子扫描模式(selected ion monitoring,SIM);溶剂延迟:5 min。
1.3.4 质谱特征碎片离子
3种邻苯二甲酸酯的保留时间,定性离子及其丰度比,定量离子见表1。
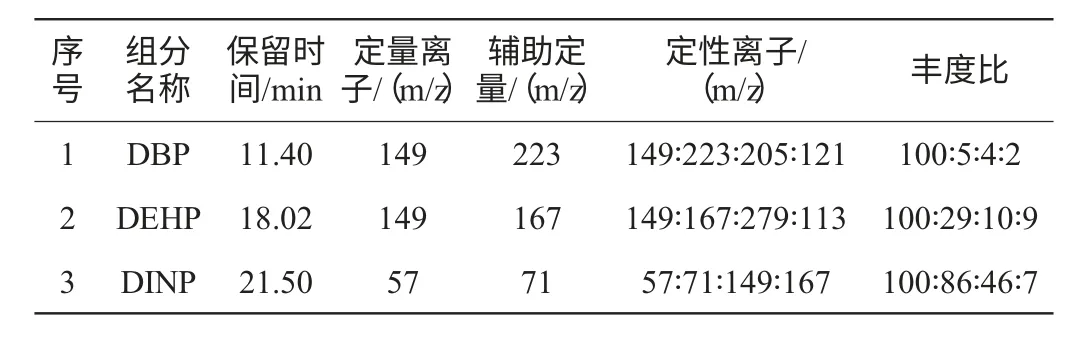
表1 邻苯二甲酸酯的定量离子、定性离子及其丰度比Table 1 Quantitative ion,qualitative ion and its abundance ratio of phthalates
2 结果与分析
2.1 样品中乙醇除去方式的选择
考虑到酒样中含有大量乙醇,而邻苯二甲酸酯类化合物能溶于乙醇中,造成正己烷提取PAEs效率偏低。同时酒样中含有的大量水分可能对离子源的灯丝造成损害。本研究分别采用沸水浴、旋转蒸发、氮吹、盐析处理同一酒样以除去乙醇。其中沸水浴温度控制在95 ℃左右,处理30 min;旋转蒸发和氮吹水温控制在40 ℃左右,处理30 min;盐析能降低酒精度数,还能防止乳化现象发生。称取18 g NaCl加入5.0 g酒样中盐析处理30 min;试验方法均采用方法一即GB/T 21911—2008《食品中邻苯二甲酸酯的测定》进行。重复测定6次,添加回收质量浓度为1.0 mg/kg。考察酒样DBP、DEHP的回收率及精密度。结果见表2。
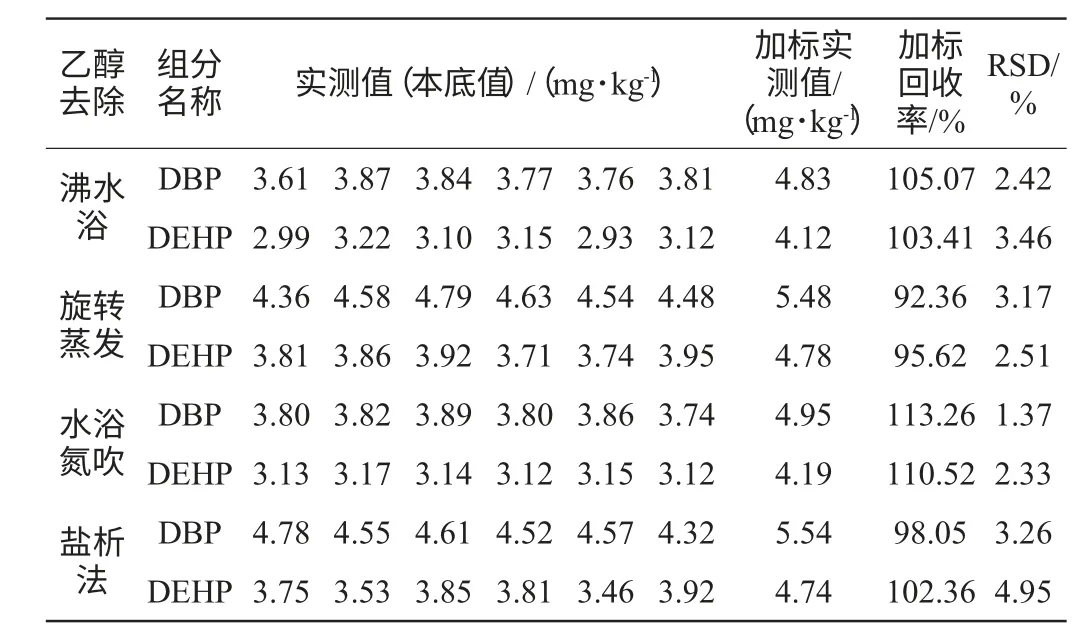
表2 不同乙醇去除方式的酒样DBP、DEHP测定结果及回收率Table 2 Results and recovery from of DBP and DEHP determination in liquor under different ethanol removal ways
从表2可知,旋转蒸发和盐析处理的酒样测定值均大于水浴氮吹、沸水浴处理的酒样。且前两种回收率为92.36%~102.36%,低于后两种的回收率(103.41%~113.26%)。可知旋转蒸发和盐析去除酒中乙醇效果较差,酒中的多种其他醇类、酯类、酸类存在干扰,与测定组分保留时间可能重合,造成测定值偏大。分析得知,沸水浴与氮吹处理的回收率比较接近,且相对标准偏差(relative standard deviation,RSD)值均在正常范围。考虑到沸水浴处理时间较长,不利于批量处理,本文选择氮吹来去除乙醇的干扰。
2.2 进样方式的选择与优化
称取相同质量的邵阳老酒样品(52%vol,第九批),采用方法二进行处理。一组直接进样(不加正己烷萃取),另一组正己烷萃取进样。同时做正己烷空白试验,以排除干扰,重复测定三次。考察DBP、DEHP、DINP三种组分出峰情况。结果见图1~图3。
结果表明,图1直接进样杂质峰太多,谱图出峰情况较差,基线不稳定,峰形不正。分离效果差,受其他杂质干扰较大。图2萃取后进样,出峰情况得到改善,峰型稳定,峰宽峰高均处在正常状态,分离效果好。干扰峰较少。图3均未检测到三种组分的出现,溶剂峰对待测波峰无影响。因此选择萃取进样方式。
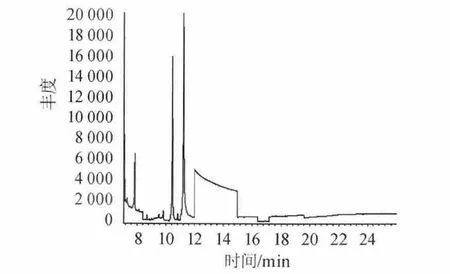
图1 直接进样测定酒中DBP、DEHP、DINP的总离子流图Fig.1 Total ion chromatorgraphy of DBP,DEHP and DINP determination in liquor by direct sampling way
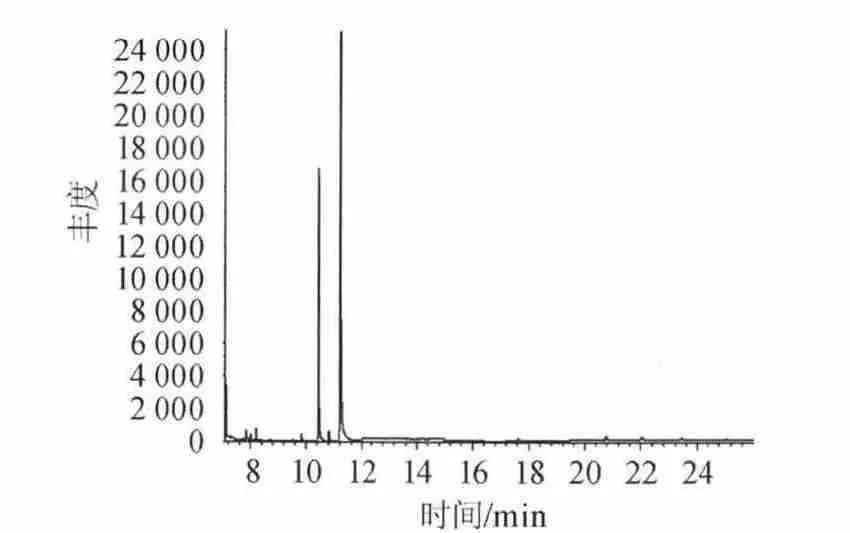
图2 正己烷萃取进样测定酒中DBP、DEHP、DINP的总离子流图Fig.2 Total ion chromatorgraphy of DBP,DEHP and DINP determination determination in liquor by N-hexane extraction sampling way
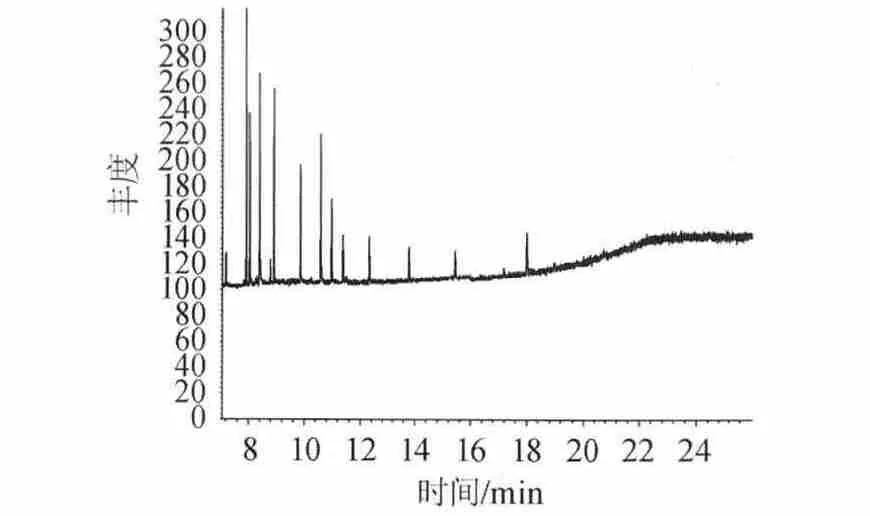
图3 正己烷全扫描离子色谱图Fig.3 Full scanning ion chromatograms of N-hexane
2.3 溶剂种类的选择与优化
萃取酒中PAEs物质常见的有机溶剂有正己烷、二氯甲烷、乙酸乙酯、乙醚等。PAEs是一类中极性化合物,为了改变提取溶剂的极性,提高各组分的回收率,选择不同混合溶剂配比条件考察其回收率。由图3可知,正己烷色谱图杂质峰少,本底干扰较小。选择正己烷为基准溶剂,与其他三种溶剂进行配比,进行回收试验。选取2 mL不同溶剂配比的有机溶剂测定不同酒精度邵阳大曲的各组分回收率,以方法一即直接提取进行样品处理。其配比分别为正己烷(100%)、正己烷∶二氯甲烷=4∶1、正己烷∶乙酸乙酯=4∶1、正己烷∶乙醚=4∶1。结果见表3。
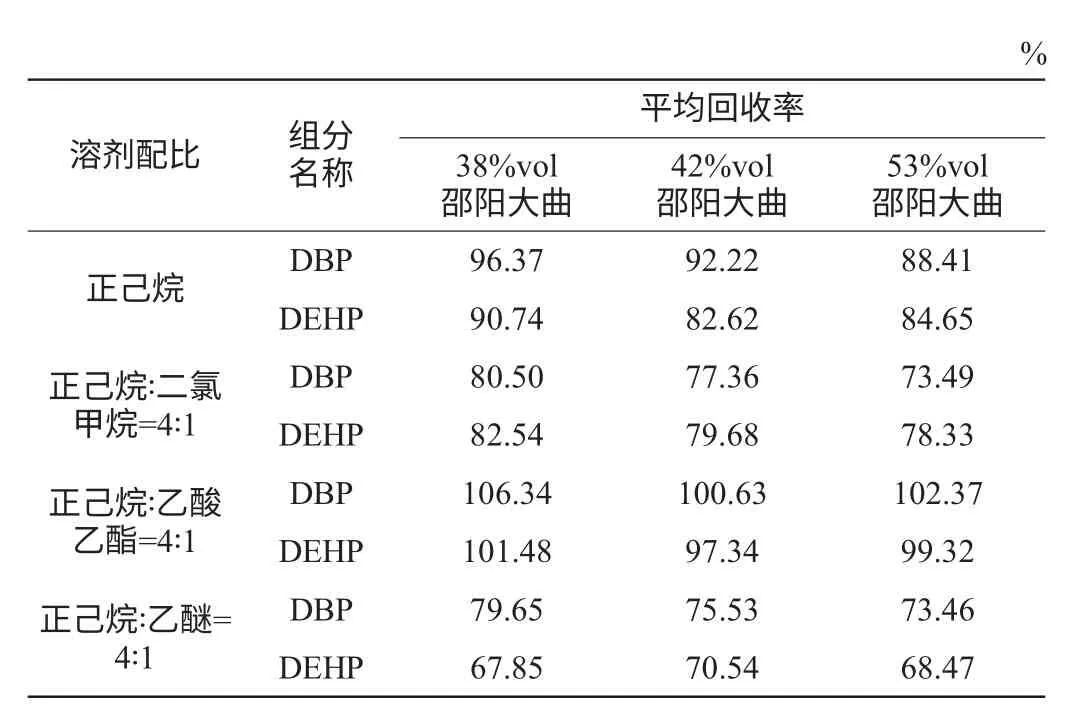
表3 不同溶剂配比下各组分的回收率情况Table 3 Recovery rate of various components by different solvent ratio
由表3可知,有机溶剂正己烷∶乙酸乙酯=4∶1的平均回收率为97.34%~106.34%,均高于其他三种的混合溶剂,正己烷提取效果仅次于正己烷与∶乙酸乙酯=4∶1。而二氯甲烷能与酒精混溶,影响其回收效果。乙醚稳定性较差[14],不利于有效提取酒样中塑化剂,故最终选择正己烷∶乙酸乙酯=4∶1为萃取溶剂。
2.4 样品前处理方式的选择与优化
根据乙醇去除方式、进样方式、溶剂种类选择实验结果,选取4种方法(方法一:直接正己烷提取;方法二:水浴氮吹后正己烷提取;方法三:净化小柱提取;方法四:SPE柱固相萃取)分别处理样品并对DBP、DEHP两个组分进行回收率试验:分别称取16份质量为5.0 g左右的酒样。分为4组,每组4份,其中一份为本底,另外3份依次添加标准溶液,添加水平依次为0.05 mg/kg、0.50 mg/kg、1.00 mg/kg。每种方法重复测定6次,结果见表4。
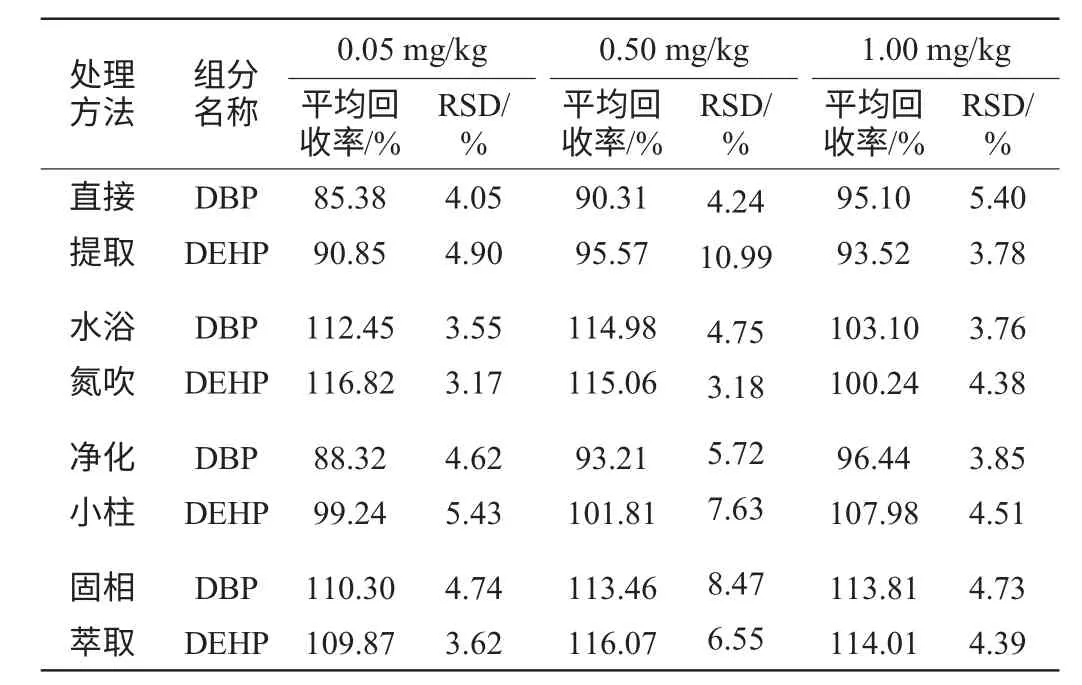
表4 不同样品前处理的白酒加标回收率与精密度试验结果Table 4 Results of liquor adding standard recovery rate and precision degree by different pretreatment
从表4可知,直接提取处理的酒样平均回收率在85.38%~95.57%之间,相对标准偏差(relative standard deviation,RSD)为3.78%~10.99%。净化小柱处理的酒样平均回收率在88.32%~107.98%之间,RSD为3.85%~7.63%。这两种前处理方式的加标回收率较为接近。说明这两种方法准确可行,处理的回收效果一致。水浴氮吹法平均回收率为100.24%~116.82%,RSD为3.17%~4.75%。而固相萃取平均回收率在109.87%~116.07%,RSD为3.62%~8.47%。表明这两种方法回收率相近且均高于直接提取处理、净化处理的回收率。同时精密度较好,方法重现性好。考虑到固相萃取方法,要求顺序操作,步骤过多,不利于大批量处理,因此本研究选择方法二作为前处理方法,即水浴氮吹法。
2.5 工作标准曲线、线性范围及检出限
将系列标准混合溶液0.5 μg/mL、1.0 μg/mL、2.0 μg/mL、4.0 μg/mL、5.0 μg/mL、10.0 μg/mL依次测定。以标准物的峰面积(Y)为纵坐标,以质量浓度(X)为横坐标,绘制标准曲线拟合线性方程。结果表明,各组分在线性范围内线性关系良好。以空白样品加标实验测定的化合物信噪比为3∶1时为浓度最低检出限。线性关系、线性范围、检出限见表5。
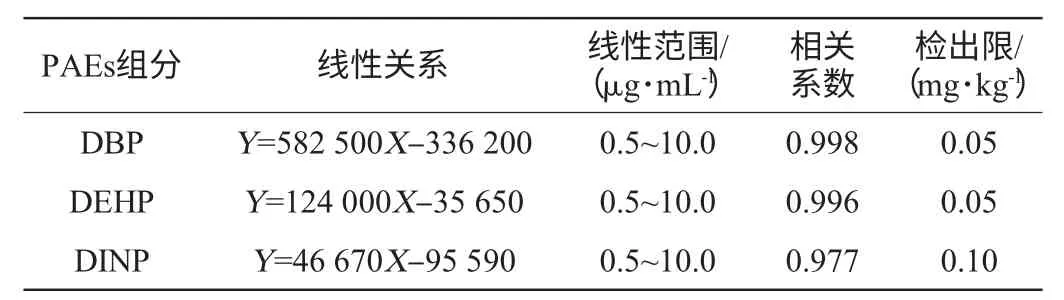
表5 所建方法的线性关系、线性范围、检出限Table 5 Linear relationship,linear range and detection limit of the methods
2.6 方法回收与精密度试验
称取5.0 g左右白酒样品,依次添加标准浓度为0.05 mg/kg、0.50 mg/kg、1.00 mg/kg的混合标准溶液。氮吹处理30 min,每个水平重复6次(n=6)。DBP、DEHP、DINP三种邻苯二甲酸酯的加标回收率和相对标准偏差检测结果见表6。
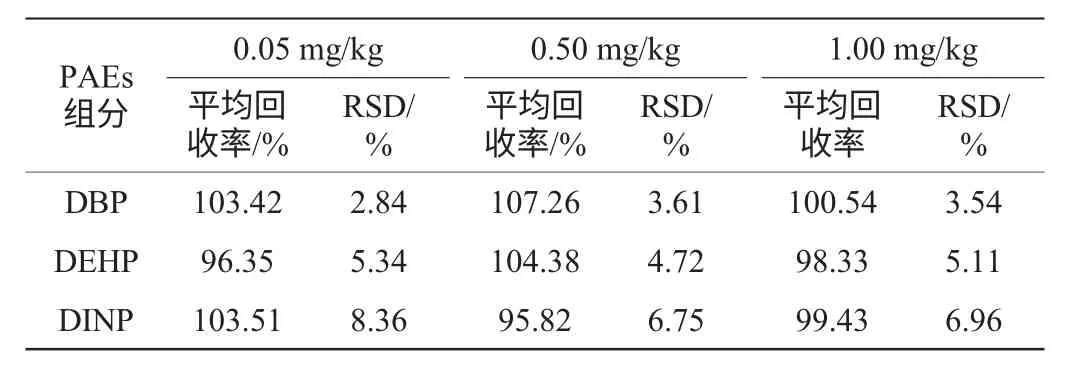
表6 三种邻苯二甲酸酯的加标回收率和相对标准偏差(n=6)Table 6 Adding standard recoveries and relative standard deviation (n=6) of three kinds of PAEs
由表6可知,平均回收率在95.82%~107.26%之间,高于国标方法85.38%~95.57%的平均回收率。RSD在2.84%~8.36%内,处在国标方法3.78%~10.99%的RSD范围之内。表明方法重现性较好,精密度性强,能满足白酒中常规检测项的检测要求。
2.7 活性炭过滤处理对塑化剂含量的影响
称取4份相同质量湘窖酒厂绵软二号酒样,一份不作处理,其余三份分别加入0.5‰、1.0‰、1.5‰的活性炭过滤处理。结果见表7。图4、图5分别为不作处理与1.5‰活性炭处理的色谱图。由图4、图5可知,用活性炭处理后,出峰组分减少,杂质峰干扰较少,能吸附部分组分。由表7可知,塑化剂的含量随着活性炭用量的增大依次降低,表明活性炭对塑化剂有较好的吸附作用,能够去除酒样中的部分杂质。可作为一种过滤方法降低酒中塑化剂的含量,减少塑化剂的危害。
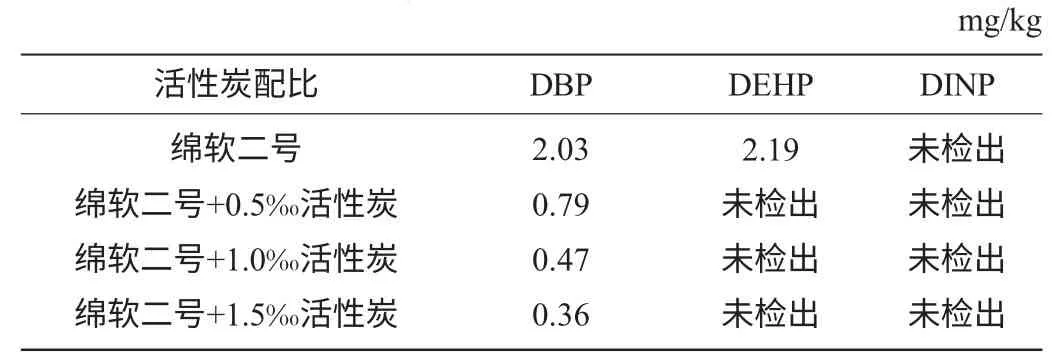
表7 不同配比活性炭处理酒样的塑化剂含量Table 7 Liquor phthalate content under different ratio of activated carbon treatment
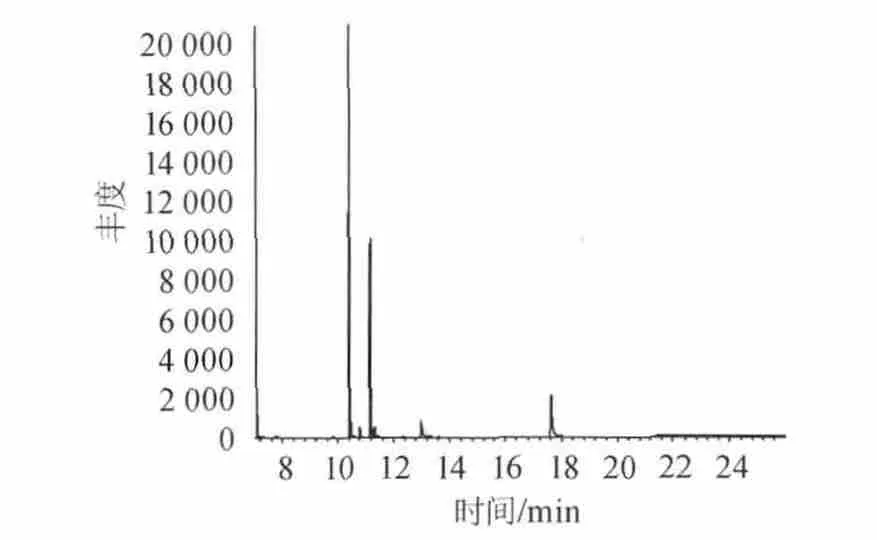
图4 绵软二号不作过滤处理的色谱图Fig.4 Chromatogram of Soft No.2 without filtering treatment
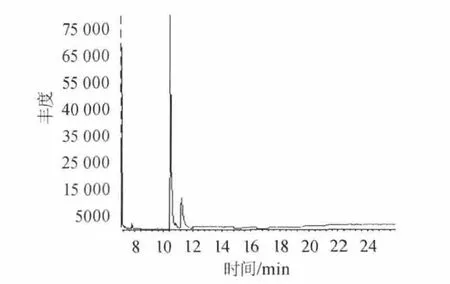
图5 绵软二号1.5‰活性炭处理的色谱图Fig.5 Chromatogram of Soft No.2 with 1.5‰ activated carbon treatment
2.8 实际酒样的测定及提出风险检测建议
利用水浴氮吹去除乙醇、正己烷与乙酸乙酯(比例4∶1)为溶剂,采取萃取进样方式对湘窖酒厂白酒的生产、包装、运输、仓储等环节采集酒样,进行PAEs残留量测定。每个监测点取3个样,结果见表8。
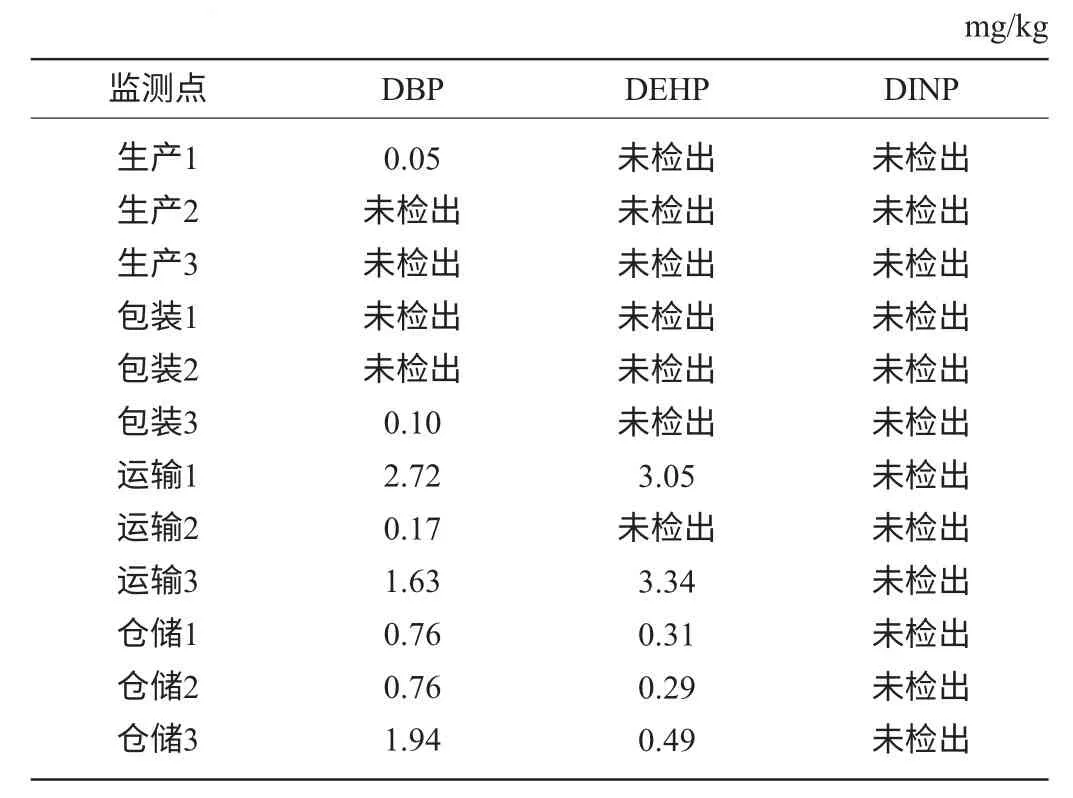
表8 不同生产工艺流程酒样的测定结果Table 8 Determination results of liquor sample under different production process
由表8可知,塑化剂主要存在于地下储存环节以及勾储车间的麻坛酒库中。而这两个工艺环节输入输出酒均用塑料管道,存在塑化剂迁移的风险。亟需建立白酒塑化剂风险评估制度更换存在塑化剂风险的塑料制品,采用不锈钢材料替代,对塑化剂超标的产品进行活性炭处理[15],使其符合标准,保证白酒的质量与安全。
3 结论
GC-MS法测定白酒塑化剂样品前处理优化方法是:乙醇去除方式为水浴氮吹;进样方式为萃取;溶剂为正己烷与乙酸乙酯比例4∶1。该法在0.5~10.0 μg/mL 范围内DBP,DEHP、DINP线性良好,线性相关系数分别为0.998、0.994、0.977。方法的检出限为0.05 mg/kg,添加量为0.05 mg/kg,0.50 mg/kg、1.00 mg/kg时,平均回收率为95.82%~107.26%,相对标准偏差RSD为2.84%~8.36%(n=6)。高于国标方法85.38%~95.57%的平均回收率。低于国标方法3.78%~10.99%的RSD。方法重现性好,精确度高。其线性关系、回收率、精密度均良好,适合白酒中DBP、DEHP、DINP残留量的日常检测。该法与国标方法相比,解决了单一溶剂提取效果差以及白酒中乙醇对质谱仪离子源灯丝造成损害的问题。实现了高回收率、高精确度、高稳定性的白酒塑化剂检测方法的探索研究,为白酒企业解决塑化剂检测问题提供理论依据。
[1]王 琨.食品中邻苯二甲酸酯的检测及迁移规律研究[D].天津:天津科技大学硕士论文,2009.
[2]FUJII M,SHINOHARA N,LIM A,et al.A study on emission of phthalate esters from plastic materials using a passive flux sampler[J].Atmos Environ,2003,37:5495-5504.
[3]LYCHE J L,GUTLEB A C,BERGMAN A,et al.Reproductive and developmental toxicity of phthalates[J].J Toxicol Environ Health,2009,12(4):225-249.
[4]彭学伟.单体同位素分析技术在邻苯二甲酸酯降解中的应用研究[D].青岛:中国海洋大学博士论文,2011.
[5]MATSUMOTO M,HIRATA-KOIZUMI M,EMA M.Potential adverse effects of phthalic acid esters on human health:A review of recent studies on reproduction[J].Regul Toxicol Pharm,2008,50(1):37-49.
[6]唐双双,朱新生.气质联用法分析镇江香醋中邻苯二甲酸酯类的分布情况[J].中国酿造,2013,32(5):150-153.
[7]詹万承.塑化剂风波的食品安全隐喻[J].行政事业资产与财务,2011(11):11-12.
[8]张前龙,王 宇,曹 云,等.食品塑料包装中酞酸酯类环境污染物气相色谱测定方法的研究[J].中国卫生检验杂志,2009,19(12):2833-2834.
[9]蒋平平.塑化剂风波与增塑剂行业对策[J].塑料助剂,2011,32(2):12-14.
[10]李羽翡,祖 新,刘 煜.GPC-GC-MS 法测定冰淇淋、果冻中的塑化剂[J].中国酿造,2013,32(6):150-153.
[11]王连珠,王瑞龙,刘溢娜,等.分散固相萃取-气相色谱-质谱法测定罐头食品中6 种邻苯二甲酸酯[J].理化检验:化学分册,2008,44(6):502-506.
[12]全国食品安全应急标准化工作组.GB/T 21911—2008 食品中邻苯二甲酸酯的测定[S].北京:中国标准出版社,2008.
[13]邵栋梁.GC-MS 法测定白酒中邻苯二甲酸酯残留量[J].化学分析计量,2010,19(6):33-35.
[14]黄艳梅,芦黎黎,等.GC-MS 法测定白酒中邻苯二甲酸二丁酯和邻苯二甲酸二(2-乙基)己酯[J].化学分析计量,2014,23(1):53-56.
[15]应全红,王 霓,白德奎,等.白酒中塑化剂GC-MS 检测方法研究[J].中国酿造,2013,32(11):141-143.

